苏教版化学必修二专题一复习
- 格式:ppt
- 大小:480.50 KB
- 文档页数:16

高一下学期苏教版化学必修2期末复习纲要(专题1-3)专题1微观结构与物质的多样性一、核外电子排布与周期性(1).原子结构1、电荷关系:2、质量关系3、原子组成:4、核素:5、同位素:(2).原子核外电子的排布1、电子分层排布:2、核外电子的排布规律:二.、元素周期律:(1)元素周期律(重点)1.化合价变化规律: 2.原子半径变化规律3.元素金属性和非金属性的递变A.元素的金属性和非金属性强弱的的判断依据(难点)B.元素性质随周期和同主族的变化规律(2)元素周期表的结构:“位,构,性”三者之间的关系(重难点)(3).元素周期表和元素周期律的应用:1.处于金属与非金属分界线附近的元素具有金属性又具有非金属性结构特点:数 = 数2.金属性最强的在周期表的左下角;非金属性最强的在周期表的右上角。
3.微粒半径大小的比较规律:三.微粒之间的相互作用1、化学键(重点):化学反应的本质:(1)离子键:存在于化合物中A.概念:B.离子化合物:注意:酸不是离子化合物。
离子键只存在离子化合物中,离子化合物中一定含有离子键。
(2)共价键:共价键的存在:单质:H2、X2、N2等(除)共价化合物:H2O、CO2、SiO2、H2S等复杂离子化合物:强碱、铵盐、含氧酸盐、过氧化物B.共价化合物:除离子化合物之外都是共价化合物(3).电子式:①.原子的电子式:②.阴阳离子的电子式:③.物质的电子式:NaOH Na2O2 NH4Cl N2 O2 CO2 NH3 CCl4 HClO C2H4 H2O2 H2O④.用电子式表示形成过程:2、分子间作用力:由分子构成的物质,分子间作用力是影响物质熔沸点和溶解性的重要因素。
3、相似的物质,越大,越大,越高3、从微观结构看物质的多样性(1)同素异形体: A.特点: B.实例:(2)同分异构体 A.特点: B.实例:①类别异构:碳原子数相同的:②碳链异构:如:③位置异构:如:(3)四类晶体的组成微粒、微观结构、作用力及性质差异。

高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构原子核中子(N个)1.原子数XAZ中子数(N)核外电子(Z个)注意:质量数(A)=质子数(Z)+中子数(N)=核电荷数=质子数=原子的核外电子★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca ★原子结构示意图和离子结构示意图的区别2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)例1 对原子核外电子运动状态的认识是有关原子结构中的重大成果,下列说法中不正确的是()A. 原子核外的电子是作无规律运动的B. 原子核外的电子运动是有规律的C. 可以近似认为原子核外电子是分层排布的D. 原子核外电子是清晰而又严格的分层排布的例2下列说法中肯定错误的是()A. 某原子K层上只有1个电子B. 某原子M层上电子数为L层电子数的4倍C. 某离子M层和L层上的电子数均为K层的4倍D. 某离子的核电荷数与最外层电子数相等4.元素的性质与原子最外层电子排布的关系例3下列说法正确的是()A. 非金属呈现的最高化合价不超过该元素原子的最外层电子数B. 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数C. 最外层有2个电子的原子都是金属原子D. 最外层有5个电子的原子都是非金属原子型化合物的是()例4下列各组指定原子序数的元素,不能形成AB2A. 6和8B. 16和8C. 12和9D. 11和16二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。


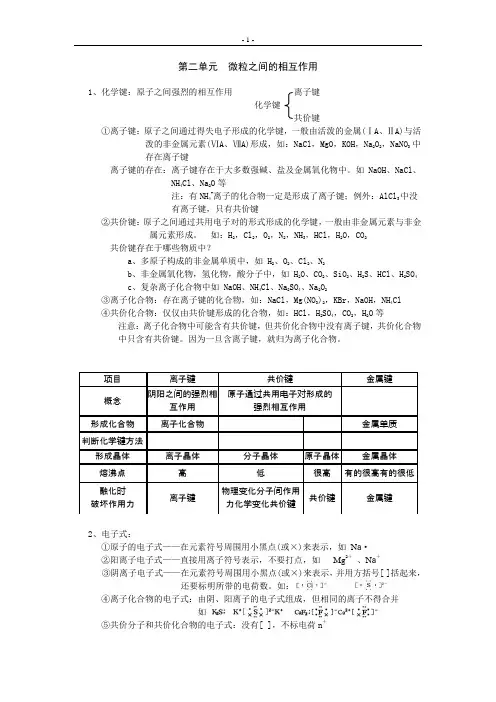
第二单元 微粒之间的相互作用1、化学键:原子之间强烈的相互作用离子键化学键共价键①离子键:原子之间通过得失电子形成的化学键,一般由活泼的金属(ⅠA 、ⅡA)与活泼的非金属元素(ⅥA 、ⅦA)形成,如:NaCl ,MgO ,KOH ,Na 2O 2,NaNO 3中存在离子键离子键的存在:离子键存在于大多数强碱、盐及金属氧化物中。
如NaOH 、NaCl 、NH 4Cl 、Na 2O 等注:有NH 4+离子的化合物一定是形成了离子键;例外:AlCl 3中没有离子键,只有共价键②共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素形成。
如:H 2,Cl 2,O 2,N 2,NH 3,HCl ,H 2O ,CO 2共价键存在于哪些物质中?a 、多原子构成的非金属单质中,如 H 2、O 2、Cl 2、N 2b 、非金属氧化物,氢化物,酸分子中,如 H 2O 、CO 2、SiO 2、H 2S 、HCl 、H 2SO 4c 、复杂离子化合物中如 NaOH 、NH 4Cl 、Na 2SO 4、Na 2O 2③离子化合物:存在离子键的化合物,如:NaCl ,Mg(NO 3)2,KBr ,NaOH ,NH 4Cl ④共价化合物:仅仅由共价键形成的化合物,如:HCl ,H 2SO 4,CO 2,H 2O 等注意:离子化合物中可能含有共价键,但共价化合物中没有离子键,共价化合物中只含有共价键。
因为一旦含离子键,就归为离子化合物。
2、电子式:①原子的电子式——在元素符号周围用小黑点(或×)来表示,如 N a ·②阳离子电子式——直接用离子符号表示,不要打点,如 Mg 2+ 、N a +③阴离子电子式——在元素符号周围用小黑点(或×)来表示,并用方括号[ ]括起来,还要标明所带的电荷数。
如:④离子化合物的电子式:由阴、阳离子的电子式组成,但相同的离子不得合并如⑤共价分子和共价化合物的电子式:没有[ ],不标电荷n +注:只有共价分子和共价化合物才有结构式,离子化合物没有结构式练习:写出下列物质的电子式:⑴、离子化合物:阴、阳离子的电子式结合即为离子化合物的电子式。

必修2期末复习提纲♦专题一微观结构与物质多样性【第一单元原了核外电了排布与元素周期律】一、原子核外电子排布:1、不同电了层的表不及能量关系(1)电子总是尽可能先排在能量 ____ 的电子层里,即最先排布 ____ 层,当 ___ 层排满后, 再排____ 层等。
(2) ____________________________ 原子核外各电子层最多容纳个电子。
(3) ____________________________ 原子最外层电子数不能超过______(K层为最外层时不能超过___________________________ ),次外层电子数不能超过____ 。
3、常见微粒结构示意图:氟原子:_______________ 氟离子:_________________氛原子:_______________镁原子:_______________ 镁离子:_________________原子:质子数=核外电子数=核电荷数=原子序数阳离子:____________________________________阴离了:___________________________________3、常见的10电子粒子:分子:___________________________________阳离子:____________________________________阴离子:____________________________________两个反应的离子方程式:二、元素周期律:1、周期性变化(1)随着原子序数的递增,元素原子最外层电子数呈 ______ 变化。
1—2 (1~2 号)J 1-—(3~10 号)-1-—(11-18 号)(2) _______________________________________________ 随着原子序数的递增,元素原子的半径呈现____________________________________________ 的周期性变化。

苏教版化学必修2复习纲要(专题1、3、4)专题1 微观结构与物质的多样性一、核外电子排布与周期性 (1).原子结构1、原子的质量主要集中在原子核上。
2、质子和中子的相对质量都近似为1,电子的质量可忽略。
3、原子序数 = 核电核数 = 质子数 = 核外电子数4、质量数(A )=质子数(Z )+中子数(N )5、在化学上,我们用符号AZ X 来表示一个质量数为A ,质子数为Z 的具体的X 原子。
如:的质子数与质量数,中子数,电子数之间的关系6、核素:把具有一定数目的质子和一定数目的中子的一种原子称为核素。
一种原子即为一种核素。
7、同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
或:同一种元素的不同核间互称为同位素。
①两 同:质子数相同、同一元素 ②两不同:中子数不同、质量数不同 ③属于同一种元素的不同种原子 (2).原子核外电子的排布1、在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。
电子总是尽先排布在能量最低的电子层里。
2、核外电子的排布规律①各电子层最多容纳的电子数是2n 2(n 表示电子层)②最外层电子数不超过8个(K 层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
③核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
二.、元素周期律 (1)元素周期律(重点) 1.核外电子层排布:随着原子序数的递增,每隔一定数目的元素,会重复出现原子“最外层电子从_______个递增到_________个的情况(K 层由1-2)而达到结构的变化规律。
2.最高正化合价和最低负化合价:随着原子序数的递增,每隔一定数目的元素,会重复出现原子最高价由+1 +7,中部出现负价,由-4 -1 的变化规律。
①O 、F 无正价,金属无负价②最高正化合价:+1→+7 最低负化合价:-4→-1→0 ③最高正化合价=最外层电子数=主族序数 ④最高正化合价+∣最低负化合价∣=________ 3.元素金属性和非金属性的递变A. 元素的金属性和非金属性强弱的的判断依据(难点)a. 单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性b. 最高价氧化物的水化物的碱性或酸性强弱原子AZ X原子核质子 Z 个中子 N 个=(A -Z )个核外电子 ZZAn Rc. 单质的还原性或氧化性的强弱(注意:单质与相应离子的性质的变化规律相反)B. 第三周期元素的变化规律和碱金属族元素的变化规律(包括物理、化学性质)1.2Na + 2H2O =2NaOH + H2↑(容易) Mg + 2 H2O 2Mg(OH)2 + H2↑(较难)金属性:Na > Mg2.Mg + 2HCl =MgCl2+ H2↑(容易) 2Al + 6 HCl =2AlCl3 +3H2↑(较难)金属性:Mg > Al 根据1、2得出:金属性Na > Mg > Al3.碱性 NaOH > Mg(OH)2> Al(OH)3 金属性:金属性Na > Mg > AlNa Mg Al金属性逐渐减弱4.结论:Si P S Cl单质与H2的反应越来越容易生成的氢化物越来越稳定最高价氧化物对应水化物的酸性逐渐增强故:非金属性逐渐增强。
](https://uimg.taocdn.com/204ba3f252d380eb63946d07.webp)
苏教版高中化学必修二知识点总结(专题一、二)[1](word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(苏教版高中化学必修二知识点总结(专题一、二)[1](word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为苏教版高中化学必修二知识点总结(专题一、二)[1](word版可编辑修改)的全部内容。
高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1 A X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2。
原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低)二三四五六七对应表示符号: K L M N O P Q3。
元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称.核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。


元素周期律与元素周期表【双基盘点】1.原子序数与元素的原子结构之间存在着好下关系:原子序数= == 。
2.核素是指 ; 互称同位素,即之间的互称。
3.表示特定原子的符号为X AZ ,该原子中质子数是 ,质量数是 ,中子数是 ,核外电子数是 。
4.元素周期表的结构(1)周期①具有 的横行,叫做一个周期;② 周期有分类:短周期(第 周期) ,长周期(第 周期)和不完全周期(第周期)(2)族:在元素周期表中,共有 个纵行, 族,其中 个主族, 个副族, 个0族, 个第VIII 族。
5.随着原子序数的递增, 都呈现周期性变化。
人们把 这一规律叫做元素周期律。
6.元素的化学性质主要取决 。
同一周期自左向右,元素的金属性逐渐 ,非金属性逐渐 ;同一主族自上而下,元素的金属性逐渐 ,非金属性逐渐 。
7.周期序数= ;主族序数=画出1~18号元素在周期表中的相对位置图:画出1~18号元素原子结构示意图:AB C8.如何比较元素的金属性、非金属性?(1)比较元素金属性强弱的方法(2)比较元素非金属性强弱的方法例1A、B、C为短周期元素,在周期表中所处位置如下图所示。
A、C两元素的原子核外电子数之和等于B原子的质子数。
B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称、、。
(2)B位于元素周期表第周期,第族。
(3)C的原子结构示意图为。
(4)比较B、C的的原子半径,B C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式。
例2下列各组元素性质的递变情况错误的是()A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正价依次升高C.N、O、F原子半径依次增大D.Na、K、Rb的电子层数依次增多例3 下列叙述中能肯定说明金属A比金属B的活泼性强的是()A.A原子的最外层电子数比B原子的最外层电子数少B.A原子电子层数比B原子电子层数多C.1mol A从酸中置换出的H2比1molB从酸中置换的H2多D.常温时,A能从酸中置换出氢,而B不能练习巩固1.下列元素中金属性最强的是()A.K B.Na C.Al D.Mg2.常用于测定动植物标本的年龄。

(完整版)苏教版⾼中化学必修⼆知识点总结(专题⼀、⼆)⾼中化学必修2知识点归纳总结第⼀单元原⼦核外电⼦排布与元素周期律⼀、原⼦结构质⼦(Z个)原⼦核注意:中⼦(N个)质量数(A)=质⼦数(Z)+中⼦数(N)1.X 原⼦序数=核电荷数=质⼦数=原⼦的核外电⼦核外电⼦(Z个)★熟背前20号元素,熟悉1~20号元素原⼦核外电⼦的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原⼦核外电⼦的排布规律:①电⼦总是尽先排布在能量最低的电⼦层⾥;②各电⼦层最多容纳的电⼦数是2n2;③最外层电⼦数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电⼦数不超过32个。
电⼦层:⼀(能量最低)⼆三四五六七对应表⽰符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同⼀类原⼦的总称。
核素:具有⼀定数⽬的质⼦和⼀定数⽬的中⼦的⼀种原⼦。
同位素:质⼦数相同⽽中⼦数不同的同⼀元素的不同原⼦互称为同位素。
(对于原⼦来说)⼆、元素周期表1.编排原则:①按原⼦序数递增的顺序从左到右排列②将电⼦层数相同..。
(周期序数=原⼦的电⼦层数)......的各元素从左到右排成⼀横⾏③把最外层电⼦数相同..。
........的元素按电⼦层数递增的顺序从上到下排成⼀纵⾏主族序数=原⼦最外层电⼦数2.结构特点:核外电⼦层数元素种类第⼀周期 1 2种元素短周期第⼆周期 2 8种元素周期第三周期 3 8种元素元(7个横⾏)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵⾏)第Ⅷ族:三个纵⾏,位于ⅦB和ⅠB之间(16个族)零族:稀有⽓体三、元素周期律1.元素周期律:元素的性质(核外电⼦排布、原⼦半径、主要化合价、⾦属性、⾮⾦属性)随着核电荷数的递增⽽呈周期性变化的规律。
高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
苏教版高一化学必修2复习纲要专题1 微观结构与物质的多样性复习纲要一、原子结构与元素原子核外电子排布规律 (一)、原子结构:原子的表示方法:X A Z ,其中X 是原子符号,A 表示质量数,Z 表示质子数。
原子:核电荷数= = =原子序数 质量数= + ≈相对原子质量阳离子:(a A m+)核外电子数=质子数 - 所带电荷数,即核外电子数=a-m 阴离子:(b B n-)核外电子数=质子数 + 所带电荷数,即核外电子数=b+n (二)、同位素: 叫同位素。
(要点)两同:质子数相同,同种元素;两不同:中子数不同,不同原子. (三)、核外电子排布规律在含有多个电子的原子中,能量低的电子通常在离核较 的区域内运动,能量高的电子通常在离核较 的区域内运动。
据此可以认为:电子在原子核外距核由 到 ,能量是由低到高的方式进行排布。
通常把能量最 、离核最 的电子层叫第一层,由里往外以此类推,共有 个电子层,分别用字母 、 、 、 、 、 、 表示,每层最多容纳的电子数为 个。
而最外层电子数不得超过 个(K 层为最外层时,电子数不超过2个),次外层不得超过18个。
(四)、画出1-20号元素的原子结构示意图和离子结构示意图 请画出以下粒子的结构示意图二、原子结构、元素周期律、元素周期表的关系(一)、原子结构与元素周期表的关系核电荷数===原子序数周期序数=;最高正价+|最低负价|=8主族序数=最外层电子数=最高正价(O、F除外)周期表结构现行元素周期表的编排原则与特点:周期:每个横行称为周期;同周期,最外层电子数从1增加到8。
(第一周期除外)族:每个纵行称为族;同主族,最外层电子数相同。
注意:一定要记住主族的表示方法。
(二)、元素周期律:随着原子序数的递增,元素的原子半径(除稀有气体元素外)、元素的金属性和非金属性、元素的主要化合价(最高化合价与最低化合价)都呈现周期性变化。
元素的性质随着核电荷数的递增而呈现周期性变化的规律叫做元素周期律。
苏教版高中化学必修二知识点总结(专题一、二)(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(苏教版高中化学必修二知识点总结(专题一、二)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为苏教版高中化学必修二知识点总结(专题一、二)(word版可编辑修改)的全部内容。
高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2。
原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低) 二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。