药物临床试验常用表13 研究者手册内容目录样版
- 格式:pdf
- 大小:74.59 KB
- 文档页数:4
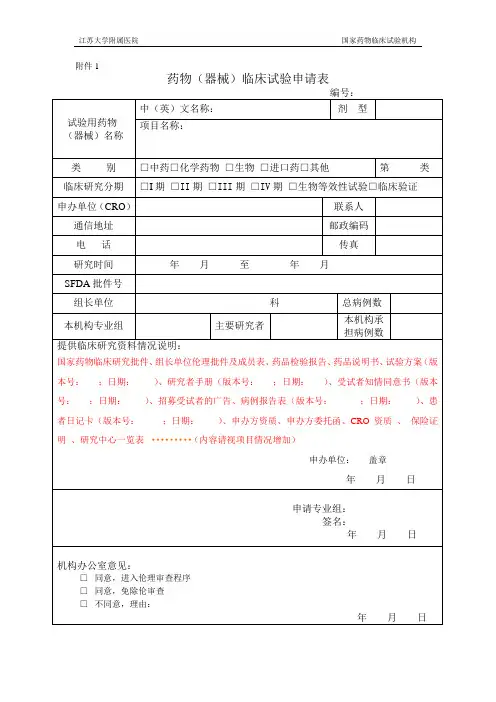
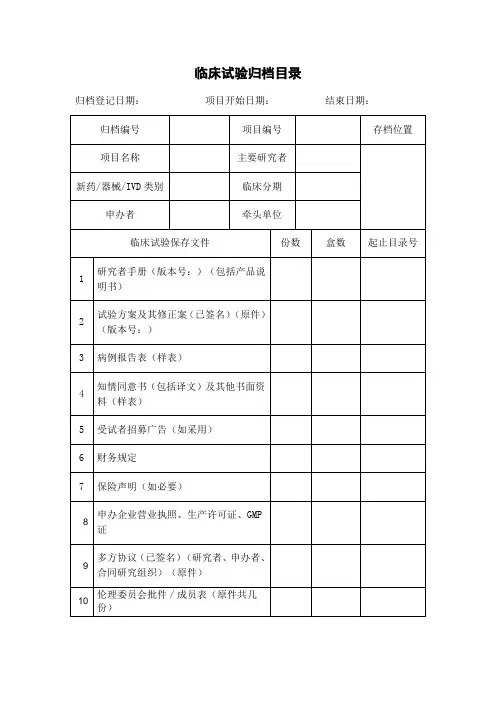

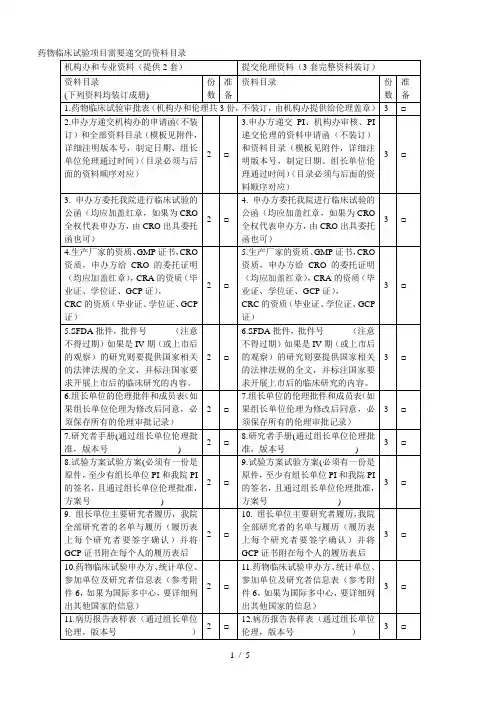
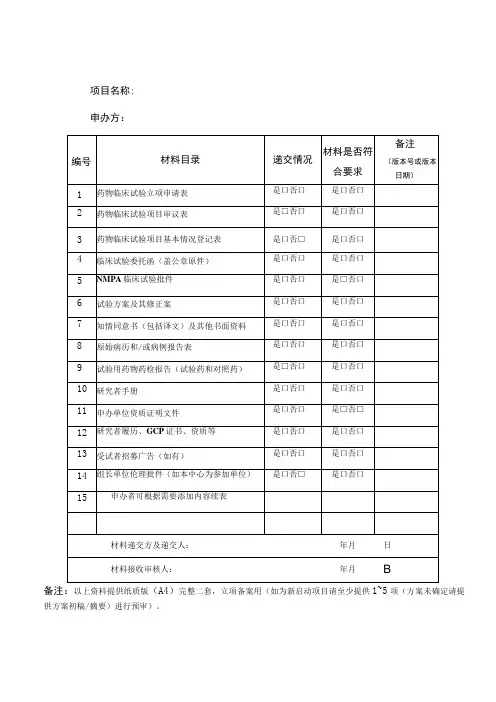
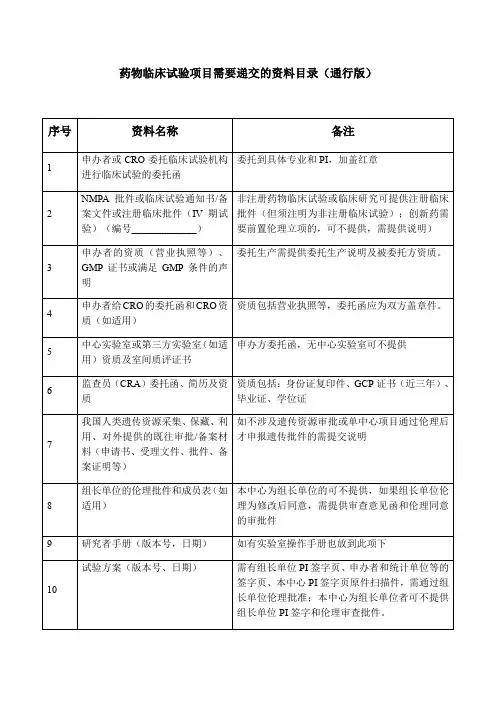
药物临床试验项目需要递交的资料目录附件2:药物临床试验申办方、统计单位、参加单位以及研究者信息表(国内项目国际多中心项目)(注:若为国际多中心项目,请先填写国际多中心的内容,国内项目可以不填)附件3:申办方前期提交机构办的备案资料封面模板试验药物名称:______________________________________药物临床试验批件号:________________________________药物临床试验方案号:________________________________我机构专业的中心号:________________________________(除项目名称用三号字居中之外,其余内容均用小四号字,1.5倍行距)项目名称(三号字,居中)青岛大学附属医院机构办备案资料手机号码:_______________________________电子邮箱:_______________________________传真;___________________________________所属部门和职务:_________________________详细通讯地址:___________________________邮政编码:_______________________________备案单位:_______________________________(加盖公章)备案单位性质:□申办方□CRO □其他________________备案时间:年月日项目名称xxxx药物临床试验资料目录资料目录请按照附件1中的目录排列,有版本号的必须注明版本号,制定日期,中心伦理通过时间.(该目录最终版本必须与相关资料顺序对起来)机构备案资料递交申请函青岛大学附属医院国家药物临床试验机构管理办公室:兹有青岛大学附属医院国家药物临床试验机构________专业申请参加一项____________________________________________________公司的多中心II期临床试验:_______________________________________________________我院为□组长单位(□参加单位),主要研究者为:__________。

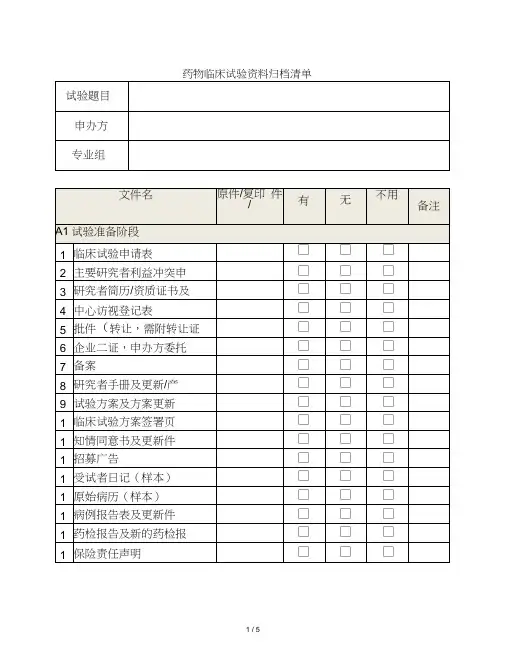
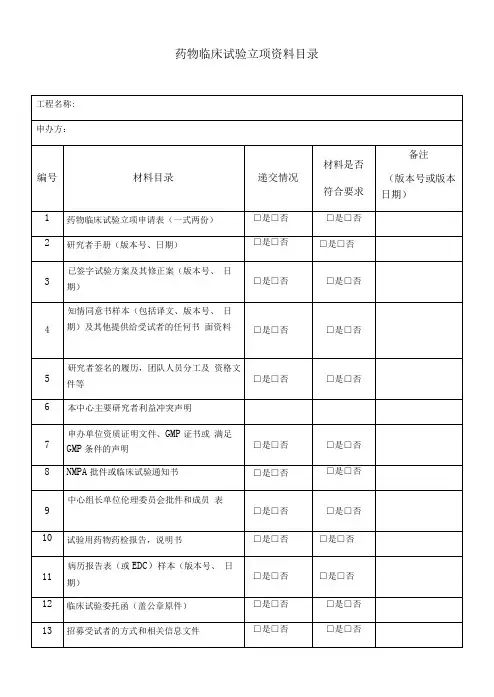
药物临床试验立项资料目录备注:1、以上资料提供纸质版(A4)完整二套,用分页夹装好,立项备案用。
2、第3项已签字试验方案及其修正案:至少包含申办者签字盖章、本中心主要研究者签字。
3、第4项中“其他提供给受试者的任何书面资料”,如有,需提供。
如受试者须知等宣教材料,受试者日记卡,受试者评分表等。
4、第5项研究者签名的履历,团队人员分工及资格文件包括:研究者签名的履历,团队人员分工及研究者的执业证书、注册证、职称证、毕业证、GCP证书等复印件。
5、第7项申办单位资质证明文件、GMP证书或满足GMP条件的声明,假设委托生产需提供委托生产说明及被委托方资质。
6、第14项受试者保险的相关文件:如有,需提供。
证明受试者发生与试验相关损害时,可获得补偿或赔偿。
5、第15项CRO相关资质证明文件及委托函:包括企业三证、委托函等。
6、第18项盲法试验的揭盲程序文件:假设未在试验方案中说明,需单独提供。
7、第19项抚慰剂对照说明:试验选择抚慰剂对照情况,需提供选择抚慰剂作为对照的原因说明。
附件2药物临床试验立项申请表立项编号:日期:附件3临床试验工程审评表机构受理号:工程名称申办方/CRO :机构办公室审查审查意见送审日期:审查结论日期:处理意见:区通知申办方和主要研究者区交我院伦理委员会审批区一式二份(一份机构办公室存档,一份伦理委员会备案)口同意临床试验机构办公室审查意见: □不同意临床试验签名: 口补充临床试验相关资料后再审专业组工程研究团队分工表工程分工:1.工程负责人/主要研究者2.研究者3.质控员4.试脸药物管理员5.其他,请描述。