异构现象与立体异构
- 格式:ppt
- 大小:5.21 MB
- 文档页数:2


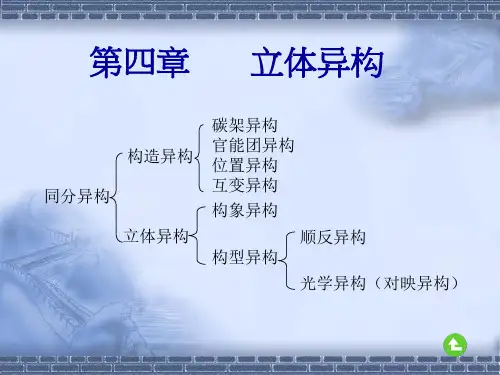
同分异构现象的分类同分异构现象是指在化学反应中,由于反应物的结构不同而导致产物的结构也不同的现象。
根据不同的原因,同分异构现象可以分为构造异构现象、空间异构现象和立体异构现象三种类型。
构造异构现象是指分子式相同但结构不同的同分异构体。
这种现象是由于原子在分子中的连接方式不同所导致的。
例如,乙醇和乙醚就是一对构造异构体。
乙醇的分子式为C2H6O,它由一个碳原子、一个氧原子和六个氢原子组成,其中碳原子与氧原子之间通过单键连接。
而乙醚的分子式也是C2H6O,但它由一个碳原子、两个氧原子和六个氢原子组成,其中碳原子与两个氧原子之间通过一个氧原子上的双键连接。
这两种化合物在物理性质和化学性质上都有明显的差异,如乙醇具有独特的酒精味和溶解性,而乙醚则具有特殊的麻醉作用。
空间异构现象是指分子式和结构相同但空间构型不同的同分异构体。
这种现象是由于分子在空间中的排列方式不同所导致的。
例如,左旋和右旋的丙氨酸就是一对空间异构体。
它们的分子式都是C3H7NO2,结构上只有一个手性碳原子,但它们的空间构型不同。
左旋丙氨酸的空间构型是左旋的,而右旋丙氨酸的空间构型是右旋的。
这两种异构体在生物活性和药理学上有着明显的差异,如左旋丙氨酸是人体必需氨基酸的一种,而右旋丙氨酸则具有放射性和毒性。
立体异构现象是指分子式和结构相同但立体构型不同的同分异构体。
这种现象是由于分子中的键的旋转或翻转所导致的。
例如,顺丁烯和反丁烯就是一对立体异构体。
它们的分子式都是C4H8,结构上都是由四个碳原子和八个氢原子组成,但它们的立体构型不同。
顺丁烯的碳链是直线型的,而反丁烯的碳链则是呈现折叠状。
这两种异构体在物理性质和化学性质上也有着明显的差异,如顺丁烯具有较高的沸点和熔点,而反丁烯则具有较低的沸点和熔点。
同分异构现象不仅在有机化学中广泛存在,也在无机化学和生物化学中有所体现。
在有机化学中,同分异构现象使得我们能够合成不同性质的化合物,从而拓宽了化学的应用领域。

有机化学中的同分异构同分异构体包括构造异构体与立体异构体而构造异构体中包括碳架异构、位置异构、官能团异构。
立体异构又包括构象异构与构型异构。
(一)立体异构一、构象异构1、定义由于高分子链的构象不同所造成的异构体,又称内旋转异构体。
注:(1)小分子的稳定构象数=3^(n-3) (n为分子中单键碳原子数目,n>2)(2)高分子的可实现构象数远小于3^(n-3),但一个高分子的可实现构象数远多于一个小分子的稳定构象数(因高分子的n值很大)。
2、构象与构型的主要区别(1)、从起因方面瞧,构象就是由单键内旋转所造成的原子空间排布方式;构型就是由化学键所固定的原子空间排列方式。
(2)、从改变方面瞧,构象发生改变时不虚破坏化学键,所需能量较少(有时分子的热运动就足够),较易于改变;而构型发生改变时需要破坏化学键,所需能量较大,不轻易改变。
(3)、从分离方面瞧,不同的构象不能用化学的方法分离,而不同构型可以用化学的方法分离。
(4)、从数目方面瞧,稳定构象数只具有统计性,且稳定构象数远多于有规构型数;而有规立构的构型数目可数。
3、晶体中的高分子链构象晶体中的分子链构象有螺旋形构象、平面锯齿形构象等。
(1)、两个原子或基团之间距离小于范德华半径之与时,将产生排斥作用。
(2)、分子链在晶体中的构象,取决于分子链上所带基团的相互排斥或吸引作用的情况。
(3)、有规立构高分子链在形成晶体时,在条件许可下总就是尽量形成时能最低的构象形式。
(4)、基本结构单元中含有两个主链原子的等规聚合物,大多倾向于形成螺旋体构象。
(5)、若存在分子内氢键,将影响分子链的构象。
4、溶液中的高分子链构象(1)、高分子溶液中,除了刚性很大的棒状分子之外,柔性分子链大多都呈无规线团状。
(2)、当呈螺旋形构象的高聚物晶体溶解时,可由棒状螺旋变成部分保持棒状螺旋小段的线团状构象。
二、构型异构构型异构:就是原子在大分子中不同空间排列所产生的异构现象。




同分异构现象分为三类:构造异构、立体异构和电子互变异构
构造异构包括:碳架异构(比如正丁烷和异丁烷)、位置异构(比如1-丙醇和2-丙醇)、官能团异构(比如丙醛和丙酮)、互变异狗(比如葡萄糖和果糖)、价键异构(比如苯和杜瓦苯),显然这些异构产生的原因都是因为化学键之间的不同形成的
立体异构包括:构型异构(顺反异构、旋光异构)、构象异构(比如交叉型和重叠型),显然这些异构产生的原因都是因为原子的对称中心或者对称面两端不对称所致。
同分异构现象----立体异构一、构象异构定义:构象异构:由于单键的自由旋转使分子中的原子或原子团在空间产生不同的排列形式。
特点:由于单键的自由旋转,乙烷可以有无数的构象优势构象:是交叉式稳定性顺序:对位交叉式> 邻位交叉式> 部分重叠式> 全重叠式a C a Cb d aC a C db C*COOHHH 3COH二、构型异构 (一)顺反异构1、产生条件:①分子中存在限制旋转的因素,如双键或脂环。
②每个不能自由旋转的碳原子必须连有2个不同的原子或原子团。
2、顺反异构命名:2个相同原子或原子团处于 π 键或脂环平面同侧的异构体称为顺式,处于异侧的称为反式。
3、E 命名法:先根据次序规则确定连接在双键碳原子上的原子或原子团的大小顺序。
当2个较大的原子或原子团在双键的同侧时,为Z 构型,在异侧的为E 构型。
● E 命名法次序规则a) 与双键直接相连的原子按原子序数大小排列,序数大的为大基团;同位素按质量大小排列(如D > H ) b) 如与双键碳直接相连的2个原子相同,则向外延伸,比较其次相连原子的原子序数,以确定原子团的大小序数。
c) 当与双键相连的为不饱和基团时,如 ,看作碳2次与氧相连。
例如(二)对映异构定义:两个分子成镜面对称,但又不能完全重叠,我们把这两个分子称为一对对映体,它们成对映异构(或旋光异构)。
1、手性手性:实物与镜像不能完全重叠的性质叫手性。
具有手性的分子叫手性分子。
● 只有手性分子才有旋光异构现象。
● 有机化合物分子具有手性。
最普遍的因素有手性碳C* ● 手性碳原子是指连接4个不同的原子或原子团的碳原子2、外消旋体与对映体 乳酸有两种构型(如下),它们互为实物与镜象,称为对映体,等量的这两种构型的混合物称为外消旋体。
C O H。
转动180酒石酸3. 如何表示对映体的构型?费歇尔(Fisher )投影式:主链放在竖键上,编号最小的碳原子放在上端。
竖键连接的原子或原子团表示伸向纸的后方,横键连接的原子或原子团表示伸向纸的前方。
有机化学立体化学一、引言有机化学是研究碳化合物及其衍生物的化学分支,而立体化学是有机化学的一个重要分支,主要研究有机化合物的立体结构、立体异构现象以及立体化学在有机反应中的应用。
在有机化学中,立体化学占据着举足轻重的地位,因为许多有机化合物的性质和反应都与它们的立体结构密切相关。
本文将简要介绍有机化学立体化学的基本概念、立体异构现象以及立体化学在有机反应中的应用。
二、立体化学基本概念1.立体结构:立体结构是指分子中原子在空间的排列方式。
在有机化学中,立体结构可以分为两类:构型和构象。
构型是指分子中原子固定的空间排列方式,如顺式异构和反式异构;构象是指分子中原子在空间可以自由旋转的排列方式,如船式构象和椅式构象。
2.立体异构:立体异构是指分子式相同、结构式不同的有机化合物。
立体异构体可以分为两类:对映异构体和非对映异构体。
对映异构体是指具有镜像对称关系的立体异构体,如左旋体和右旋体;非对映异构体是指不具有镜像对称关系的立体异构体,如顺式异构和反式异构。
三、立体异构现象1.对映异构:对映异构体是指具有镜像对称关系的立体异构体。
在有机化学中,对映异构体的存在导致了化合物的旋光性质。
旋光性质是指有机化合物能使偏振光旋转一定的角度。
对映异构体的旋光方向相反,旋光角度相等。
对映异构体的分离和制备是有机化学中一个重要的研究方向。
2.非对映异构:非对映异构体是指不具有镜像对称关系的立体异构体。
在有机化学中,非对映异构体的存在导致了化合物的化学性质和物理性质的不同。
非对映异构体的分离和制备也是有机化学中一个重要的研究方向。
四、立体化学在有机反应中的应用1.立体选择性反应:在有机反应中,立体选择性反应是指反应物优先与某种立体异构体发生反应。
立体选择性反应可以通过选择适当的反应条件和催化剂来实现。
立体选择性反应在合成手性化合物中具有重要意义。
2.立体专一性反应:在有机反应中,立体专一性反应是指反应物只与某种立体异构体发生反应。
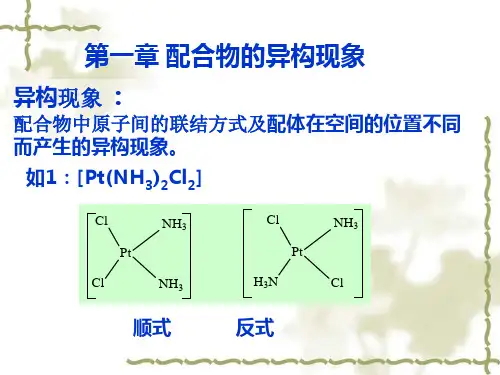
第二节配合物的几何结构与异构现象一.知识储备1.配离子或配分子的空间结构根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构2.配合物的异构现象化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物MA 2B 2型平面四边形配合物有顺式和反式两种异构体。