配合物的结构及异构现象
- 格式:doc
- 大小:1.98 MB
- 文档页数:43










第二章配合物的结构及异构现象第一节配位数与配位多面体配位多面体:把围绕中心原子的配位原子看作点,以线按一定的方式连接各点就得到配位多面体。
用来描述中心离子的配位环境。
1、配位数为2理想构型为直线型结构,大多限于Cu(I)、Ag(I)、Au(I)和Hg(II)的配合物。
如:[Ag(NH3)2]+2、配位数为3理想构型为等边三角形结构。
如:[HgI3]−3、配位数为41)四面体构型 2) 平面正方形构型[NiCl4]2−[Ni(CN)4]2−[Zn(NH3)4]2+[Pt(NH3)4]2+4、配位数为51)三角双锥构型 2) 四方锥构型[Fe(CO)5] [InCl5]2−[CuCl5]3−5、配位数为6八面体构型三棱柱构型[Co(NH3)6]3+Re(S2C2Ph2)36、配位数为71)五角双锥构型如 [ZrF7]3−2)单面心三棱柱构型3)单面心八面体构型7、配位数为81)四方反棱柱。
如 [Sr(H2O)8]2+2)三角十二面体。
如 [Co(NO3)4]2-8、配位数大于8的情况多出现在镧系及锕系金属配合物中。
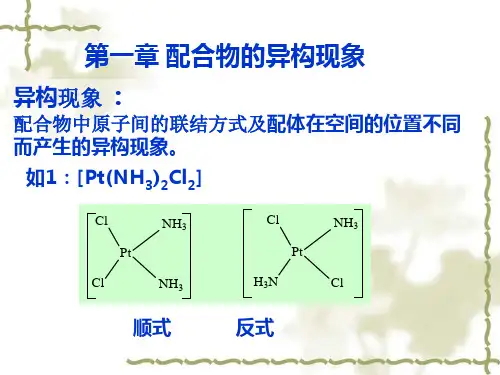
为什么?N H N NNNNHN H NNNHNOOOONHNNNHNLa第二节几何异构现象 (geometrical isomerism)几何异构:由于配体在空间的位置不同而产生的异构现象。
1.平面正方形配合物 1)[Pt(NH 3)2Cl 2]PtCl ClH 3NH 3NPtNH 3ClClH 3N顺式反式ClNH 3H 3N Cl2)[Pt(NH 3)(py)ClBr]PtPy BrClH 3NPt PyNH 3ClBrH平面正方形配合物几何异构体数目配合物类型 MA 4 MA 3B MA 2B 2 MA 2BC MABCD异构体数目 1 1 2 2 32.八面体构型的配合物[Co(NH3)4Cl2]+的几何异构体:有两种几何异构体:NH3NH3Cl NH3ClNH3NH3NH3H3NNH3ClCl顺式(绿色)反式(紫色)[Rh(py)3Cl3]:Py PyCl ClClPyPyPyCl PyClCl面式(facial)经式(meridional))[Co(en)2Cl2]+ (en = H2NCH2CH2NH2):N H2H2 NN H2NH2ClClNH2NH2Cl ClH2NH2N反式顺式八面体配合物几何异构体数目类型MA6 MA5B MA4B2 MA3B3 MA4BC数目 1 1 2 2 2类型MA3B2C MA2B2C2 MABCDEF数目 3 5 153、几何异构体的鉴别方法1)偶极矩偶极矩:μ= q x l如:例:Pt(II)配合物的偶极矩(Debye): 顺式NH 3NH 3ClPtCl反式[Pt(NH3)2Cl2] 8.7 02)红外光谱cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2]cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2] 3)紫外-可见光谱法cis-和trans-[Co(en)2Cl(NO2)]+的紫外-可见光谱4) X射线衍射法可确定原子在空间的三维坐标。
第4章配合物4.1 复习笔记一、配合物的基本概念1.配合物的定义配位化合物简称配合物,又称络合物,是一大类化合物的总称。
2.配合物的组成(1)形成体①中心离子(或中心原子)称为配合物的形成体;②中心离子大多数是带正电荷的金属阳离子,以过渡金属离子居多,如Mn2+、Fe3+、Co2+、Ni2+、Cu2+、Ag+等;少数高氧化态的非金属元素也可作中心离子,如[BF4]-、[SiF6]2-中的B(Ⅲ)、Si(Ⅳ)等;③中心原子如[Ni(CO)4]、[Fe(CO)5]中的Ni、Fe原子。
(2)配位个体、配体及配位原子①由形成体结合一定数目的配体所形成的结构单元称为配位个体,即配合物的核心部分;②在配合物中与形成体结合的离子或中性分子称为配体;③在配体中提供孤电子对与形成体形成配位键的原子称为配位原子。
(3)配体分类根据配体中所含配位原子数目的不同,可分为单齿配体和多齿配体。
①单齿配体:一个配体中只有一个配位原子,如NH3、OH-、X-、CN-、SCN-等;②多齿配体:一个配体中有两个或两个以上的配位原子。
(4)配位数①定义配位数是指在配位个体中与一个形成体形成配位键的配位原子的总数。
②配位数与配体的关系a.由单齿配体形成的配合物,中心离子的配位数等于配体的数目;b.若配体是多齿的,那么配体的数目不等于中心离子的配位数。
③形成体和配体的性质对配位数的影响a.中心离子正电荷越多,配位数越大;b.中心离子半径较大时,其周围可容纳较多的配体,易形成高配位的配合物,但是中心离子半径若过大时,有时配位数反而减小;c.配体的负电荷越多,配位数减小;d.配体的半径增大时,中心离子周围可容纳的配体数减少,配位数减小;e.配体浓度大、反应温度低,易形成高配位配合物。
(5)配离子的电荷配离子的电荷为形成体和配体电荷的代数和。
3.配合物的化学式及命名(1)配合物的化学式①含配离子的配合物,其化学式中阳离子写在前,阴离子写在后;②配位个体中,先列出形成体的元素符号,再依次列出阴离子和中性配体;③无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括在方括号内;④在括号内同类配体的次序,以配位原子元素符号的英文字母次序为准。
第二章配合物的结构及异构现象第一节配位数与配位多面体配位多面体:把围绕中心原子的配位原子看作点,以线按一定的方式连接各点就得到配位多面体。
用来描述中心离子的配位环境。
1、配位数为2理想构型为直线型结构,大多限于Cu(I)、Ag(I)、Au(I)和Hg(II)的配合物。
如:[Ag(NH3)2]+2、配位数为3理想构型为等边三角形结构。
如:[HgI3]−3、配位数为41)四面体构型 2) 平面正方形构型[NiCl4]2−[Ni(CN)4]2−[Zn(NH3)4]2+[Pt(NH3)4]2+4、配位数为51)三角双锥构型2) 四方锥构型[Fe(CO)5][InCl5]2−[CuCl5]3−5、配位数为6八面体构型三棱柱构型[Co(NH3)6]3+Re(S2C2Ph2)36、配位数为71)五角双锥构型如[ZrF7]3−2)单面心三棱柱构型3)单面心八面体构型7、配位数为81)四方反棱柱。
如[Sr(H2O)8]2+2)三角十二面体。
如[Co(NO3)4]2-8、配位数大于8的情况多出现在镧系及锕系金属配合物中。
为什么?N H N NNNNHN H NNNHNOOOONHNNNHNLa第二节几何异构现象(geometrical isomerism)几何异构:由于配体在空间的位置不同而产生的异构现象。
1.平面正方形配合物 1)[Pt(NH 3)2Cl 2]PtCl ClH 3NH 3NPtNH 3ClClH 3N顺式反式ClNH 3H 3N Cl2)[Pt(NH 3)(py)ClBr]PtPyBrClH 3NPtPyNH 3ClBrH平面正方形配合物几何异构体数目配合物类型MA4MA3B MA2B2 MA2BC MABCD异构体数目 1 1 2 2 32.八面体构型的配合物[Co(NH3)4Cl2]+的几何异构体:有两种几何异构体:NH3NH3Cl NH3ClNH3NH3NH3H3N NH3ClCl顺式(绿色)反式(紫色)[Rh(py)3Cl3]:Py PyCl ClClPyPyPyClPyClCl面式(facial)经式(meridional))[Co(en)2Cl2]+ (en = H2NCH2CH2NH2):N H2H2 NN H2NH2ClClNH2NH2Cl ClH2NH2N反式顺式八面体配合物几何异构体数目类型MA6MA5B MA4B2 MA3B3MA4BC数目 1 1 2 2 2类型MA3B2C MA2B2C2 MABCDEF数目 3 5 153、几何异构体的鉴别方法1)偶极矩偶极矩:μ= q x l如:例:Pt(II)配合物的偶极矩(Debye): 顺式反式[Pt(NH 3)2Cl 2] 8.7 02)红外光谱cis-[PtCl 2(NH 3)2]NH 3NH 3ClPtCltrans-[PtCl2(NH3)2]cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2] 3)紫外-可见光谱法cis-和trans-[Co(en)2Cl(NO2)]+的紫外-可见光谱4) X射线衍射法可确定原子在空间的三维坐标。
N N CO2N第三节旋光异构现象(optical isomerism)1、旋光异构及其与对称性的关系1)旋光异构体(对映异构体):CHClBrI。
CHBrClICHBrClI四面体型NH3PyCl BrNH3PyClBrPtPt平面正方形2)分子具有旋光异构体的对称性判据可以证明:分子具有旋光异构体的充分必要条件是该分子不具备任意次的旋转反映轴(非真轴)S n。
例:CCl4具有S4轴。
CCl ClClClS4ClClClClS4ClClClCl ClClClClc4特例:S1=σ(对称面)S2=i (对称中心)因此具有对称面或对称中心的分子不存在旋光异构体。
2、旋光异构体实例* 平面正方形配合物不存在旋光异构体。
1)[Co(NH3)2(H2O)2Cl2]+:共有5个几何异构体,其中4个无旋光异构体H2O H2OH3N ClClNH3NH3ClOH2H2OClNH 3H2OH2OClNH3ClNH3旋转180度2)[Rh(en)2Cl2]+:N H2H2 NN H2NH2ClClCl NH2H2NNH2NH2ClNH 2NH 2ClClH 2NH 2NClNH 2H 2NNH 2NH 2ClClN H 2H 2NNH 2NH 2Cl旋转180度3)[Co(en)3]3+:NH 2NH 2N H 2NH 2H 2NH 2NNH 2NH 2H 2NNH 2NH 2H 2NNH 2N H 2H 2NNH 2NH 2H 2N旋转180度3、旋光异构体的拆分定义:从两个旋光异构体的混合物中分离出单一异构体的过程。
1)自然拆分法:D D D D D DD D D D D DD D D D D DL L L L L L L L L L L L L L L2)化学拆分法D L D L D L L D L D L D D L D L D LD L D L D L L D L D L D D L D L D L D L D L D L L D L D L DD L D L D LD L D L D L L D L D L D D L D L D L D L D L D L L D L D L D D L D L D LD_J L_J D_J L_J D_J L_J L_J D_J L_J D_J L_J D_J D_J L_J D_J L_J D_J L_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_J D_JD_J L_J D_J L_J D_J L_J L_J D_J L_J D_J L_J D_J D_J L_J D_J L_J D_J L_JD_J L_J D_J L_J D_J L_J L_J D_J L_J D_J L_J D_J D_J L_J D_J L_J D_J L_JL_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_J L_JD D D D D D D D D D D D D D D D D DL L L L L L L L L L L L L L L L L LJJ+J例:拆分[Rh(en)3]3+的两种异构体(Werner的工作):A、拆分试剂:硝基樟脑磺酸钠(NaL)d,l-[Rh(en)3]3++NaL →l-[Rh(en)3]L3↓+d-[Rh(en)3]L3(aq)B、除去拆分试剂:l-[Rh(en)3]L3+NaI→l-[Rh(en)3]I3+NaLC、溶解度较大的d—异构体可从溶液中回收。
第四节其他异构现象1、电离异构由于阴离子处于内界或外界不同而引起的异构现象。
例:[Co(NH3)5Br]SO4═[Co(NH3)5Br]2++SO42−[Co(NH3)5SO4]Br ═[Co(NH3)5SO4]++Br−2、水合异构由于水分子处于内界或外界不同而引起的异构现象。
例:[Cr(H2O)4Cl2]Cl.2H2O[Cr(H2O)5Cl]Cl2.H2O3、键合异构配体用不同的配位原子与中心原子键合而产生的异构。
例:[(NH3)5Co-NO2] Cl2、[(NH3)5Co-O-N=O] Cl2[(H2O)5Cr-SCN]2+、[(H2O)5Cr-NCS]2+4、配合异构由于配体在配阳离子和配阴离子之间分配不同而引起的异构。
例:[Co(NH3)6] [Cr(CN)6][Cr(NH3)6] [Co(CN)6]5、配体异构若配体为异构体,则其相应的配合物亦为异构体。
例:[Co(1,2-pn)2Cl2]Cl [Co(1,3-pn)2Cl2]Cl1,2-pn= 1, 2-丙二胺1,3-pn= 1, 3-丙二胺。