3-1构造异构现象
- 格式:ppt
- 大小:307.00 KB
- 文档页数:18

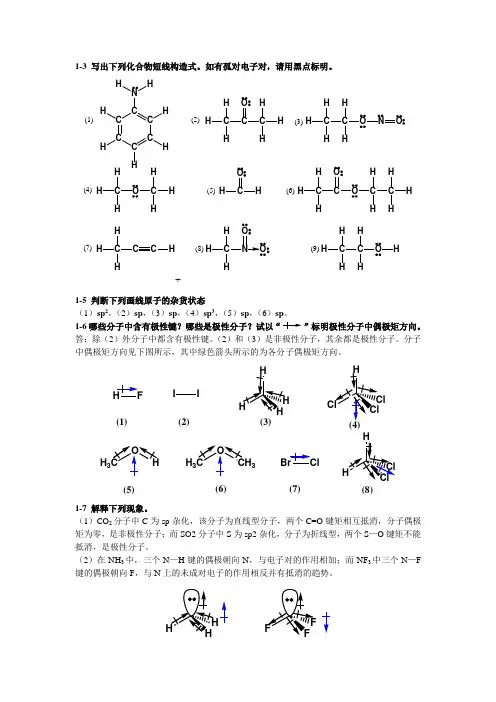
1-3 写出下列化合物短线构造式。
如有孤对电子对,请用黑点标明。
÷C C CC C CNHHH H HC CH HHC O H HHHC H C H ONOH C HOC H HHHOHC HCO OCC H H HHC HCCHH C HNOOHC H C HOH(1)(2)(3)(4)(5)(6)(7)(8)(9)1-5 判断下列画线原子的杂货状态 (1)sp 2,(2)sp ,(3)sp ,(4)sp 3,(5)sp ,(6)sp 。
1-6哪些分子中含有极性键?哪些是极性分子?试以“”标明极性分子中偶极矩方向。
答:除(2)外分子中都含有极性键。
(2)和(3)是非极性分子,其余都是极性分子。
分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
HH 33H 3I I(1)(2)(3)(5)(6)(7)(8)1-7 解释下列现象。
(1)CO 2分子中C 为sp 杂化,该分子为直线型分子,两个C=O 键矩相互抵消,分子偶极矩为零,是非极性分子;而SO2分子中S 为sp2杂化,分子为折线型,两个S —O 键矩不能抵消,是极性分子。
(2)在NH 3中,三个N —H 键的偶极朝向N ,与电子对的作用相加;而NF 3中三个N —F 键的偶极朝向F ,与N 上的未成对电子的作用相反并有抵消的趋势。
(3)Cl和F为一同主族元素,原子共价半径是Cl比F大,而电负性是F比Cl大。
键的偶极矩等于μ=qd,q为正电荷中心或负电荷中心上的电荷量,d为正负电荷中心的距离。
HCl 键长虽比HF的长,但F-中心上的电荷量大大于Cl-上的电荷量,总的结果导致HF的偶极矩大于HCl。
所以键长是H—Cl较长,偶极矩是H—F较大。
1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。
答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3到sp2至sp,s成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。





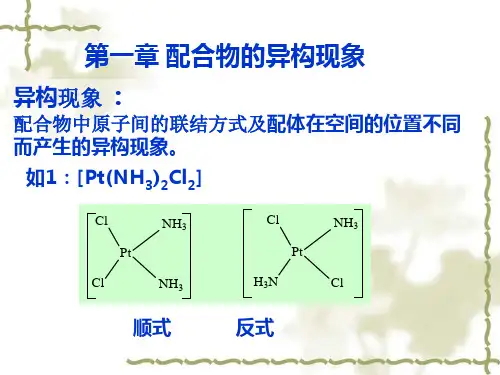
构造异构体构造异构体是旋光异构体。
1.异构体分类异构体分为以下三类:1、碳链异构:由于碳原子的连接次序不同而引起的异构现象。
2、官能团位置异构:由于官能团的位置不同而引起的异构现象。
3、官能团异类异构:由于官能团的不同而引起的异构现象。
化学上同分异构现象是指具有相同化学式,有同样的化学键而有不同的原子排列的化合物。
化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
立体异构体(stereoisomerism),根据IUPAC 金色书的定义是指具有相同原子连接顺序,但原子在空间排列不相同的同分异构体。
这种异构现象称为立体异构。
具有不同光学性质的立体异构体又称光学异构体,光学异构”以前将立体异构划分为几何异构、旋光异构和构象异构三类,但目前较好的分类是将其分为对映异构和非对映异构两类,其中非对映异构又包括顺反异构(即几何异构)和构象异构。
2.构造异构与构型异构是什么?构造异构有这几种⒈碳链异构:异构体的分子式相同而碳骨架不同的现象。
正丁烷CH3CH2CH2CH3和异丁烷(CH3)2CHCH3 ⒉位置异构:异构体的分子式相同而分子中官能团或取代基在碳骨架上的位置不同的现象。
又可分为官能团位置异构和取代基位置异构。
⑴官能团位置异构是因官能团取代不同类型的氢而引起的。
1-丁烯CH2=CHCH2CH3和2-丁烯CH3CH=CHCH3 ⑵取代基位置异构是取代基取代不对称环上不同类型的氢而引起的。
1-甲萘和2-甲萘⒊官能团异构是异构体的分子式相同而分子中的官能团不同的现象。
乙醇CH3CH2OH 和甲醚CH3OCH3的分子式都是C2,但官能团不同。
3.构造异构包括什么?构造异构可分为以下3类:异构体的分子式相同而碳骨架不同的现象。
正丁烷CH3CH2CH2CH3和异丁烷(CH3)2CHCH3 ⒉位置异构:异构体的分子式相同而分子中官能团或取代基在碳骨架上的位置不同的现象。
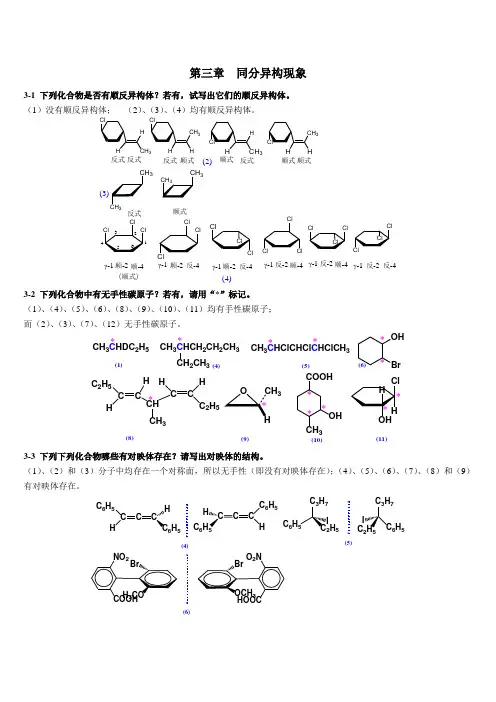
第三章 同分异构现象3-1 下列化合物是否有顺反异构体?若有,试写出它们的顺反异构体。
(1)没有顺反异构体; (2)、(3)、(4)均有顺反异构体。
3333(2)(3)(4)顺式反式333(顺式)顺式反式γ-1反-2顺-2反-4顺-2反-4γ-1γ-1反-4γ-1顺-2顺-4顺式反式顺式顺式反式反式反-2γ-1顺-4反-2γ-1顺-43-2 下列化合物中有无手性碳原子?若有,请用“*”标记。
(1)、(4)、(5)、(6)、(8)、(9)、(10)、(11)均有手性碳原子; 而(2)、(3)、(7)、(12)无手性碳原子。
C C 2H 5HC H CHCH 3CH CH C 2H 5(1)(9)(10)(4)(5)(6)(8)CH 3C HDC 2H 5*CH 3C HCH 2CH 2CH 3*CH 3C HClCHCl C HClCH 3*CH 2CH 3*OH Br**3COOHCH 3OH****(11)3-3 下列下列化合物哪些有对映体存在?请写出对映体的结构。
(1)、(2)和(3)分子中均存在一个对称面,所以无手性(即没有对映体存在);(4)、(5)、(6)、(7)、(8)和(9)有对映体存在。
(4)(5)(6)C CCC 6H 5H 6H 5H C CCC 6H 5HC 6C 6HH 576H 5C 25(7)H3H33333a(9)(8)OH3-4指出下列化合物是否有旋光活性?(2)、(5)有旋光活性;(1)中有一个甲基和羟基所在平面的对称面;(3)非平面型分子(两个苯环互相垂直),含甲酰基和氯所在的苯平面是分子的对称面;(4)为平面型分子,同时也含有对称中心;(6)、(7)和(8)三个分子都有对称面[(6)和(7)为内消旋体,其中(7)中3位碳原子上三个原子或基团旋转后即可看出;(8)取代的乙烯有平面型分子,即二个双键碳原子、与双键碳相连的H、Cl、Br、C共六个原子在同一平面]。


第三章 不饱和烃不饱和烃是指分子结构中含有碳碳双键或三键的烃。
不饱和烃中含有碳碳双键的叫烯烃,含有碳碳三键的称为炔烃。
含有两个或多个碳碳双键的不饱和烃称为二烯烃和多烯烃。
一个不饱和烃分子结构中同时含有碳碳双键和三键则称为烯炔。
不饱和烃的双键和三键不太牢固,容易发生亲电加成反应、取代反应及氧化反应。
烯烃是指含有碳碳双键的不饱和烃,包括链状烯烃和环状烯烃,其官能团为碳碳双键。
链状烯烃的通式为C n H 2n (n ≥2)。
相对于饱和烷烃,烯烃分子结构中每增加1个双键则减少2个氢原子。
一、烯烃的结构和异构现象 (一)烯烃的结构烯烃的结构中主要特征部分为碳碳双键,以最简单的烯烃-乙烯为例来了解双键的结构,乙烯的分子式为C 2H 4,乙烯的两个C 原子和四个氢原子均在同一个平面上,每个碳原子只和3个原子相连,为平面型分子。
碳碳双键由1个σ键和1个π键构成,而不是两个单键构成。
乙烯的平面构型如图3-1(a )所示,分子模型见图3-1(b )和3-1(c )。
CCH HH H121.7°117°0.108nm(a)乙烯的平面构型 (b)球棍模型 (c)比例模型图3-1 乙烯分子的结构拓展阅读碳原子的sp 2杂化和π键杂化轨道理论认为,乙烯分子中的碳原子在成键过程中,处于激发态的1个2s 轨道和2个2p 轨道进行杂化,形成3个能量相同的sp 2杂化轨道,称为sp 2杂化,其杂化过程可表示为:2s 2p激发sp 2杂化sp 2杂化轨道2p2s 2p基态激发态杂化态形成的3个sp 2杂化轨道中每个含有1/3的s 轨道成分和2/3的p 轨道成分,形状是一头大一头小;3个sp 2杂化轨道的对称轴分布在同一平面上,夹角为120°,呈平面三角形,每个碳原子还有一个2p z 轨道未参与杂化,其对称轴垂直于3个sp 2杂化轨道的对称轴所形成的平面,见图3-2。
由此可见,乙烯分子中碳碳双键是由1个σ键和1个π键组成的,π键是由2个p 轨道侧面重叠形成的,电子云分布于键轴上下,键能较小,同时由于π键电子云离核较远,受原子核束缚力较弱,容易被外电场极化,所以π键不稳定,比σ键容易断裂。