配合物的异构现象
- 格式:ppt
- 大小:4.21 MB
- 文档页数:35









第11章配合物结构11.1 复习笔记一、配合物的空间构型、异构现象和磁性1.配合物的空间结构(1)定义配合物:提供孤电子对的配体与接受孤电子对的中心离子(或原子)以配位键结合形成的化合物。
配合物的空间结构:围绕着中心离子(或原子)的配体排布的几何构型。
(2)影响因素①配位数的多少;配合物的空间构型与配位数间的关系如表11-1-1所示。
表11-1-1 配合物的空间构型与配位数②中心离子、配体种类。
示例:[Ni(CN)4]2-为平面正方形构型,而[Ni(Cl)4]2-是四面体构型。
(3)配合物的空间构型的规律①形成体在中间,配体围绕中心离子排布;②配体间倾向于尽可能远离,能量低,配合物稳定。
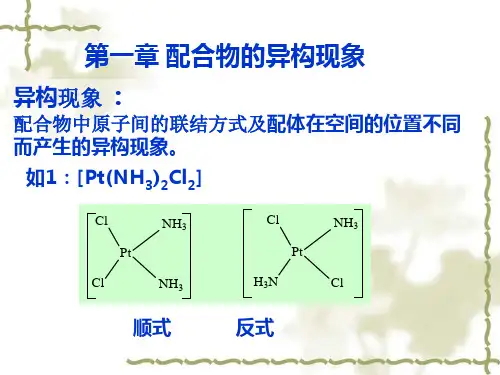
2.配合物的异构现象(1)定义配合物的异构现象:两种或两种以上配合物的化学组成相同而结构、性质不同的现象。
(2)分类配合物的异构现象可分为:键合异构、配位异构、几何异构和旋光异构。
在这里主要介绍后两种异构现象。
①几何异构:根据配体相对于中心离子的排列位置可分为顺式异构体和反式异构体两类。
配位数为4的平面正方形和配位数为6的八面体构型的配合物会发生顺、反异构。
配位数为4的四面体配合物以及配位数为2和3的配合物不存在几何异构体。
②旋光异构(光学异构):由分子的特殊对称性(无对称面和对称中心)形成的两种异构体而引起旋光性相反的现象。
两种旋光异构体互成镜像关系。
配位数为4的平面正方形构型的配合物一般无旋光性,而四面体构型则存在旋光性。
3.配合物的磁性(1)定义配合物的磁性:配合物在磁场中所表现出来的相关特性。
(2)分类: ①顺磁性物质:含有未成对电子的配合物;②反磁性物质:不含有未成对电子的配合物。
(3)表示方法配合物磁性可用磁矩(µ)进行表示。
磁矩µ与配合物中的未成对电子数n 间的关系为式中,µB 为磁矩单位,玻尔磁子,1µB =9.274×10-24J ·T -1。

第二章配合物的结构及异构现象第一节配位数与配位多面体配位多面体:把围绕中心原子的配位原子看作点,以线按一定的方式连接各点就得到配位多面体。
用来描述中心离子的配位环境。
1、配位数为2理想构型为直线型结构,大多限于Cu(I)、Ag(I)、Au(I)和Hg(II)的配合物。
如:[Ag(NH3)2]+2、配位数为3理想构型为等边三角形结构。
如:[HgI3]−3、配位数为41)四面体构型 2) 平面正方形构型[NiCl4]2−[Ni(CN)4]2−[Zn(NH3)4]2+[Pt(NH3)4]2+4、配位数为51)三角双锥构型 2) 四方锥构型[Fe(CO)5] [InCl5]2−[CuCl5]3−5、配位数为6八面体构型三棱柱构型[Co(NH3)6]3+Re(S2C2Ph2)36、配位数为71)五角双锥构型如 [ZrF7]3−2)单面心三棱柱构型3)单面心八面体构型7、配位数为81)四方反棱柱。
如 [Sr(H2O)8]2+2)三角十二面体。
如 [Co(NO3)4]2-8、配位数大于8的情况多出现在镧系及锕系金属配合物中。
为什么?N H N NNNNHN H NNNHNOOOONHNNNHNLa第二节几何异构现象 (geometrical isomerism)几何异构:由于配体在空间的位置不同而产生的异构现象。
1.平面正方形配合物 1)[Pt(NH 3)2Cl 2]PtCl ClH 3NH 3NPtNH 3ClClH 3N顺式反式ClNH 3H 3N Cl2)[Pt(NH 3)(py)ClBr]PtPy BrClH 3NPt PyNH 3ClBrH平面正方形配合物几何异构体数目配合物类型 MA 4 MA 3B MA 2B 2 MA 2BC MABCD异构体数目 1 1 2 2 32.八面体构型的配合物[Co(NH3)4Cl2]+的几何异构体:有两种几何异构体:NH3NH3Cl NH3ClNH3NH3NH3H3NNH3ClCl顺式(绿色)反式(紫色)[Rh(py)3Cl3]:Py PyCl ClClPyPyPyCl PyClCl面式(facial)经式(meridional))[Co(en)2Cl2]+ (en = H2NCH2CH2NH2):N H2H2 NN H2NH2ClClNH2NH2Cl ClH2NH2N反式顺式八面体配合物几何异构体数目类型MA6 MA5B MA4B2 MA3B3 MA4BC数目 1 1 2 2 2类型MA3B2C MA2B2C2 MABCDEF数目 3 5 153、几何异构体的鉴别方法1)偶极矩偶极矩:μ= q x l如:例:Pt(II)配合物的偶极矩(Debye): 顺式NH 3NH 3ClPtCl反式[Pt(NH3)2Cl2] 8.7 02)红外光谱cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2]cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2] 3)紫外-可见光谱法cis-和trans-[Co(en)2Cl(NO2)]+的紫外-可见光谱4) X射线衍射法可确定原子在空间的三维坐标。
宁波大学研究生期末考试答题纸
配合物的同分异构体
1、同分异构体的定义
化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
2. 配合物的异构现象
化合物的分子式相同而结构、性质不同的现象称为同分异构现象。
对于配合物来说,常见的异构现象有几何异构、旋光异构、结构异构(电离异构、水合异构、键合异构、配位异构) 等。
2.1几何(立体)异构及几何异构体的命名
多种配体在中心原子(离子)周围所处的相对位置不同而导致的异构现象称为配合物的几何异构。
2.1.1 顺-反异构
同种配体处于相邻位置者称为顺式异构体,同种配体处于对角位置者称为反式异
构体。
MA2B2类型的平面正方型配合物具有顺反异构体。
如[Pt(NH3)2Cl2]。
MA2B4类型的四角双锥配合物也具有顺反异构体。
如[Co(NH3)4Cl2]+配离子。
2.1.2面-经异构
MA3B3异构体中,若A、B两种配体各自连成互相平行的平面者称为面式异构体,反之若两平面互相垂直则称为经式异构体。
2.2 镜像异构(旋光异构)
2.2.1 镜像异构
当两种化合物的组成和相对位置皆相同,但它们互为镜像关系,象左右手一样不能重合,这种异构称为手性异构或镜像异构。
如丙氨酸,等。
2.3 结构异构。
第5讲:群论与配位化合物的异构现象1.常见配位化合物的异构现象(单齿配体)1.1四配位化合物的异构现象1.1.1平面方形配合物立体异构体数几何异构体数对映体数顺反异构体数Ma4 1 1 0 0Ma3b 1 1 0 0Ma2b2 2 1 0 1Ma2bc 2 1 0 1 Mabcd 3 3 0 01.1.2 四面体配合物立体异构体数几何异构体数对映体数Ma4 1 1 0Ma3b 1 1 0Ma2b2 1 1 0Ma2bc 1 1 0Mabcd 2 1 11.2.五配位化合物的异构现象(三角双锥)配合物立体异构体数几何异构体数对映体数Ma5 1 1 0Ma4b 2 2 0Ma3b2 3 2 1Ma3bc Ma2b2c Ma2bcd 4410337113Mabcde 20 10 101.3.六配位化合物的异构现象(八面体)配合物立体异构体数几何异构体数对映体数Ma6 1 1 0Ma5b 1 1 0Ma4b2 Ma3b3 Ma4bc 222222Ma3bcd Ma2bcde Mabcdef 5153049151615Ma2b2cd 8 6 2Ma2b2c2 6 5 1Ma3b2c 3 3 02.配合物异构体的推导方法——Barlar方法以六配位化合物Mabcdef为例,其基本步骤如下:①将a、b、c、d、e、f放置在八面体的六个顶点上;②选一个配体为固定点(如a),另一个配体为参考点(如b),得到1种几何异构体,标记为1L;然后交换e、d,得一种新的几何异构体,标记为1M;继续交换d、f,又得一种几何异构体1N。
1L:(ab)(cd)(ef)1M:(ab)(ce)(df)1N:(ab)(cf)(ed)③a为固定点,c为参考点。
2L:(ac)(bd)(ef)2M:(ac)(be)(df)2N:(ac)(bf)(ed)④a为固定点,d为参考点。
3L:(ad)(cb)(ef)3M:(ad)(ce)(bf)3N:(ad)(be)(cf)⑤a为固定点,e为参考点。