配位化学-配合物异构现象
- 格式:ppt
- 大小:307.50 KB
- 文档页数:21

9.2 配位化合物空间结构及几何异构现象
9.2.1 配位化合物的空间结构
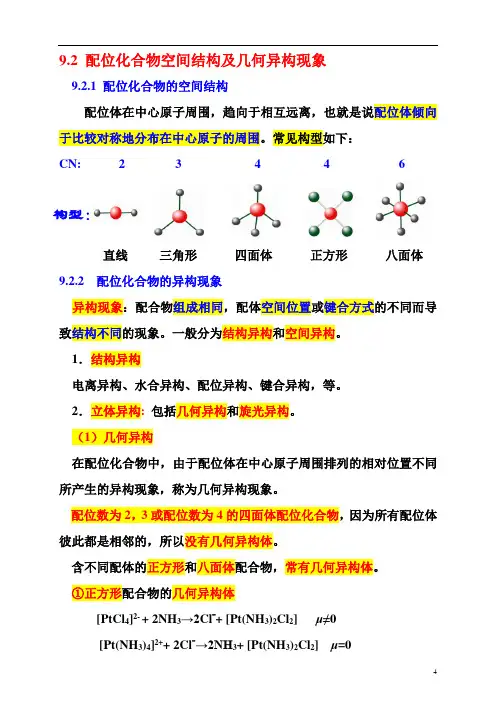
配位体在中心原子周围,趋向于相互远离,也就是说配位体倾向于比较对称地分布在中心原子的周围。
常见构型如下:
CN: 2 3 4 4 6
构型:
直线三角形四面体正方形八面体9.2.2 配位化合物的异构现象
异构现象:配合物组成相同,配体空间位置或键合方式的不同而导致结构不同的现象。
一般分为结构异构和空间异构。
1.结构异构
电离异构、水合异构、配位异构、键合异构,等。
2.立体异构:包括几何异构和旋光异构。
(1)几何异构
在配位化合物中,由于配位体在中心原子周围排列的相对位置不同所产生的异构现象,称为几何异构现象。
配位数为2,3或配位数为4的四面体配位化合物,因为所有配位体彼此都是相邻的,所以没有几何异构体。
含不同配体的正方形和八面体配合物,常有几何异构体。
①正方形配合物的几何异构体
[PtCl4]2- + 2NH3→2Cl-+ [Pt(NH3)2Cl2] μ≠0
[Pt(NH3)4]2++ 2Cl-→2NH3+ [Pt(NH3)2Cl2] μ=0
4。



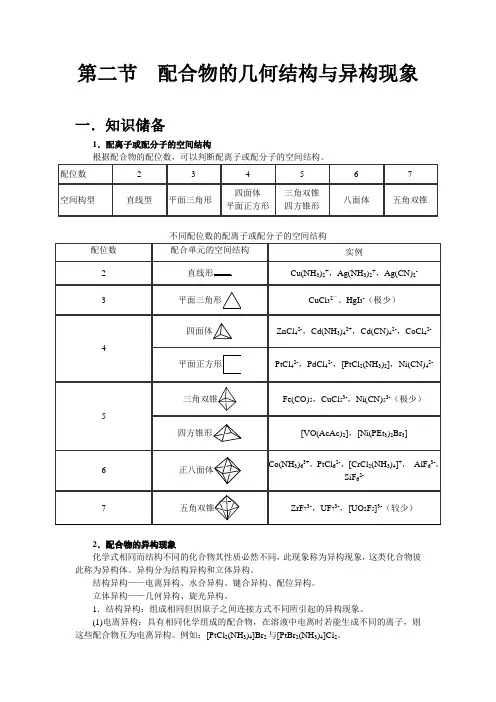
第二节配合物的几何结构与异构现象一.知识储备1.配离子或配分子的空间结构根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构2.配合物的异构现象化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物MA 2B 2型平面四边形配合物有顺式和反式两种异构体。




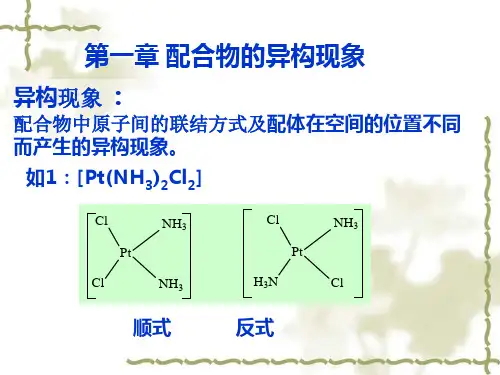
§16-2 配位化合物的同分异构现象The Isomerism of plexes一、总论:1.Definition:凡是化学组成相同的若干配合物,因原子间的连接方式或空间排列方式的不同而引起的结构和性质不同的现象,称为配合物的同分异构现象(isomerism)。
2.Classification(1) 化学结构异构现象(chemical structure isomerism):化学组成相同,原子间的连接方式不同而引起的异构现象,称为化学结构异构现象。
例如:[Co(NH 3)5(NO 2)]2+ 和 [Co(NH 3)5(ONO)]2+(2) 立体异构现象(stereo isomerism ):化学组成相同,空间排列不同而引起的异构现象,称为立体异构现象。
例如:Pt(NH 3)2Cl 2cis – 二氯·二氨合铂(II)trans - 二氯·二氨合铂(II)二、化学结构异构现象,大致分为五类:Ionization isomerism, Hydrate isomerism, Linkage isomerism, Coordination isomerism,Polymerization isomerism. 1.Ionization isomerism(1)Two coordination pounds which differ in the distribution of ions between thosedirectly coordinated and counter-ions present in the crystal lattice are called ionization isomers.(2) e.g. [Cr(NH 3)5Br]SO 4and [Cr(NH 3)5SO 4]Br 2.Hydrate isomerism (Solvent isomerism)(1)Hydrate isomerism is similar to ionization isomerism except that an unchargedligand changes from being coordinated to a free-lattice position whilst another ligand moves in the opposite sense.(2) e.g. [Cr(H 2O)6]Cl 3,[Cr(H 2O)5Cl]Cl 2·H 2O ,[Cr(H 2O)4Cl 2]Cl ·2H 2O 3.Linkage isomerism(1)The first example of this type of isomerism was provided by J φrgensen, W erner’scontemporary. His method of preparation was as follows :A"solution "Cl]Cl )[Co(NH 23NaNO HCl NH 253−−−→−−−→−−−→− red Co(ONO)]Cl )[(NH A"solution "253cold in stand let −−−−−→− yellow )]Cl Co(NO )[(NH A"solution "2253HCl conc heat −−−→−−−→−⋅(2)It deals with a few ligands (ambidenatate) that are capable of bonding throughare type of donor atom in one situation not a different atom in another plex. Some authors refer to this type of isomerism as “structural isomerism” but inasmuch as all isomerism is basically “structural” , the term linkage isomerism is preferable.(3) e.g. +252SCN]O)[Cr(H and +252NCS]O)Cr(H [+]SSO )Co(NH [353 and +S]OSO )[Co(NH 2534.Coordination isomerism(1)This may occur only when the cation and anion of a salt are both plexes, the twoisomers differing in the distribution of ligands between the cation and anion(2) e.g. ]Cr(Ox)][)Co(NH [363 and ]][Co(Ox))[Cr(NH 363 ]][Cr(SCN))[Cr(NH 663 and ](SCN))][Cr(NH (SCN))[Cr(NH 423243 ]PtCl ][)[Pt(NH 643 and ]][PtCl Cl )[Pt(NH 4243(3) Coordination position isomerismIn this form of isomerism the distribution of ligands between two coordination centers differs e.g.and5.Polymerization isomerism(1) Strictly speaking, polymerization isomerism, in which n varies in the plex [ML m ]nis not isomerism. It is included in this list because it represents on additional way in which an empirical formula may give inplete information about the nature of a plex.(2) For example, all members of the following series are polymerization isomers:])(NO )[Co(NH 32331=n])Co(NO ][)Co(NH [62632=n])(NO )][Co(NH )(NO )Co(NH [422322432=n 24223253])(NO ))][Co(NH (NO )Co(NH [3=n3422363])(NO )][Co(NH )Co(NH [4=n 2623253])Co(NO [)](NO )Co(NH [5=n三、立体异构现象 (Stereo Isomerism ) 1.几何异构现象 (Geometrical isomerism )(1) 配合物的配位数与几何构型的关系 (The relationship between coordination numberof plexes and geometrical structure.)a .两配位:直线型 (linear) +23)Ag(NH 、-2CuClb .三配位:平面三角型 (triangle)-][HgI 3c .四配位:平面四方 (square planar) -24PtCl ; 正四面体 (tetrahedron)[ (NH 3)4CoO OCo(NH 3)2Cl 2 ]2+H H [ Cl(NH 3)3CoO O Co(NH 3)3Cl ]2+H H-24 Zn(CN)d.五配位:三角双锥(trigonal bipyramid) +])[Co(NCCH53、+I]Cu(dipy)[2四方锥(square pyramid) ][VO(acac)2e.六配位:正八面体 (octahedron)6SF、-6PCl三棱柱 (trigonal prism) ])phC[Re(S3222f.七配位:五角双锥 (pentagonal bipyramid)][ZrFNa73带帽三棱柱 (the one-face centred trigonal prism)][ZrF)(NH734带帽八面体 (the one-face centred octahedron)g.八配位:立方体 (cube)88HC(立方烷)四方反棱柱(square anti prism)]Zr(acac)[4十二面体(dodecahedron)44[Zr(ox)]-我们将讨论四、五、六配位配合物的几何异构现象(2)决定配合物几何异构体数目的因素:a.空间构型:例如正四面体几何构型不存在几何异构体。