2010中国药典统计-提取物.
- 格式:xls
- 大小:70.50 KB
- 文档页数:5

中国药典2010 年版一部附录附录Ⅰ A 丸剂丸剂系指饮片细粉或提取物加适宜的黏合剂或其他辅料制成的球形或类球形制剂,分为蜜丸、水蜜丸、水丸、糊丸、蜡丸和浓缩丸等类型。
蜜丸系指饮片细粉以蜂蜜为黏合剂制成的丸剂。
其中每丸重量在0.5g(含0.5g)以上的称大蜜丸,每丸重量在0.5g 以下的称小蜜丸。
水蜜丸系指饮片细粉以蜂蜜和水为黏合剂制成的丸剂。
水丸系指饮片细粉以水(或根据制法用黄酒、醋、稀药汁、糖液等)为黏合剂制成的丸剂。
糊丸系指饮片细粉以米粉、米糊或面糊等为黏合剂制成的丸剂。
蜡丸系指饮片细粉以蜂蜡为黏合剂制成的丸剂。
浓缩丸系指饮片或部分饮片提取浓缩后,与适宜的辅料或其余饮片细粉,以水、蜂蜜或蜂蜜和水为勤合剂制成的丸剂。
根据所用黏合剂的不同,分为浓缩水丸、浓缩蜜丸和浓缩水蜜丸。
丸剂在生产与贮藏期间应符合下列有关规定。
一、除另有规定外,供制丸剂用的药粉应为细粉或最细粉。
二、蜜丸所用蜂蜜须经炼制后使用,按炼蜜程度分为嫩蜜、中蜜和老蜜,制备蜜丸时可根据品种、气像等具体情况选用。
除另有规定外,用塑制法制备蜜丸时,炼蜜应雄热加入药粉中,混合均匀;处方中有树脂类、胶类及含挥发性成分的药味时,炼蜜应在60℃左右加入;用泛制法制备水蜜丸时,炼蜜应用沸水稀释后使用。
三、浓缩丸所用提取物应按制法规定,采用一定的方法提取浓缩制成。
四、除另有规定外,水蜜丸、水丸、浓缩水蜜丸和浓缩水丸均应在80℃以下干燥;含挥发性成分或淀粉较多的丸剂(包括糊丸)应在60℃以下干燥;不宜加热干燥的应采用其他适宜的方法干燥。
五、制备蜡丸所用的蜂蜡应符合本版药典该饮片项下的规定。
制备时,将蜂蜡加热熔化,待冷却至60℃左右按比例加入药粉,棍合均匀,趁热按塑制法制丸,并注意保温。
六、凡需包衣和打光的丸剂,应使用各品种制法项下规定的包衣材料进行包衣和打光。
七、丸剂外观应圆整均匀、色泽一致。
蜜丸应细腻滋润,软硬适中。
蜡丸表面应光滑无裂纹,丸内不得有蜡点和颗粒。

中国药典2010版第一部摘要:一、引言二、中国药典2010版第一部的概述三、中国药典2010版第一部的主要内容1.药物的分类2.药物的命名规则3.药物的性状、鉴别与检查4.药物的炮制5.药物的制剂四、中国药典2010版第一部的应用与价值五、结论正文:一、引言中国药典是中医药行业的一部权威性法典,对药品的研究、生产、经营、使用、监督管理等方面具有重要的指导作用。
本文将重点介绍中国药典2010版第一部的相关内容。
二、中国药典2010版第一部的概述中国药典2010版第一部,简称2010版药典一部,是按照我国药品监督管理部门的要求,由中国药典委员会组织编纂的。
该书于2010年正式出版,是我国药品标准体系的重要组成部分。
三、中国药典2010版第一部的主要内容1.药物的分类2010版药典一部对药物进行了详细的分类,包括中药材、中药提取物、中药成方制剂、化学药品、生化药品、抗生素、放射性药品等。
2.药物的命名规则药典规定了药物的命名原则,包括通用名、化学名、商品名等,并对药物的命名进行了规范和统一。
3.药物的性状、鉴别与检查药典对药物的性状、鉴别与检查进行了详细的规定,包括外观性状、理化性质、鉴别方法、检查方法等,为药品的真伪鉴别提供了依据。
4.药物的炮制药典对药物的炮制进行了规范,包括炮制方法、炮制程度等,以确保药物的疗效和安全性。
5.药物的制剂药典对药物的制剂进行了详细的规定,包括制剂工艺、处方、质量要求等,以确保药品的质量和疗效。
四、中国药典2010版第一部的应用与价值2010版药典一部的出版,为药品的生产、经营、使用、监督管理等方面提供了重要的依据和指导,对提高我国药品质量、保障人民用药安全有效具有重要意义。
五、结论中国药典2010版第一部是中医药行业的一部权威性法典,对药品的研究、生产、经营、使用、监督管理等方面具有重要的指导作用。
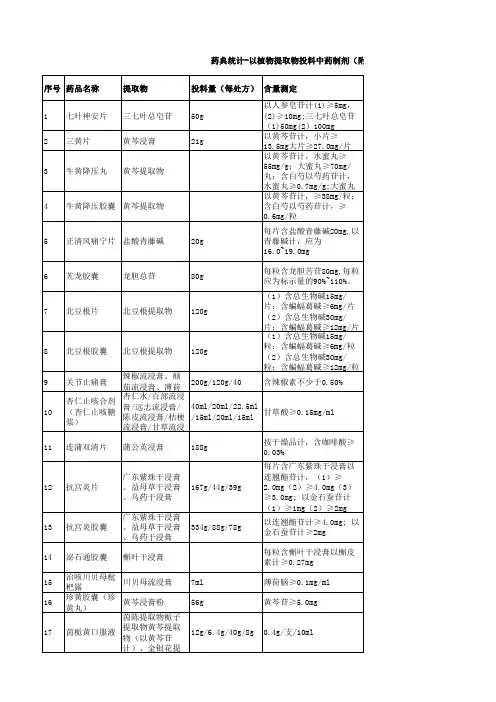

中国药典银杏叶提取物质量标准我要投稿作者:不详出处:不详时间:2010-11-23类别:银杏叶提取物人气:432 中国药典银杏叶提取物质量标准:制法:乙醇(不是甲醇)回流提取,大孔树脂吸附,喷干,粉碎。
性状:浅棕黄色至棕褐色粉末;味微苦。
检查:水分小于5.0%;炽灼残渣小于0.8%;重金属不得过百万分之二十,即20ppm以下。
黄酮苷元峰面积比,槲皮素与山奈素的峰面积比应为0.8至1.5。
(如果超过1.5,则应怀疑被人为添加了槲皮素或者芦丁。
)总银杏酸不得过百万分之十,即10ppm。
含量测定高效液相色谱法。
总黄酮醇苷不得少于24.0%;总黄酮醇苷含量=槲皮素含量+山奈素含量+异鼠李素含量萜类内脂总量不得少于6.0%;萜类内脂总量=白果内脂+银杏内脂A+银杏内脂B+银杏内脂C。
银杏叶提取物 Ginkgo Biloba Extract(1)原料级标准(不可直接用于制剂)(1)Routine银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5银杏总内酯≥6% Total terpene lactones ≥ 6%(2)中国药典2005版标准(2)CP2005银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5 银杏总内酯≥6% Total terpene lactones ≥ 6%银杏酸<10ppm Ginkgolic acid < 10ppm(3) 低酸银杏叶提取物 EGB761 (3) EGB761银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5 银杏总内酯≥6% Total terpene lactones ≥ 6%银杏酸<5ppm Ginkgolic acid < 5ppm(4)超低酸银杏叶提取物(4)Minimal acid银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5银杏总内酯≥6% Total terpene lactones ≥ 6%银杏酸<1ppm Ginkgolic acid < 1ppm(5)中国药典2005标准水溶性银杏叶提取物(5)CP2005( Water soluble)银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5银杏总内酯≥6% Total terpene lactones ≥ 6%银杏酸<10ppm Ginkgolic acid < 10ppm溶解度:1克溶于1000毫升水中 Solubility:1g extract in 1000 ml water (6) 低酸水溶性银杏叶提取物 EGB761 (6) EGB761( Water soluble)银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5银杏总内酯≥6% Total terpene lactones ≥ 6%银杏酸<5ppm Ginkgolic acid < 5ppm溶解度:1克溶于100毫升水中 Solubility:1g extract in 100 ml water (7)超低酸水溶性银杏叶提取物(7)Minimal acid( Water soluble)银杏黄酮≥24% Total Ginkgo flavone glycosides ≥ 24%槲皮素与山奈酚峰比0.8--1.5之间 Quercatin: kaemperol 0.8--1.5银杏总内酯≥6% Total terpene lactones ≥ 6%银杏酸<1ppm Ginkgolic acid < 1ppm。




《中华人民共和国药典》2010年版简介《中华人民共和国药典》(简称《中国药典》)2010年版,按照第九届药典委员会成立大会暨全体委员大会审议通过的《中国药典》2010年版编制大纲所确立的指导思想、基本原则、任务目标及具体要求,在全体委员和常设机构工作人员的不懈努力及有关部门和参与单位的大力支持下编制完成。
经第九届药典委员会执行委员会审议通过,为中华人民共和国第九版药典。
本版药典分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
本版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
本版药典的变化主要体现在:收载品种有较大幅度的增加。
本版药典积极扩大了收载品种范围,基本覆盖了国家基本药物目录品种范围。
此次收载品种的新增幅度和修订幅度均为历版最高。
对于部分标准不完善、多年无生产、临床不良反应多的药品,也加大调整力度,2005年版收载而本版药典未收载的品种共计36种。
现代分析技术得到进一步扩大应用。
除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用。
如附录中新增离子色谱法、核磁共振波谱法、拉曼光谱法指导原则等。
中药品种中采用了液相色谱质谱联用、DNA分子鉴定、薄层生物自显影技术等方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。
化药品种中采用了分离效能更高的离子色谱法和毛细管电泳法;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中。

片剂片剂:片剂是指提取物、提取物加片剂细粉或饮片细粉与十一的辅料混匀压制或用其他适宜方法制成的圆片装或异形片状的制剂、有浸膏剂、半浸膏剂片和全粉片等。
片剂以,口服普通片为主另外有含片、咀嚼片、泡腾片、阴道片、阴道泡腾片和肠溶片等。
口含片指含于口腔内缓慢溶解的压制片,能对口腔及咽部产生持久的药效,用于局部的消炎、消毒等,如草珊瑚含片。
咀嚼片是指于口腔中咀嚼后吞服的片剂。
泡腾片是指含有碳酸氢钠和有机酸遇水可产生气体而呈泡腾状的片剂。
阴道片与阴道泡腾片是指于阴道内是用的片剂。
肠溶片是指肠溶性包衣材料进行包衣的片剂。
片剂在生产与贮藏期间应符合下列有关规定。
(1)用于偏激的要分与辅料应混合均匀。
含药量小的或者有毒性的片剂,应根据药物的性质用适宜的方法使药物分散均匀。
(2)凡属于挥发性或遇热不稳定的药物,在制片过程中应避免受热损失。
(3)压片前的颗粒应控制水分,以适应制片工艺的需要,并防止成品在贮藏期间发霉、变质。
(4)片剂根据需要,可加入娇味剂、芳香剂和着色剂等附加剂。
(5)为增加稳定性、掩盖药物不良臭味或该散片剂万贯等。
可对制成的药片包衣或薄膜衣,对一些遇胃液易破坏刺激胃黏膜或需要在肠道内释放的口服药片,可包肠溶衣,必要时,薄膜衣片剂应检查残留溶剂。
(6)偏激外观应完整光洁、色泽均匀,有适宜的硬度,以避免在包装、贮运过程中发生磨损或破碎。
(7)除另有规定外,片剂应蜜蜂储藏除另有规定外,偏激应进行一下检查。
【重量差异】片剂照下列方法检查,应符合规定。
检查法取供试品20片,精密称定总重量,求得平均片重量后,在分别精密称定每片重量,每片重量应与标识片重量相比较,按规定,超出重量差异的限度不得超过2片,并不得有一片超过限量的1倍。
糖衣片的片芯应质量检查差异符合规定,包糖衣后不在检查重量差异。
除另有规定外,其他包衣应在包衣后检查重量差异病应符合规定。
【崩解时限】除另有规定外,照崩解时限检查法检查,应符合检查。
阴道片照融变时限检查法检查,并应符合规定。

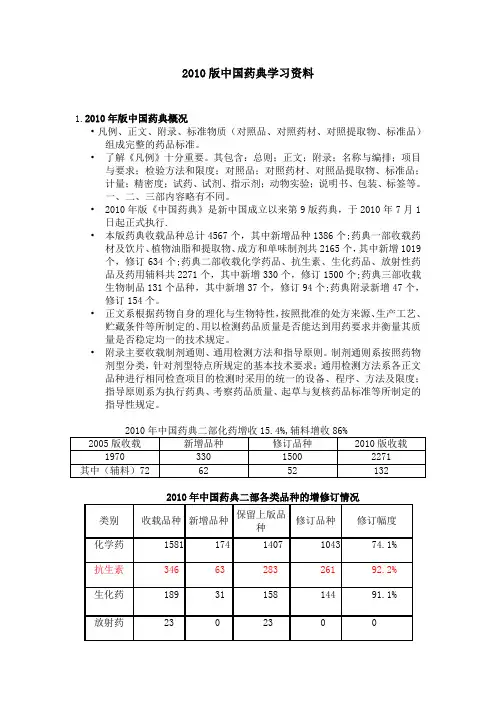
2010版中国药典学习资料1.2010年版中国药典概况•凡例、正文、附录、标准物质(对照品、对照药材、对照提取物、标准品)组成完整的药品标准。
•了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对照品;对照药材、对照品提取物、标准品;计量;精密度;试药、试剂、指示剂;动物实验;说明书、包装、标签等。
一、二、三部内容略有不同。
•2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.•本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
•正文系根据药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳定均一的技术规定。
•附录主要收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采用的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情况•新版药典凡例进行了重大修订:•1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,并且做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也基本一致。
•2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品管理法》组织制定和颁布实施”。
银杏叶提取物质量标准修订意义重大——康恩贝参与中国药典2010版标准修订作者:研究院/方玲叶剑锋009年8月6日,国家药典委网站上公布了关于2010年版药典(一部)部分增修订及新增品种(第四批)的公示,其中就包括了浙江省药检所起草的新的标准主要修订了黄酮苷元峰面积比,将峰比修订为:槲皮素与山萘素的峰面积比(Q/K)应为0.8~1.2,异鼠李素与槲皮素的峰面积比(I/Q)不小于0.15其实,在此之前,我公司已经认识到,银杏叶提取物标准的修订迫在眉睫,按公司领导的安排部署,以及各相关部门做的大量具体研究工作基础上,书面准进行修订。
小小的改动,触动了很多银杏叶生产厂的“神经”,很多厂家积极反对,认为太严了。
其实,很多厂家为了谋求利益,产品不按照规定的工艺进行生产,在银杏叶提取物(EGB)是我国乃至世界上重要的天然药物原料之一。
中国是世界上银杏的发祥地,也是银杏的主要生产国与出口国,银杏资源占世界总量的厂家生产设备及工艺水平参差不齐,部分银杏叶提取物厂家为了使产品主要化学指标符合客户标准,采用水提、半萃取,掺入银杏树皮、根皮与银杏叶共素或山奈素结构的物质共同提取,或使用甲醇、工业乙醇提取等这些不当的商业行为,不仅混乱了产品的质量构成,还严重干扰了市场秩序,阻碍产品的国银杏产业的声誉。
那么,如此修订背后的意义何在呢?我们进行了如下深入理论研究。
一、银杏叶提取物及其制剂中黄酮含量研究按中国药典所载方法,测定银杏叶中黄酮含量,经多批次检验,槲皮素:山萘素峰面积比均在0.74~1.137范围内,平均为0.882。
说明在自然界的银杏叶比就有一个固定的范围。
测定数据见表1。
我公司按中国药典收载的方法,制备银杏叶提取物,多年的测定数据显示,槲皮素:山萘素(Q/K)峰比超过1.1的几乎没有。
近日,本公司有三批银杏叶提经医保商会指定的厂家进行复核检测,峰比也均为1.00~1.04之间。
美国药典USP31版中规定槲皮素:山萘素峰面积比应为0.8~1.2,异鼠李素:槲皮素峰面积比应不小于0.1,新修订的中国药典2010版中结合美国药典的素:山萘素峰面积比应为0.8~1.2,异鼠李素:槲皮素峰面积比应不小于0.15。
备案品种:
2010年药典植物油脂和提取物:47个品种
1、丁香罗勒油、八角茴香油、松节油、桉油、广藿香油、满山红油、牡荆油、肉桂油、茶油、莪术油、蓖麻油、薄荷素油、薄荷脑、麻油
2、岩白菜素、灯盏花素、环维黄杨星D、香果脂、黄藤素、穿心莲内酯
3、三七三醇皂苷、三七总皂苷、人参总皂苷、人参茎叶总皂苷、积雪草总苷
4、丹参总酚酸提取物、丹参酮提取物、北豆根提取物、山楂叶提取物、茵陈提取物、连翘提取物、银杏叶提取物、黄芩提取物
5、刺五加浸膏、大黄流浸膏、大黄浸膏、姜流浸膏、当归流浸膏、浙贝流浸膏、甘草浸膏、益母草流浸膏、甘草流浸膏、肿节风浸膏、远志流浸膏、颠茄流浸膏、颠茄浸膏
6、水牛角浓缩粉
以往国家标准品种:24个
药典2000:薄荷油
药典85:芸香草油
药典77:艾叶油、砂仁叶油、松节油、椰馏油
药典63 :橙皮油、丁香油(部标维药)、桂皮油、花生油、可可豆油、棉子油、杏仁油、亚麻油
药典53:柯柯豆油、松溜油、鱼肝油、樟脑(蒙药)
其他:红花子油(部标维药)、黄荆油(部颁中药)、鲜竹沥(部颁中药)、洋橄榄油(部标维药)、豨莶液(Z2-287、WS3-B-0456-90) 、贝母花流浸膏(Z6-35 、WS3-B-1104-92)、桔梗流浸膏(WS3-B-2205-96)。
《中国药典》是国家为保证药品质量可控、确保人民用药安全有效而依法制定的药品法典,是药品研制、生产、经营、使用和管理都必须严格遵守的法定依据,是国家药品标准体系的核心,是开展国际交流与合作的重要内容。
2010年版《中国药典》是新中国成立60年来组织编制的第九版药典,新版药典在总结历版药典的基础上,充分利用近年来国内外药品标准资源,注重创新与发展,实事求是地反映了我国医药产业和临床用药水平的发展现状,为进一步加强药品监督管理提供了强有力的技术支撑。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
2010年版《中国药典》收载品种4600余种,其中新增1300余种,基本覆盖国家基本药物目录品种和国家医疗保险目录品种。
2010年版《中国药典》有以下主要特点:一、药品安全性得到进一步保障在药品安全性方面,除在附录中加强安全性检查总体要求外,在品种正文标准中也大幅度增加或完善安全性检查项目,进一步提高对高风险品种的标准要求,进一步加强对重金属或有害元素、杂质、残留溶剂等的控制,并规定眼用制剂按无菌制剂要求,明确用于烧伤或严重创伤的外用剂型均按无菌要求。
新版药典的附录和凡例等通用性、基础性技术规定与要求,对药典以外的所有上市药品都有直接的作用和影响力。
在有效性和质量可控性方面,除新增和修订相关的检查方法和指导原则外,在品种正文标准中增加或完善有效性检查项目,大幅度增加了符合中药特点的专属性鉴别,含量测定采用了专属性更强的检查方法,增加溶出度、含量均匀度等检查项目。
2010年版《中国药典》重点药品标准的系统性提高工作,对高风险药品尤为重视。
新版药典增加了化学药注射剂安全性检查法应用指导原则;在制剂通则中将渗透压摩尔浓度检查作为注射剂的必检项目;对药典一部收载的中药注射剂品种全部增加了重金属和有害元素限度标准;此外对于其他注射剂品种的标准也不同程度地增加了对产品安全性、有效性及质量可控性等方面的质控要求,这些措施对于解决注射剂、特别是中药注射剂的安全性问题必将起到积极的作用。
《中国药典》2010年版一部收载微生物限度标准非无菌药品的微生物限度标准是基于药品的给药途径及对患者健康潜在的危害而制订的。
药品的生产、贮存、销售过程中的检验,中药提取物及辅料的检验,新药标准制订,进口药品标准复核,考察药品质量及仲裁等,除另有规定外,其微生物限度均以本标准为依据。
1. 制剂通则、品种项下要求无菌的制剂及标示无菌的制剂应符合无菌检查法规定。
2. 口服给药制剂2.1 不含药材原粉的制剂细菌数每1g不得过l000cfu。
每lml不得过100cfu。
霉菌和酵母菌数每lg或lml不得过100cfu。
大肠埃希菌每1g 或lml不得检出。
2.2 含药材原粉的制剂细菌数每1g不得过l0000cfu(丸剂每1g不得过30000cfu)。
每lml不得过500cfu。
霉菌和酵母菌数每lg或lml不得过100cfu。
大肠埃希菌每1g 或lml不得检出。
大肠菌群每1g应小于100个。
每1ml应小于10个。
2.3 含豆豉、神曲等发酵原粉的制剂细菌数每1g不得过l00000cfu。
每lml不得过1000cfu。
霉菌和酵母菌数每lg或lml不得过500cfu。
每lml不得过100cfu。
大肠埃希菌每1g 或lml不得检出。
大肠菌群每1g应小于100个。
每1ml应小于10个。
3. 局部给药制剂3.1 用于手术、烧伤及严重创伤的局部给药制剂应符合无菌检查法规定。
3.2 用于表皮或黏膜不完整的含药材原粉的局部给药制剂细菌数每1g或l0cm2不得过1000cfu。
每lml不得过100cfu。
霉菌和酵母菌数每1g、lml 或l0cm2不得过100cfu。
金黄色葡萄球菌、铜绿假单胞菌每1g、lml 或l0cm2不得检出。
3.3 用于表皮或黏膜完整的含药材原粉的局部给药制剂细菌数每1g或l0cm2不得过10000cfu。
每lml不得过100cfu。
霉菌和酵母菌数每1g、lml 或l0cm2不得过100cfu。
金黄色葡萄球菌、铜绿假单胞菌每1g、lml 或l0cm2不得检出。