中国药典2010版、质量标准
- 格式:ppt
- 大小:343.00 KB
- 文档页数:11

明胶空心胶囊Mingjiao Kongxin JiaonangVacant Gelatin Capsules本品系由胶囊用明胶加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂二氧化钛)、半透明(一节含遮光剂,一节不含)、不透明(两节均含遮光剂)三种。
【鉴别】(1)取本品0.25g,加水50ml,加热使溶化,放冷、摇匀,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)的混合液数滴,即生产橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml,加水50ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品约0.3g,置试管中,加钠石灰少许,产生的气体能使湿润的红色石蕊试纸变蓝色。
【检查】松紧度取本品10粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合、锁合,逐粒于1m 的高度处直坠于厚度为2cm的木板上,应不漏粉;如有少量漏粉,不得超过1粒。
如超过,应另取10粒复试,均应符合规定脆碎度取本品50粒,置表面皿中,移入盛有硝酸镁饱和溶液的干燥器内,置25±1℃恒温24小时,取出,立即分别逐粒放入直立在木板(厚度2cm)上的玻璃管(内径为24mm,长为200mm)内,将圆柱形砝码(材质为聚四氟乙烯,直径为22mm,重20±0.1g)从玻璃管口处自由落下,视胶囊是否破裂,如有破裂,不得超过5粒。
崩解时限取本品6粒,装满滑石粉,照崩解时限检查法(附录ⅩA)胶囊剂项下的方法,加挡板进行检查,各粒均应在10分钟内全部溶化或崩解。
如有1粒不能全部溶化或崩解,应另取6粒复试,均应符合规定。
黏度取本品4.50g,置已称定重量的100ml烧杯中,加温水20ml,置60℃水浴中搅拌,使溶化。
取出烧杯,擦干外壁,加水使胶液总重量达到下列计算式的重量(含干燥品15.0%),将胶液搅匀后倒入干燥的具塞锥形瓶中,密塞,置40℃±0.1℃水浴中,约10分钟后,移至平氏黏度计内,照黏度测定法(附录ⅥG第一法,毛细管内径为2.0 mm),于40℃±0.1℃水浴中测定,本品运动黏度不得低于60mm2/s。
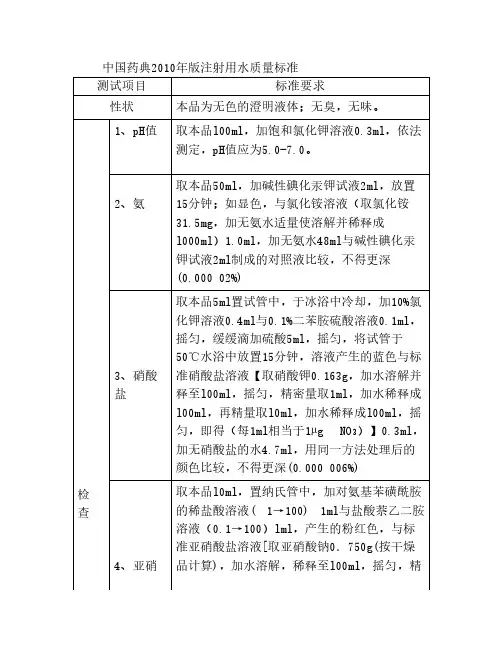
中国药典2010年版注射用水质量标准测试项目标准要求性状本品为无色的澄明液体;无臭,无味。
检查1、pH值取本品l00ml,加饱和氯化钾溶液0.3ml,依法测定,pH值应为5.0-7.0。
2、氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成l000ml)1.0ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 02%)3、硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液【取硝酸钾0.163g,加水溶解并释至l00ml,摇匀,精密量取1ml,加水稀释成l00ml,再精量取l0ml,加水稀释成l00ml,摇匀,即得(每1ml相当于1µg NO3)】0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)4、亚硝取本品l0ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液( 1→100) 1ml与盐酸萘乙二胺溶液(0.1→100)lml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至l00ml,摇匀,精酸盐密量取1ml,加水稀释成l00ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1µg NO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000 002%)5、电导率μS/cm 25℃时小于1.3,60℃时小于2.2,70℃时小于2.5,75-90℃时小于2.7,95℃时小于2.9,100℃时小于3.1。
6、总有机碳不得过0.50mg/L。
7、不挥发物取本品l00ml,置105℃恒重的蒸发皿中,在水浴上蒸干,并在105℃干燥至恒重,遗留残渣不得过1mg。
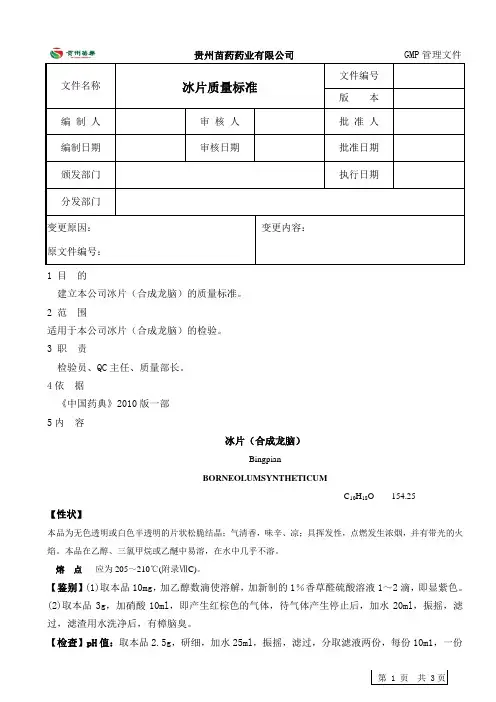
贵州苗药药业有限公司 GMP 管理文件第 1 页 共 3页文件名称冰片质量标准文件编号版 本编 制 人 审 核 人 批 准 人 编制日期审核日期批准日期 颁发部门执行日期分发部门变更原因: 原文件编号: 变更内容:1 目 的建立本公司冰片(合成龙脑)的质量标准。
2 范 围适用于本公司冰片(合成龙脑)的检验。
3 职 责检验员、QC 主任、质量部长。
4依 据《中国药典》2010版一部 5内 容冰片(合成龙脑)BingpianBORNEOLUMSYNTHETICUMC 10H 18O 154.25【性状】本品为无色透明或白色半透明的片状松脆结晶;气清香,味辛、凉;具挥发性,点燃发生浓烟,并有带光的火焰。
本品在乙醇、三氯甲烷或乙醚中易溶,在水中几乎不溶。
熔 点 应为205~210℃(附录ⅦC)。
【鉴别】(1)取本品10mg ,加乙醇数滴使溶解,加新制的1%香草醛硫酸溶液1~2滴,即显紫色。
(2)取本品3g ,加硝酸10ml ,即产生红棕色的气体,待气体产生停止后,加水20ml ,振摇,滤过,滤渣用水洗净后,有樟脑臭。
【检查】pH 值:取本品2.5g ,研细,加水25ml ,振摇,滤过,分取滤液两份,每份10m1,一份贵州苗药药业有限公司GMP管理文件文件名称冰片质量标准文件编号版本加甲基红指示液2滴,另一份加酚酞指示液2滴,均不得最红色。
不挥发物:取本品10g,置称定重量的蒸发皿中,置水浴上加热挥发后,在105℃干燥至恒重,遗留残渣不得过3.5mg(0.035%)。
水分:取本品lg,加石油醚10ml,振摇使溶解,溶液应澄清。
重金属:取本品2g,加乙醇23ml溶解后,加稀醋酸2ml,依法检查(附录ⅨE第一法),含重金属不得过百万分之五。
砷盐:取本品1g,加氢氧化钙0.5g与水2ml,混匀,置水浴上加热使本品挥发后,放冷,加盐酸中和,再加盐酸5ml与水适量使成28ml,依法检查(附录ⅨF),含砷量不得过百万分之二。

五味子2010版中国药典质量标准WuweiziSCHISANDRAECHINENSISFRUCTUS本品为木兰科植物五味子schisandrnfhinensis(Turcz.)Baill.的干燥成熟果实。
习称“北五味子”。
秋季果实成熟时采摘,晒干或蒸后晒干,除去果梗和杂质。
【性状】本品呈不规则的球形或扁球形,直径5~8mm。
表面红色、紫红色或暗红色,皱缩,显油润;有的表面呈黑红色或出现“白霜”。
果肉柔软,种子1~2,肾形,表面棕黄色,有光泽,种皮薄而脆。
果肉气微,味酸;种子破碎后,有香气,味辛、微苦。
【鉴别】(1)本品横切面:外果皮为1列方形或长方形细胞,壁稍厚.外被角质层,散有油细胞;中果皮薄壁细胞l0余列,含淀粉粒,散有小型外韧型维管束;内果皮为1列小方形薄壁细胞。
种皮最外层为1列径向延长的石细胞,壁厚,纹孔和孔沟细密;其下为数列类圆形、三角形或多角形石细胞,纹孔较大;石细胞层下为数列薄壁细胞.种脊部位有维管束;油细胞层为1列长方形细胞,含棕黄色油滴;再下为3~5列小形细胞;种皮内表皮为l列小细胞,壁稍厚,胚乳细胞含脂肪油滴及糊粉粒。
粉末暗紫色。
种皮表皮石细胞表面观呈多角形或长多角形,直径18~50μm,壁厚,孔沟极细密,胞腔内含深棕色物。
种皮内层石细胞呈多角形、类圆形或不规则形,直径约至83μm,壁稍厚,纹孔较大。
果皮表皮细胞表面观类多角形,垂周壁略呈连珠状增厚,表面有角质线纹;表皮中散有油细胞。
中果皮细胞皱缩,含暗棕色物,并含淀粉粒。
(2)取本品粉末1g,加三氯甲烷20ml,加热回流30分钟,滤过,滤液蒸干,残渣加三氯甲烷1m1使溶解,作为供试品溶液。
另取五味子对照药材1g,同法制成对照药材溶液。
再取五味子甲素对照品,加三氯甲烷制成每1ml含1mg的溶液,作为对照品溶液。
照《薄层色谱法检验标准操作程序》(附录ⅥB)试验,吸取上述3种溶液各2μl,分别点于同一硅胶GF254,薄层板上,以石油醚(30~60℃)一甲酸乙酯甲酸(15:5:1)的上层溶液为展开剂,展开,取出.晾干,置紫外光灯(254nm)下检视。



细胞培养基质量标准及检验方法中国医药生物技术协会二0一一年四月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准细胞培养基质量应符合表1所示的技术要求。
表1 技术要求二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
2.1 澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
2.2 pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤA进行。
2.3 干燥减量的测定按中华人民共和国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。
2.4 渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
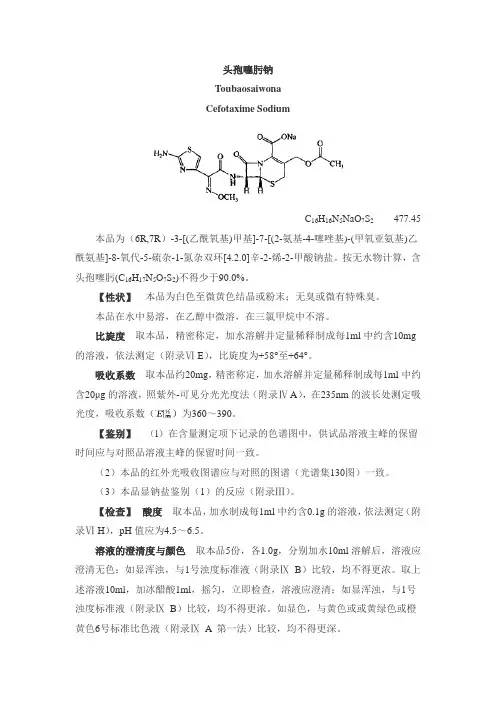
头孢噻肟钠ToubaosaiwonaCefotaxime SodiumC16H16N5NaO7S2477.45 本品为(6R,7R)-3-[(乙酰氧基)甲基]-7-[(2-氨基-4-噻唑基)-(甲氧亚氨基)乙酰氨基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸钠盐。
按无水物计算,含头孢噻肟(C16H17N5O7S2)不得少于90.0%。
【性状】本品为白色至微黄色结晶或粉末;无臭或微有特殊臭。
本品在水中易溶,在乙醇中微溶,在三氯甲烷中不溶。
比旋度取本品,精密称定,加水溶解并定量稀释制成每1ml中约含10mg 的溶液,依法测定(附录Ⅵ E),比旋度为+58°至+64°。
吸收系数取本品约20mg,精密称定,加水溶解并定量稀释制成每1ml中约含20μg的溶液,照紫外-可见分光光度法(附录Ⅳ A),在235nm的波长处测定吸光度,吸收系数()为360~390。
【鉴别】(l)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集130图)一致。
(3)本品显钠盐鉴别(1)的反应(附录Ⅲ)。
【检查】酸度取本品,加水制成每1ml中约含0.1g的溶液,依法测定(附录Ⅵ H),pH值应为4.5~6.5。
溶液的澄清度与颜色取本品5份,各1.0g,分别加水10ml溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(附录ⅨB)比较,均不得更浓。
取上述溶液10ml,加冰醋酸1ml,摇匀,立即检查,溶液应澄清;如显浑浊,与1号浊度标准液(附录ⅨB)比较,均不得更浓。
如显色,与黄色或或黄绿色或橙黄色6号标准比色液(附录Ⅸ A 第一法)比较,均不得更深。
有关物质取本品适量,精密称定,加流动相A溶解并定量稀释制成每1ml 中含1mg的溶液,作为供试品溶液(此溶液配制后应立即进样);另取头孢噻肟对照品适量,加流动相A溶解并定量稀释制成每1ml中含10μg的溶液,作为对照溶液。

2010年版《中国药典》二部制剂通则口服溶液剂:药物溶解于适宜溶剂中制成供口服的澄清液体制剂。
滴剂:用适宜的量具以小体积或以滴计量的口服溶液剂、口服混悬剂、口服乳剂的液体制剂。
生产与贮藏期间应符合下列规定:1.口服溶液剂的溶剂常用纯化水。
2.根据需要可加入适宜的附加剂,如防腐剂、分散剂、助悬剂、增稠剂、助溶剂、润湿剂、缓冲剂、稳定剂、乳化剂、矫味剂以与色素等。
其品种与用量应符合国家标准的有关规定,不影响产品的稳定性,并避免对检验产生干扰。
3.不得有发霉、酸败、变色、异物、产生气体或其他变质现象。
4.除另有规定外,应密封、遮光贮存。
除另有规定外,口服溶液剂应进行一下相应检查。
装量:除另有规定外,单剂量包装的口服溶液剂装量,应符合下列规定。
取供试品10支,分别将内容物倾尽,测定其装量,每支装量均不得少于其标示量。
微生物限度:照微生物限度检查法(2010年版《中国药典》附录XI J)检查,应符合规定。
附录XI J微生物限度检查法检验量:一次试验所用的供试品量。
除另有规定外,一般供试品的检验量为10g或10ml。
要求检查沙门菌的供试品,其检验量应增加20g或20ml。
检验时,应从2个以上最小包装单位中抽取供试品。
一般应随机抽取不少于检验用量(两个以上最小包装单位)的3倍量供试品。
微生物限度标准:口服给药制剂细菌数:每1ml不得过100cfu。
霉菌和酵母菌数:每1ml不得过100cfu。
大肠埃希菌:每1ml不得检出。
防腐剂用量限度:2010版《中国药典》附录I K糖浆剂。
山梨酸和苯甲酸的用量不得超过0.3%,(其钾盐、钠盐的用量分别按酸计算)。
羟苯酯类的用量不得超过0.05%。
2010年版《中国药典》附录XIX N 抑菌剂效力检查法指导原则抑菌剂效力检查法是用于测定灭菌、非灭菌制剂中抑菌剂的活性,以评价最终产品的抑菌效力,同时也可用于指导生产企业在研发阶段制剂中抑菌剂浓度的确定。
产品分类属于3类:口服非固体制剂(非抗酸剂)。

中国药典2010版中国药典(Chinese Pharmacopoeia,简称CP)是指在我国境内生产或进口药品的生产、经营和使用过程中使用的标准规范文献。
而中国药典2010版是一部重要的药品标准参考书,是指导我国药品生产和使用的权威性文件。
1. 药典的作用和意义中国药典的编制和实施对于保证药品的质量、安全和有效性具有重要意义。
它提供了药品质量标准的基础,帮助药品生产企业进行药品质量控制和质量管理,保障人民群众的用药安全。
中国药典2010版作为最新的版本,对药品的质量标准进行了全面更新和修订。
它的发布完善了我国的药品法规体系,提高了整个药品行业的水平,推动了我国药品产业的发展。
2. 中国药典2010版的特点中国药典2010版相对于之前的版本,在以下几个方面有了新的特点和改进。
2.1 引入PH. Eur.和USP标准中国药典2010版大量引进了“欧洲药典”(PH. Eur.)和“美国药典”(USP)的标准。
这些国际药典在药品质量标准方面具有较高的权威性和国际认可度,引入这些标准有助于我国药典与国际接轨,提高药品质量标准的水平。
2.2 严格审定药品成分和质量标准中国药典2010版在药品成分和质量标准的审定方面更加严格和细致。
通过严格的实验研究和论证,确保药品的质量和有效性,并杜绝了劣质药品的生产和流通。
2.3 增加新药品和新疗法的标准随着医学科学的不断发展,新药品和新疗法层出不穷。
中国药典2010版增加了一批新药品和新疗法的标准,覆盖了更多的治疗领域,使得中国药典更加全面和实用。
3. 中国药典2010版的应用中国药典2010版主要应用在以下几个方面:3.1 药品注册和审批药品企业在进行药品注册和药品审批时需要参考中国药典2010版的相关标准。
只有符合药典标准的药品才能够获得批准生产和销售。
3.2 药品质量控制药品生产企业在生产过程中需要参照中国药典2010版的标准进行质量控制。
通过严格控制生产环节和检验程序,确保药品的质量符合标准要求。
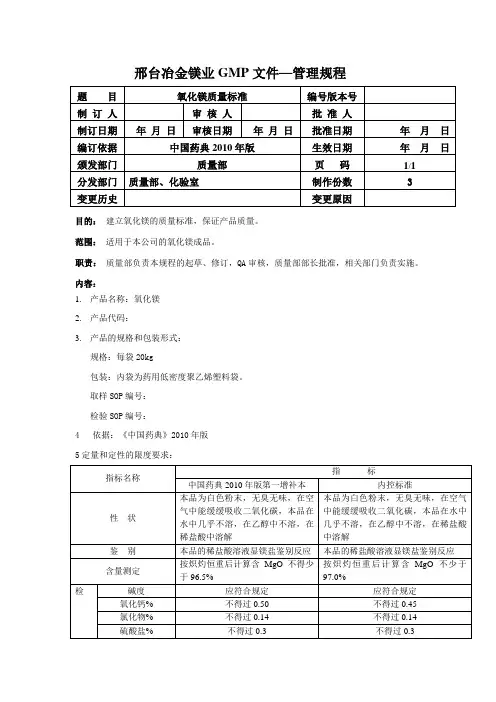
2010版中国药典石斛质量标准1 标准依据《中国药典》2010年版一部。
2 内容2.1 物料名称与代码物料名称:石斛物料代码:Z0072.2来源本品为兰科植物金釵石斛Dendrobium nobile Lindl.、鼓槌石斛Dendrobium chrysotoxum Lindl或流苏石斛Dendrobium fimbriatum Hook.的栽培品及其同属植物近似种的新鲜或干燥茎。
全年均可采收,鲜用者除去根和泥沙;干用者采收后,除去杂质,用开水略烫或烘软,再边搓边烘晒,至叶鞘搓净,干燥。
2.3 性状鲜石斛呈圆柱形或扁圆柱形,长约30cm,直径0.4-1.2cm。
表面黄绿色,光滑或有纵纹,节明显,色较深,节上有膜质叶鞘。
肉质多汁,易折断。
气微,味微苦而回甜,嚼之有黏性。
金釵石斛呈扁圆柱形,长20-30cm,直径0.4-0.6cm,节间长2.5-3cm。
表面金黄色或黄中带绿色,有深纵沟。
质硬而脆,断面较平坦而疏松。
气微,味苦。
鼓槌石斛呈粗纺锤形, 中部直径1~3cm,具3~7节。
表面光滑,金黄色,有明显凸起的棱。
质轻而松脆,断面海绵状。
气微,味淡,嚼之有黏性。
流苏石斛等呈长圆柱形,长20~150cm,直径0.4~1.2cm,节明显,节间长2~6cm。
表面黄色至暗黄色,有深纵槽。
质疏松,断面平坦或呈纤维性。
味淡或微苦,嚼之有黏性。
2.4 鉴别(1)本品横切面:金钗石斛表皮细胞1列,扁平,外被鲜黄色角质层。
基本组织细胞大小较悬殊,有壁孔,散在多数外韧型维管束,排成7~8圈。
维管束外侧纤维束新月形或半圆形,其外侧薄壁细胞有的含类圆形硅质块,木质部有1~3个导管直径较大。
含草酸钙针晶细胞多见于维管束旁。
鼓槌石斛表皮细胞扁平,外壁及侧壁增厚,胞腔狭长形;角质层淡黄色。
基本组织细胞大小差异较显著。
多数外韧型维管束略排成10~12圈。
木质部导管大小近似。
有的可见含草酸钙针晶束细胞。
流苏石斛等表皮细胞扁圆形或类方形,壁增厚或不增厚。
2010版《中国药典》纯化水质量标准本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【性状】本品为无色的澄清液体;无臭,无味。
【检查】酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐取本品5ml置试管中,于水浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1ugNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
亚硝酸盐取本品10ml,置纳氏管中,对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.75g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ugNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%)。
氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氨化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.00003%)。
总有机碳不得过0.50mg/L(0.5ppm 、500ppb)易氧化物取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
三七2010版中国药典质量标准SanqiN0T0GINSENGRADIXETRHIZ0MA本品为五加科植物三七Panaxnotoginseng(Burk.)F.H.Chen的干燥根和根茎。
秋季花开前采挖,洗净,分开主根、支根及根茎,干燥。
支根习称“筋条”,根茎习称“剪口”。
【性状】主根呈类圆锥形或圆柱形,长1~6cm,直径1~4cm。
表面灰褐色或灰黄色,有断续的纵皱纹和支根痕。
顶端有茎痕,周围有瘤状突起。
体重,质坚实,断面灰绿色、黄绿色或灰白色,木部微呈放射状排列。
气微,味苦回甜。
筋条呈圆柱形或圆锥形,长2~6cm,上端直径约0.8era,下端直径约0.3cm。
剪口呈不规则的皱缩块状或条状,表面有数个明显的茎痕及环纹,断面中心灰绿色或白色,边缘深绿色或灰色。
【鉴别】(1)本品粉末灰黄色。
淀粉粒甚多,单粒圆形、半圆形或圆多角形,直径4~30μm;复粒由2~10余分粒组成。
树脂道碎片含黄色分泌物。
梯纹导管、网纹导管及螺纹导管直径15~55μm。
草酸钙簇晶少见,直径50~80μm。
(2)取本品粉末0.5g,加水5滴,搅匀,再加以水饱和的正丁醇5m1,密塞,振摇10分钟,放置2小时,离心,取上清液,加3倍量以正丁醇饱和的水,摇匀,放置使分层(必要时离心),取正丁醇层,蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取人参皂苷Rb1对照品、人参皂苷Re 对照品、人参皂苷Rg1对照品及三七皂苷R1对照品,加甲醇制成每1ml各含0.5mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各1μl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15:40:22:10)10℃以下放置的下层溶液为展开剂,展开,取出,晾于,喷以硫酸溶液(1—10),在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;置紫外光灯(365nm)下检视,显相同的荧光斑点。
磷酸氢二钠Linsuan Qing'ernaDisodium Hydrogen Phosphate DodecahydrateNa2HPO4·12H20 358.14[10039-32-4]本品按干燥品计算,含Na2HP04不得少于99.0%。
【性状】本品为无色或白色结晶或块状物;无臭;常温置空气中易风化。
本品在水中易溶,在乙醇中几乎不溶。
【鉴别】本品的水溶液显钠盐与磷酸盐的鉴别反应(附录Ⅲ)。
【检查】碱度取本品1.0g,加水20ml溶解后,依法测定(附录Ⅵ H),pH值应为9.l~9.4。
溶液的澄清度与颜色取本品1.0g,加水l0ml溶解后,溶液应澄清无色。
氯化物取本品5.0g,依法检查(附录Ⅶ A),与标准氯化钠溶液5.0ml制成的对照液比较,不得更浓(0.001%)。
硫酸盐取本品2.0g,依法检查(附录Ⅶ B),与标准硫酸钾溶液2.0 ml制成的对照液比较,不得更浓(0.01%)。
碳酸盐取本品2.0g,加水l0ml,煮沸,冷却后,加盐酸2ml,应无气泡产生。
水中不溶物取本品20.0g,加热水l00ml使溶解,用经105℃干燥至恒重的4号垂熔坩埚滤过,沉淀用热水200ml分10次洗涤,在105℃干燥2小时,遗留残渣不得过10mg (0.05%)。
还原物质取本品5.0g,加新沸过的冷水溶解并稀释至50ml,量取5.0ml,加稀硫酸5ml 与高锰酸钾滴定液 (0.02mol/L)0.25ml,水浴加热5分钟,溶液的紫红色不消失。
干燥失重取本品,在130℃干燥至恒重,减失重量应为55.0%~64.0%附录Ⅷ L)。
铁盐取本品2.0g,加水20ml溶解后,加盐酸溶液(1→2)lml与10%磺基水杨酸溶液2ml,摇匀,加氨试液5ml,摇匀,如显色,与标准铁溶液(附录Ⅷ G)1.0ml用同一方法制成的对照液比较,不得更深(0.0005%).重金属取本品4.0g,加水15ml溶解后,加盐酸适量调节溶液pH值约为4,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,依法检查(附录Ⅶ H第一法),含量金属不得过百万分之五。