关于2010年版《中国药典》第二增补本品种的公示
- 格式:doc
- 大小:199.50 KB
- 文档页数:5

关于2010年版《中国药典》第二增补本品种的公示
更新日期: 2012年4月9日下午3:42
29 乳癖消颗粒
30 参苓白术丸
31 参苓白术颗粒
32 季德胜蛇药片
33 金匮肾气丸
34 金匮肾气片
35 保和片
36 保和颗粒
37 冠心苏合胶囊
38 复方丹参胶囊
39 活血止痛胶囊
40 胃苏颗粒
41 茵栀黄颗粒
42 香砂养胃丸(浓缩丸)
43 消炎利胆胶囊
44 消炎利胆颗粒
45 益母草片
46 益母草胶囊
47 通宣理肺颗粒
48 速效救心丸
49 接骨七厘片
50 清开灵颗粒
51 蛇胆川贝液
52 银黄片
53 颈舒颗粒
54 黄连上清胶囊
55 黄连上清颗粒
56 普乐安片
57 普乐安胶囊
58 舒筋活血丸
59 舒筋活血片
60 橘红片
61 橘红胶囊
2、新增品种
序号品种名称
1 金嗓清音丸
2 保济口服液
3 脉安颗粒
4 健脾生血颗粒。

目录1.关于2010年版药典(二部)增修订内容及新增品种(第一批)的公示·········22.关于2010年版药典(二部)增修订内容及新增品种(第二批)的公示·········23.关于2010年版药典(二部)增修订内容及新增品种(第三批)的公示·········24.2010年版药典(二部)增补本增修订内容-第四批·········································35.2010年版药典增补本拟新增品种公示-第四批·················································56.2010年版药典(二部)增补本增修订内容(第五批)··································77.附件:2010年版药典增补本拟新增品种公示-第五批·········································98.附件:关于2010年版药典(二部)增补本的公示(第六批)····························99.关于2010年版药典(二部)增补本的公示(第七批)·································101.关于2010年版药典(二部)增修订内容及新增品种(第一批)的公示更新日期:2010年6月12日上午10:22我委现将2010年版药典(二部)增修订内容及新增品种(第一批)进行公示,增修订内容见附件。


征求意见稿2010 年版药典(二部)增修订内容及新增品种公示(第三批)一、增修订品种诺氟沙星胶囊[订正]【检查】其他 应符合胶囊剂项下有关的各项规定(附录Ⅰ E)。
盐酸甲氯芬酯[订正]【检查】有机酸 第4行“消耗氢氧化钠滴定液(1.0mol/L)不得过0.54ml”改为“消耗氢氧化钠滴定液(0.1mol/L)不得过0.54ml”。
富马酸亚铁咀嚼片 [订正] 【鉴别】(1)第1行“取本品,除去包衣后,研细,取细粉适量(约相当于富马酸亚铁2g)”改为“取本品细粉适量(约相当于富马酸亚铁2g)”硫唑嘌呤片 [订正]【检查】有关物质 第4行“供试品溶液色谱图中如有与对照品溶液色谱图中6-巯基嘌呤峰……”改为“供试品溶液色谱图中如有与对照品溶液(1)色谱图中6-巯基嘌呤峰……”。
卡莫司汀 [订正]【检查】干燥失重 第2行“60℃减压干燥至恒重……”改为“减压干燥至恒重……吸收性明胶海绵 [修订] 【检查】甲醛 取本品10片,剪碎,混合均匀,精密称取0.5g,加水100ml,浸泡2小时,并时时振摇,吸取上清液 1.0ml,加变色酸试液20ml,摇匀,加塞,置水浴中加热30分钟,放冷,照紫外-可见分光光度法(附录Ⅳ A),在570nm 的波长处测定吸光度,与征求意见稿0.003%(W/V)标准甲醛溶液1.0ml 同法制成的对照液比较,吸光度不得更大(0.6%)。
注射用盐酸甲氯芬酯[修订]【检查】溶液的澄清度 “取本品,每支加水5ml 溶解后,溶液应澄清……”改为“取本品,加水溶解并稀释制成每1ml 中约含50mg 的溶液,溶液应澄清……”。
叶酸[增订]【检查】有关物质 取本品约100mg ,精密称定,置100ml 量瓶中,加氨试液约1ml 使溶解,用流动相稀释至刻度,摇匀,作为供试品溶液。
精密量取适量,加流动相定量稀释制成每1ml 中约含1μg 的溶液作为对照溶液。
取蝶酸10mg ,置100ml 量瓶中,加0.1mol/L 磷酸钠溶液5ml 与供试品溶液10ml ,用流动相溶解并稀释至刻度,摇匀,照含量测定项下的色谱条件,取10μl 注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。

2010年药典第二增补本2010年药典第二增补本是中华人民共和国卫生部制定的医药领域的重要规范性文件,全称为《中华人民共和国药典-药品行业标准-药典增补本(2010年)第二部》。
这本药典增补本是在原有2010年药典的基础上进行修订和增补而成,为医药行业的规范发展和药品质量的保证起到了重要的作用。
首先,2010年药典第二增补本对于药品的规格和质量标准做出了详细的规定。
药品对于人们的生命健康至关重要,因此药品的质量必须得到严格的控制和保证。
增补本对于常用的药品进行了规格和质量标准的明确,从原材料的选择、生产工艺的控制到最终产品的质量检测等方面进行了全面的规定。
这对于提升药品的质量和可靠性具有十分重要的意义。
其次,2010年药典第二增补本对于公共卫生和个人健康也起到了积极的作用。
药品的规范使用和正确用药对于人们的健康至关重要,特别是在公共卫生事件和突发疫情等情况下,正确用药更是关系到整个社会的健康和稳定。
增补本对于药品的使用说明、禁忌和注意事项进行了详细的规定,确保了药品的正确使用,避免了因为错误使用导致的不良反应和副作用。
更重要的是,增补本还对药品的储存和运输等环节进行了规范,避免了药品质量受到损害的可能。
此外,2010年药典第二增补本还推动了医药行业的技术创新和科学发展。
药典是医药行业的基础性文件,其质量要求和技术规范的更新对于新药开发和现有药品的改进至关重要。
增补本对于一些新药的质量标准进行了修订和增补,使得这些新药能够更好地适应市场需求,并保证了其安全性和有效性。
此外,增补本还对一些已有药品的质量标准进行了调整和完善,使得这些药品能够更好地适应现实临床需求。
总而言之,2010年药典第二增补本是医药领域的重要规范性文件,其规定的药品规格和质量标准能够确保药品的安全性和有效性。
增补本对于公共卫生和个人健康也起到了积极的作用,确保了药品的正确使用和储存运输,避免了不良反应和药品质量受到损害的可能。
此外,增补本还推动了医药行业的技术创新和科学发展,为新药开发和现有药品的改进提供了可靠的依据。


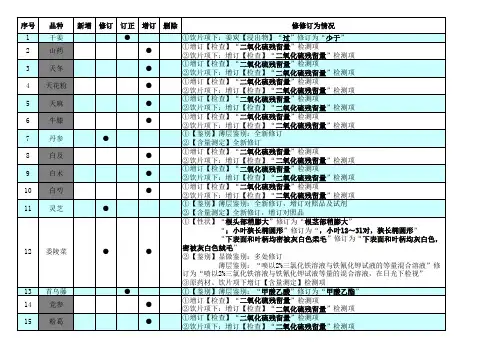
药典第二增补本近日,国家药典委发布了《中国药典》2010版第二增补本,共收载新增品种288个,修订或订正品种160个,其中中药材及饮片二氧化硫残留量限度标准收入到增补本内,规定中药材及饮片(矿物来源的中药材除外,下同)中亚硫酸盐残留量(以二氧化硫计)不得过150mg/kg,山药、牛膝、粉葛、天冬、天麻、天花粉、白及、白芍、白术、党参等10种中药材及其饮片中亚硫酸盐残留量(以二氧化硫计)不得过400mg/kg国家药典委关于《中国药典》2010年版第二增补本有关增修订内容的说明根据《药典委员会章程》和国家药品标准发展的要求,为适应药品研发、生产、检验、应用以及监督管理等方面的需要,国家药典委员会及时对国家药品标准进行增修订和订正,出版《中国药典》增补本。
增补本与现行版《中国药典》具有同等的法定地位。
自2010年10月1日《中国药典》2010年版执行以来,按照《中国药典》2015年版编制大纲所确定的内容,我委于2012年出版了第一增补本。
前一阶段我委经过广泛征求意见,进一步提出了增修订内容,通过药典委员会相关专业委员会审定并经网上公示,编制了《中国药典》2010年版第二增补本。
第二增补本共收载新增品种288个,修订或订正品种160个。
其中,一部新增75个(成方制剂75个),修订或订正102个(药材17个、成方制剂85个);二部新增210个(化学药204个、辅料6个),修订或订正42个(化学药37个、辅料5个);三部新增3个(预防类1个、治疗类2个),三部修订或订正16个(预防类11个、治疗类5个)。
对《中国药典》2010年版的附录也进行了增修订,其中一部增订5个、修订或订正9个;二部增订5 个、修订或订正6个;三部增订3个、修订或订正2个。
其中,中药材及饮片二氧化硫残留量限度标准已收载进第二增补本(有关情况说明见附件)。
第二增补本的修订内容采用全文刊载方式,变动部分辅以“■ ■”标记,并分别以[修订]、[订正]、[增订]和[删除]予以标识,以利于广大药学工作者及时掌握标准修订内容和方便使用。

《中国药典》版增补本增补内容序号《中国药典》2010年版第一增补本(一部)《中国药典》2010年版第一增补本(二部)新增品种乙醇丹七片头孢氨苄对乙酰氨基酚修订品种肌苷大黄安乃近山银花安乃近片川木香苯甲酸川贝母木通明胶龙胆牛膝枸橼酸钠当归补骨脂附子重质碳酸镁麦芽氧化镁苦杏仁诺氟沙星胶囊枇杷叶泽泻修订附录酸枣仁重金属检查法黄连滴定液酸枣仁牛黄解毒片订正附录妇康宁片最低装量检查法抗病毒口服液补中益气丸(水丸)修订附录重金属检查法酸败度检查法滴定液序号《中国药典》2010年版第二增补本(一部)《中国药典》2010年版第二增补本(二部)修订品种干姜修订附录山药一般鉴别试验牛膝铵盐检查法天冬粒度和粒度分布测定法丹参溶出度测定法白及白术白芍粉葛黄连酸枣仁龙胆泻肝丸板兰根颗粒复方鱼腥草片清火栀麦片修订附录药材和饮片检定通则显微鉴别法一般鉴别试验炽灼残渣检查法膨胀度测定法鞣质含量测定法序号《中国药典》2005年版增补本《中国药典》2005年版增补本一部修订品种一部修订附录三七药材检定通则大青叶杂质检查法牛蒡子砷盐检查法丹参微生物限度检查法甘草对照品对照药材对照提取物石膏龙胆白术二部修订品种白芍马来酸氯苯那敏百部头孢氨苄连翘明胶苦杏仁盐酸小檗碱片郁金诺氟沙星胶囊金钱草淀粉金银花糊精荆芥茵陈茯苓二部修订附录栀子砷盐检查法粉葛崩解时限检查法浙贝母微生物限度检查法桑白皮试液黄芪滴定液炙黄芪标准品与对照品表黄连黄柏菟丝子酸枣仁罂粟壳甘草浸膏黄芩提取物六味地黄丸石淋通片板兰根颗粒。

酸枣仁色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-O.05m o l/L磷酸二氢钾溶液(50:50) (每100m l中加十二烷基硫酸钠0.4g.再以磷酸调节p H值为4.0)为流动相;检测波长为345nm。
理论板数按盐酸小檗碱峰计算应不低于5000。
对照品溶液的制备取盐酸小檗碱对照品适置,精密称定,加甲醇制成每〗m l含90.5埤的溶液,即得。
供试品溶液的制备取本品粉末(过二号筛)约0.2g,精密称定,置具塞锥形瓶中,精密加人甲醇-盐酸(100:1)的混合溶液50m l,密塞,称定重量,超声处理(功率250W.频率40k H z)30分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液2m l,置10m l量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液与供试品溶液各10M1,注人液相色谱仪,测定,以盐酸小檗碱对照品的峰面积为对照,分别计算小檗碱、表小檗碱、黄连碱和巴马汀的含量,用待测成分色谱峰与盐酸小檗碱色谱峰的相对保留时间确定。
表小檗喊、黄连碱、巴马汀、小檗碱的峰位,其相对保留时间应在规定值的±5%范围之内,即得。
相对保留时间见下表:待测成分(蜂)相对保留时间表小檗碱0. 71黄连碱0. 78巴马汀0. 91小檗碱 1. 00本品按干燥品计算.,以盐酸小檗碱(C^H u C l N C X)计,含小檗碱(C^H n N C U不得少于5.5%,表小檗碱(^。
叶7~04)不得少于0.80%,黄连碱((:1943:^04)不得少于1.6%,巴马汀(C21H21 N04)不得少于1.5%。
雅连按干燥品计算,以盐酸小檗碱(C^H uC lN O,)计,含小檗碱(Q。
H17 N04)不得少于4. 5%。
云连按干燥品计算,以盐酸小檗碱(C2Q H1B C1N(^)计,■含小檗碱(C2。
H17 NO, )_[i T i E]不得少于7. 0%。
国家药典委关于《中国药典》2010年版第二增补本有关增修订内容的说明2013年04月27日发布根据《药典委员会章程》和国家药品标准发展的要求,为适应药品研发、生产、检验、应用以及监督管理等方面的需要,国家药典委员会及时对国家药品标准进行增修订和订正,出版《中国药典》增补本。
增补本与现行版《中国药典》具有同等的法定地位。
自2010年10月1日《中国药典》2010年版执行以来,按照《中国药典》2015年版编制大纲所确定的内容,我委于2012年出版了第一增补本。
前一阶段我委经过广泛征求意见,进一步提出了增修订内容,通过药典委员会相关专业委员会审定并经网上公示,编制了《中国药典》2010年版第二增补本。
第二增补本共收载新增品种288个,修订或订正品种160个。
其中,一部新增75个(成方制剂75个),修订或订正102个(药材17个、成方制剂85个);二部新增210个(化学药204个、辅料6个),修订或订正42个(化学药37个、辅料5个);三部新增3个(预防类1个、治疗类2个),三部修订或订正16个(预防类11个、治疗类5个)。
对《中国药典》2010年版的附录也进行了增修订,其中一部增订5个、修订或订正9个;二部增订5个、修订或订正6个;三部增订3个、修订或订正2个。
其中,中药材及饮片二氧化硫残留量限度标准已收载进第二增补本(有关情况说明见附件)。
第二增补本的修订内容采用全文刊载方式,变动部分辅以“■■”标记,并分别以[修订]、[订正]、[增订]和[删除]予以标识,以利于广大药学工作者及时掌握标准修订内容和方便使用。
目前我委已将第二增补本定稿及颁布请示上报至国家食品药品监督管理总局进行批准颁布工作,预计六月底前完成出版印刷工作。
第二增补本将按照国家食品药品监督管理总局有关公告明确的执行日期开始实施,请相关单位和药品企业积极做好执行第二增补本标准有关准备工作。
附件:国家药典委关于《中国药典》2010年版第二增补本收载中药材及饮片二氧化硫残留限量有关情况的说明近年来,随着中药质量控制水平的提高和科研工作的发展,国家药典委员会在不断提升药品标准的同时,加强中药材及饮片中具有潜在风险的残留物质的控制。
国家药典委员会2010年版药典(二部)增修订内容及新增品种公示(第一批)一、增修订品种甲巯咪唑 Jiaqiu Mizuo Thiamazole书页号:中国药典2010年版二部-160[增订]【检查】 残留溶剂 苯 取本品约1.0g ,精密称定,置顶空瓶中,精密加水5ml 使溶解,密封,作为供试品溶液;精密称取苯适量,用水定量稀释制成每1ml 中约含0.4μg 的溶液,精密量取5ml ,置顶空瓶中,密封,作为对照品溶液。
照残留溶剂测定法(附录Ⅷ P 第二法)测定,以6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相近)为固定液;起始温度为70℃,维持8分钟,以每分钟30℃的速率升温至200℃,维持3分钟;进样口温度为220℃;检测器温度为250℃;顶空瓶平衡温度为85℃,平衡时间为30分钟。
取供试品溶液和对照品溶液分别顶空进样,记录色谱图,按外标法以峰面积计算,应符合规定。
复方炔诺酮片Fufang Quenuotong PianCompound Norethisterone Tablets书页号:中国药典2010年版二部-584 [订正]【检查】 溶出度 “……;另精密称取炔诺酮对照品约12mg,精密稳定,置200ml 量瓶中,……”改为“……;另精密称取炔诺酮对照品约12mg,置200ml 量瓶中,……”维生素B 1片Weishengsu B 1 Pian Vitamin B 1 Tablets书页号:中国药典2010年版二部-896 [订正]国家药典委员会【鉴别】 “取本品细粉适量,加水搅拌,滤过,滤液蒸干后,照维生素B 1鉴别项下试验,显相同的反应。
”订正为“取本品细粉适量,加水搅拌,滤过,滤液蒸干后,照维生素B 1鉴别(1)、(3)项试验,显相同的反应。
”维生素B 1注射液Weishengsu B 1 Zhusheye Vitamin B 1 Injection书页号:中国药典2010年版二部-897 [订正]【鉴别】 “取本品适量,照维生素B 1鉴别项下试验,显相同的反应。
《中国药典》2010年版(二部)概况河北省药品检验所2010年11月石家庄主要内容O 总体情况凡例的增修订情况© 各论的增修订情况举例附录增修订情况◎ y药典(药品标准)一点个人体含10年版与05年版二部增修订情况比较表10版二部各类品种的增修订情况标准中有较大变化的部分制剂品种(1)(主要是有关物质、含量测定项目)-乙酰半胱氨酸颗粒,乙酰哇胺片,二轻丙茶殓片、注射液,己烯雌酚注射液,己酮可可殓注射液,马来酸氯苯那敏注射液、片、滴丸,五氟利多片,贝诺酯片,牛磺酸颗粒,双氯芬酸钠肠溶片,双喀达莫片、注射液,丙戊酸钠片,甘露醇注射液,左氧氟沙星片,布美他尼注射液、片,丙谷氨片、胶囊,布洛芬片、胶囊,扑米酮片,标准中有较大变化的部分制剂品种(2)•卡马西平片、胶囊,卡托普利片,卡维地洛片、胶囊,甲芬那酸片、胶囊,甲氧氯普胺片,盐酸甲氧氯普胺注射液,甲氧节旋注射液,甲硝哇片、泡腾片、栓、胶囊、注射液,甲磺酸培氟沙星片、胶囊,甲磺酸酚妥拉明注射液,司坦哇醇片,尼莫地平片、分散片、胶囊,尼可刹米注射液,标准中有较大变化的部分制剂品种(3)•尼美舒利片,尼索地平片,对乙酰氨基酚片、胶囊、注射液,地高辛片,地西泮片, 达那异烟耕片、粉针,地塞米松磷酸钠注射液,西米替丁氯化钠注射液,达非哇胶囊,曲安奈德注射液,肌昔葡萄糖注射液,注射用肌昔,米非司酮片,安乃近片,异戊巴比妥片,异烟耕片,芬布芬片、胶囊,克霉哇乳膏、药膜、栓,咲喃妥因肠溶片,标准中有较大变化的部分制剂品种(4)-咲廛米注射液,毗哌酸胶囊、片,口引喙美辛肠溶片、乳膏,利福平注射液,谷氨酸钾注射液,泛酸钙片,阿司匹林肠溶片,阿普噪仑片,环扁桃酯胶囊,苯巴比妥钠片,注射用苯妥英钠,非诺贝特片、胶囊, 罗通定片,洛莫司汀胶囊,辛伐他汀片、胶囊,非诺贝特胶囊,标准中有较大变化的部分制剂品种(5) •复方十一烯酸复方磺胺唏喘片,盐酸依诺沙星片、胶苯海明片,苯殓缓释片,枸橡酸他莫昔芬片,枸椽酸芬太尼注射液,枸椽酸喷托维林片,氟康哇氯化钠注射液,氢化可的松注射液,氢氯廛嗪片,氢漠酸东萇君殓注射液,重酒石酸间轻胺注射液,复方卡托普利片,复方克霉噪乳膏,复方盐酸阿米洛利片,复方磺胺甲噁哇注射液,标准中有较大变化的部分制剂品种(6)•胆苯殓片,美洛昔康片、分散片、胶囊,洛莫司汀胶囊,盐酸乙胺丁醇片,枸椽酸喷托维林片,氢化可的松注射液,氢氟廛嗪片,氢漠酸东芨蓉殓片、注射液,水仙殓片,复方甘草片,复方卡托普利片,复方甲苯咪哇片,复方克霉哇乳膏,复方莪术油栓,复方铝酸钮胶囊、片,标准中有较大变化的部分制剂品种(7)•度米芬滴丸,盐酸马普替林片,盐酸布比卡因注射液,注射用盐酸甲氯芬酯,盐酸尼卡地平片,盐酸地芬尼多片,盐酸多巴胺注射液,盐酸多巴芬丁胺注射液,盐酸多塞平片,盐酸异丙肾上腺素注射液,盐酸异丙嗪片、注射液,盐酸利多卡因胶浆, 盐酸妥拉噪林片、注射液,盐酸阿米替林片,盐酸苯乙双肌片,盐酸苯海索片,盐酸奈福泮片、注射液,标准中有较大变化的部分制剂品种(8)•盐酸罗通定片,盐酸哌哇嗪片,盐酸哌替喘片、注射液,盐酸氟奋乃近片、注射液, 盐酸美沙酮片、注射液,盐酸倍他司汀片, 盐酸胺碘酮片、注射液、胶囊,盐酸麻黄碱注射液、滴鼻液,盐酸维拉帕米缓释片, 盐酸氯西那林片,盐酸氯米帕明片,盐酸氯胺酮注射液,盐酸普鲁卡因注射液,标准中有较大变化的部分制剂品种(9)•盐酸雷尼替丁注射液,盐酸漠己新片,格列齐特片(II),核黄素磷酸钠注射液,盐酸丁丙诺啡注射液,盐酸己氟拉嗪片,盐酸去氯轻嗪片,盐酸左氧氟沙星片、胶囊,盐酸布桂嗪片、注射液,盐酸甲氧明注射液,盐酸甲氯芬酯胶囊,盐酸曲吗多胶囊,盐酸伐昔洛韦片、胶囊,标准中有较大变化的部分制剂品种(10)•盐酸多沙普仑注射液,盐酸安他噪林片,盐酸利多卡因注射液,盐酸环丙沙星片、胶囊.滴眼液,盐酸帕罗西汀片,盐酸美西律注射液,盐酸莫雷西嗪帕酮注射液,氧氟沙星片、胶囊、滴眼液, 氨甲环酸片、注射液,烟酸占替诺注射液, 酒石酸美托洛米片、注射液、胶囊,标准中有较大变化的部分制剂品种(11)•盐酸消旋山萇蓉殓注射液,诺氟沙星软膏、滴眼剂,蔡普生片、栓、胶囊、颗粒,咖片,径基眼片,维A酸片,维生素B1片、注射液,维生素C 注射液(草酸检査),维生素E软胶囊,维生素K1注射液,联磺甲氧节旋片,葡萄糖酸亚铁片.胶囊、糖浆,硝西泮片,硝苯地平片、胶囊,标准中有较大变化的部分制剂品种(12)•硝酸甘油片、注射液,硝酸异山梨酯乳膏, 硝酸益康乳膏、栓、喷雾剂、溶液,硫酸亚铁片,氯硝西泮片、注射液,氯氮平片,氯氮片,氯磺径哇乳膏,奥沙西泮酮洛芬肠溶胶囊,酮康噪片、片* 9 bn m乳膏、胶囊,标准中有较大变化的部分制剂品种(13)•澳丙胺太林片,熊去氯胆酸片,醋酸甲径孕酮片,醋酸地塞米松片,醋酸曲安奈德注射液,磺胺咳呢片、混悬液,磷酸川茸嗪片、胶囊、注射液,磷酸可待因片,磷酸苯丙哌林颗粒、片、胶囊,磷酸氯唾片、注射液,螺内酯片、胶囊。