植物生理生化测定
- 格式:doc
- 大小:52.50 KB
- 文档页数:5

小黑豆相关生理指标测定1.表型变化:鲜重、株高、主根长和叶面积鲜重:取处理好的植株,擦干根和叶表面水分,测量整株植物的重量,每个测6个重复。
株高:取处理好的植株,测量从根和茎分隔处到植株最高点的高度,记录,每个测6个重复。
主根长:取处理好的植株,测量从根和茎分隔处到主根最远点长度,记录,每个测6个重复。
叶面积:取处理好的植株,选择第二节段的叶片,测量叶面积,叶面积测量方法是测每个叶片最宽处长度作为叶的长,测叶片最窄处长度作为叶的宽,叶片长和宽的乘积即为叶表面积。
每个测6个重复。
2.总蛋白、可溶性糖、丙二醛(MDA)和H2O2含量测定样品处理:取0.5g样品(叶片要去除叶脉、根要先用清水清洗干净),速在液氮中冻存,在遇冷的研钵中加液氮研磨,然后加入1.5ml的Tris-HCl(pH7.4)抽提,将抽提液转移到2ml的EP管中,于4℃,12000rpm离心15min,取上清,保存在-20℃下,上清液可用于总蛋白、丙二醛(MDA)、可溶性糖和H2O2含量测定。
总蛋白测定(Bradford法):样品反应体系(800ul H2O+200ul Bradford+5ul 样品),空白对照为(800ul H2O+200ul Bradford)。
测定后带入标准曲线Y=32.549X-0.224(Y代表蛋白含量,X代表OD595),计算得出蛋白含量。
可溶性糖测定:样品反应体系(1ml蒽酮+180ul ddH2O+20ul样品提取液);空白对照(1ml蒽酮+180ul ddH2O),测定OD625后带入标准曲线:Y=0.0345X+0.0204(Y代表OD625,X代表可溶性糖含量(ug))蒽酮配方:称取100mg蒽酮溶于100ml稀硫酸(76ml浓硫酸+30mlH2O).注意:浓硫酸加入水中时,一点一点递加,小心溅出受伤。
丙二醛(MDA)测定:在酸性和高温条件下,丙二醛可与硫代巴比妥(TBA)反应生成红棕色的3,5,5-三甲基恶唑2,4-二酮,在532nm处有最大吸收波长,但该反应受可溶性糖的极大干扰,糖与TBA的反应产物在532nm处也有吸收,但其最大吸收波长在450nm处。

植物生理学与生物化学研究方法植物生理学和生物化学是对植物生命过程进行深入研究的两个重要学科。
植物生理学研究植物在生长发育、代谢过程以及环境适应等方面的生理机制,而生物化学则着重于研究植物细胞和分子水平上的化学成分和反应。
本文将重点介绍植物生理学和生物化学研究中常用的方法和技术。
一、植物生理学研究方法1.生长分析法生长分析法是研究植物在时间和空间上的生长变化的一种重要方法。
它可通过测量植物的高度、叶面积、根系长度等参数,定量分析植物各组织器官的生长速率,并研究生长速率与外界环境因素的关系。
2.生理生化测定法生理生化测定法是研究植物代谢水平和功能活性的重要手段。
例如,酶活性测定可用于研究植物代谢过程中的关键酶活性变化;叶绿素含量测定可反映叶片光合能力水平;光谱测定可用于分析植物组织中的各种生物分子的含量和结构等。
3.生物学指标法生物学指标法是以某一生理生化指标作为植物对环境适应能力的评价指标。
例如,水分利用效率可通过测定植物封闭室内的水分蒸腾量和生物产量来评价植物对水分利用的效率;抗寒力可通过测定植物在低温下的生存能力和生长状态来评价植物的寒冷适应性等。
二、生物化学研究方法1.色谱分析法色谱分析法是生物化学领域中广泛应用的分离和定量分析方法。
其中,气相色谱法可用于分析植物挥发性成分和气体代谢产物;液相色谱法可用于分析植物中的有机酸、氨基酸、生物碱等物质。
2.质谱分析法质谱分析法是一种高灵敏度、高分辨率的分析技术,可用于鉴定植物中微量物质的种类和结构。
常用的质谱技术包括质谱-质谱联用技术(MS-MS)、电喷雾质谱技术(ESI-MS)、气相色谱-质谱联用技术(GC-MS)等。
3.荧光显微镜技术荧光显微镜技术是一种通过利用植物中的特定荧光探针来标记和可视化特定分子或结构的技术。
例如,利用叶绿素的自然荧光和活性氧荧光染料,可以观察植物光合作用过程中的能量传递和损伤情况。
总结:综上所述,植物生理学与生物化学研究方法多种多样,每一种方法都有其适用范围和特点。

植物生理生化指标测定植物生理生化指标测定是研究植物生长发育和适应环境的重要手段之一、通过测定植物的生理生化指标,可以了解植物的代谢活动、光合作用强度、水分状况、营养状况等,从而为植物生长调控、抗逆性研究提供依据。
下面将从光合作用测定、水分状况测定和营养状况测定三个方面对植物生理生化指标测定进行详细介绍。
光合作用是植物生长发育的重要过程之一,也是植物蓄积养分和能量的主要途径。
常用的光合作用测定指标有净光合速率、光饱和点、光补偿点和光抑制。
净光合速率是指单位时间内单位叶面积净光合产物的量,可以通过测定二氧化碳吸收量和氧气释放量来计算。
光饱和点是指植物的净光合速率达到最大值时的光强度,可以通过测定不同光强下的净光合速率来得出。
光补偿点是指净光合速率和呼吸速率相等的光强度,可以通过测定不同光强下的净光合速率和呼吸速率来确定。
光抑制是指过高或过低的光强度对植物光合作用的影响,可以通过测定光强对净光合速率的影响来评价。
水分状况是植物生理生化指标测定的重要方面之一,也是植物生长发育和适应环境的关键因素之一、常用的水分状况测定指标有相对含水量、蒸腾速率和水分利用效率。
相对含水量是指植物组织中的相对含水量与干重的比值,可以通过称量植物组织的湿重和干重来计算。
蒸腾速率是指单位时间内单位叶面积水分蒸腾的量,可以通过测定植物的蒸腾量和叶面积来计算。
水分利用效率是指植物单位干物质产量所需要的水分量,可以通过测定植物的干物质产量和水分消耗量来计算。
营养状况是植物生理生化指标测定的另一个重要方面,也是植物生长发育和代谢活动的基础。
常用的营养状况测定指标有叶绿素含量、叶绿素荧光参数和土壤养分含量。
叶绿素含量是评价植物叶绿素合成和叶绿素降解的指标之一,可以通过植物叶片中叶绿素的提取和测定来得出。
叶绿素荧光参数是评价光能利用效率和光能转化效率的重要指标之一,可以通过叶绿素荧光仪来测定。
土壤养分含量是评价土壤中不同营养元素含量的指标之一,可以通过土壤样品的提取和测定来得出。

令狐采学《植物生理生化》实验指导(适用专业:农学类相关专业)黑龙江八一农垦大学植物科技学院生理生化教研室目录生物化学实验部分:实验一、氨基酸的纸层析 (1)实验二、蛋白质含量测定(设计性实验) (5)实验三、酶的基本性质 (7)实验四、维生素C含量的测定 (12)实验五、还原糖和总糖的测定 (14)实验六、淀粉酶活性的测定 (17)实验七、脂肪浸提——索氏脂肪浸提法 (20)实验八、一种简单实用的提取植物DNA的方法 (22)实验九、聚丙烯酰胺电泳法测定大麦、小麦种子纯度 (24)实验十、淀粉酶的诱导、提取和活性测定(综合性实验) (26)植物生理学实验部分:实验一、植物组织水势的测定(小液流法) (28)实验二、植物伤流量的测定 (30)实验三、根系活力的测定 (31)实验四、蒸腾强度的测定 (35)实验五、叶绿体色素的提取、分离、性质和定量测定(综合性实验) (37)实验六、光合强度的测定(改良半叶法) (39)实验七、呼吸强度的测定 (41)实验八、植物抗逆性的鉴定(电导仪法) (43)实验九、植物缺水程度的测定(脯氨酸法) (45)生物化学实验部分实验一氨基酸的纸层析一、目的:层析分析法已广泛用于氨基酸、核酸、激素、维生素、糖类的分离与分析。
其优点是能够分离与分析在组成、结构及性质上极为相似的物质;设备简单,操作容易,样品用量很少,结果也较明确。
本实验的目的在于要求学生掌握纸层析法的一般原理和操作技术。
二、原理:纸层析法是以滤纸作为支持物的分配层析法。
分配层析法是利用物质在两种不同混合溶剂中的分配系数不同,而达到分离的目的。
通常用α表示分配系数。
在一定条件下,一种物质在某溶剂系统中的分配系数是一个常数。
)溶质在流动相的浓度()溶质在静止相的浓度(l s C C =α 层析溶剂是选用有机溶剂和水组成的。
由于滤纸纤维素对水有较强的亲和力(纸上有很多-OH 基与水以氢键相连),吸附很多水分子,一般达滤纸重的22%左右(其中约有6%的水与纤维素结合成复合物),因此使这一部分水扩散作用降低形成静止相;而有机溶剂与滤纸的亲和力很弱,可以在滤纸的毛细管中自由流动,便形成流动相。


植物生理指标测定方法植物生理指标是指用来衡量植物生理状况的具体参数或指标,在植物生理研究中起到了非常重要的作用。
植物生理指标测定方法主要包括以下几个方面:光合作用指标、呼吸作用指标、蒸腾作用指标、叶绿素指标、产量指标和抗逆性指标等。
1.光合作用指标的测定方法:(1)净光合速率的测定方法:通过光合速率仪测定植物叶片在光照条件下的净光合速率;(2)光饱和点和CO2抗饱和点的测定方法:通过对光合速率与光照强度或CO2浓度的关系进行测定,确定光饱和点和CO2抗饱和点;(3)光合色素含量的测定方法:通过分光光度计或高效液相色谱法测定叶片中的叶绿素a、叶绿素b和类胡萝卜素等光合色素的含量;(4)光合机构有效光能利用率的测定方法:通过光合色素荧光分析仪测定叶片的光能利用效率。
2.呼吸作用指标的测定方法:(1)总呼吸速率的测定方法:通过呼吸速率仪或气体分析仪测定植物组织在不同温度条件下的总呼吸速率;(2)细胞内呼吸速率的测定方法:通过氧和二氧化碳分压差法或氧电极法测定细胞内的呼吸速率。
3.蒸腾作用指标的测定方法:(1)蒸腾速率的测定方法:通过蒸腾速率仪测定植物叶片在不同光照和湿度条件下的蒸腾速率;(2)水分利用效率的测定方法:通过测量蒸腾速率和光合速率的比值来反映植物对水分的利用效率。
4.叶绿素指标的测定方法:(1)叶绿素含量的测定方法:通过叶绿素荧光分析仪或高效液相色谱法测定叶片中叶绿素a、叶绿素b和类胡萝卜素的含量;(2)叶绿素荧光动力学特性的测定方法:通过荧光指数、叶绿素荧光参数和叶绿素荧光成像等技术来评估叶绿素在光抑制和光保护状态下的变化。
5.产量指标的测定方法:(1)单株产量的测定方法:通过对植株生物量、籽粒数或实际产量的测定来计算出单株产量;(2)单穗产量的测定方法:通过对穗长、穗粒数和粒重的测定来计算出单穗产量;(3)单粒产量的测定方法:通过对单穗粒数和粒重的测定来计算出单粒产量。
6.抗逆性指标的测定方法:(1)抗氧化酶活性的测定方法:通过测定植物组织中抗氧化酶活性,如超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶等的活性来反映植物的抗氧化能力;(2)渗透调节物质含量的测定方法:通过测定植物组织中渗透调节物质(如脯氨酸、脯氨酸激酶等)的含量来评估植物的胁迫适应能力;(3)膜脂过氧化程度的测定方法:通过测定植物组织中膜脂过氧化程度的指标,如丙二醛和过氧化氢含量来评估植物膜的稳定性。


植物生理生化指标的测定方法与意义解读植物生理生化指标的测定方法与意义解读对于研究植物生长、适应环境以及疾病防治等领域至关重要。
本文将介绍几种常用的植物生理生化指标的测定方法,并解读其意义。
一、叶绿素含量的测定方法与意义解读叶绿素是植物光合作用的关键物质,反映了植物的光合能力和光合效率。
常用的测定叶绿素含量的方法有多种,如色素提取法、光度法和荧光法等。
其中,色素提取法是最常用的方法之一。
该方法通过乙醇提取叶片中的叶绿素,然后用紫外-可见光谱仪分析提取液的吸光度,从而计算出叶绿素含量。
叶绿素含量的测定对植物的研究具有重要意义。
首先,叶绿素含量可以直接反映植物的光合能力和光合效率。
一般来说,叶绿素含量越高,植物的光合作用效率越高,并且可以更好地利用阳光进行光合作用。
其次,叶绿素含量也可以作为植物受到生态环境和生理状态变化的指示器。
例如,在氮素缺乏的条件下,植物体内的叶绿素含量会下降,表明植物养分供应不足。
因此,测定叶绿素含量有助于了解植物在不同环境和条件下的光合适应能力和生长状态。
二、抗氧化酶活性的测定方法与意义解读抗氧化酶是植物体内起重要保护作用的一类酶,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)等。
这些酶能够清除植物体内产生的有害氧自由基,保护细胞免受氧化损伤。
常用的抗氧化酶活性测定方法有多种,如显色法、发光法和酶活测定法等。
抗氧化酶活性的测定在研究植物的环境适应能力和应对氧化胁迫方面具有重要意义。
首先,抗氧化酶活性可以反映植物受到氧化胁迫的程度。
当植物受到氧化胁迫时,抗氧化酶活性会显著增加,以应对有害氧自由基的累积。
其次,抗氧化酶活性还可以用来评估植物的环境适应能力。
例如,在干旱或高温等胁迫条件下,植物体内的抗氧化酶活性通常会增加,以维持细胞内的氧化-还原平衡。
三、渗透调节物质含量的测定方法与意义解读渗透调节物质是植物在干旱、盐碱等逆境环境下维持细胞渗透平衡和稳态的重要物质。
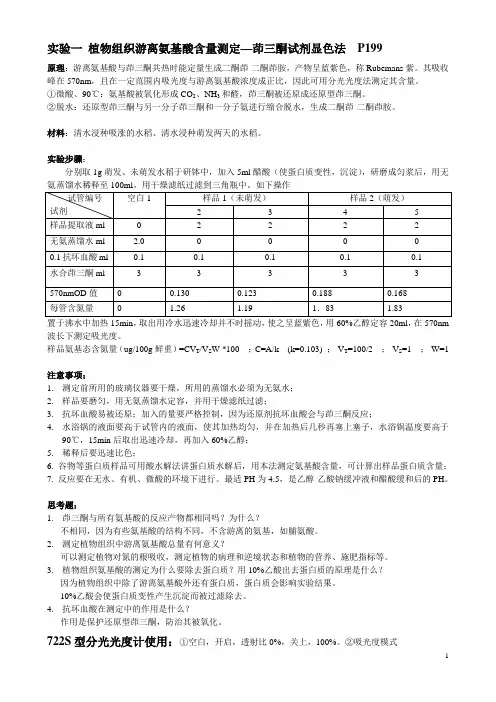
实验一植物组织游离氨基酸含量测定—茚三酮试剂显色法P199原理:游离氨基酸与茚三酮共热时能定量生成二酮茚-二酮茚胺,产物呈蓝紫色,称Rubemans紫。
其吸收峰在570nm,且在一定范围内吸光度与游离氨基酸浓度成正比,因此可用分光光度法测定其含量。
①微酸、90℃:氨基酸被氧化形成CO2、NH3和醛,茚三酮被还原成还原型茚三酮。
②脱水:还原型茚三酮与另一分子茚三酮和一分子氨进行缩合脱水,生成二酮茚-二酮茚胺。
材料:清水浸种吸涨的水稻、清水浸种萌发两天的水稻。
实验步骤:分别取1g萌发、未萌发水稻于研钵中,加入5ml醋酸(使蛋白质变性,沉淀),研磨成匀浆后,用无置于沸水中加热15min,取出用冷水迅速冷却并不时摇动,使之呈蓝紫色,用60%乙醇定容20ml,在570nm 波长下测定吸光度。
样品氨基态含氮量(ug/100g鲜重)=CV T/V S W *100 ;C=A/k (k=0.103) ;V T=100/2 ;V S=1 ;W=1注意事项:1.测定前所用的玻璃仪器要干燥,所用的蒸馏水必须为无氨水;2.样品要磨匀,用无氨蒸馏水定容,并用干燥滤纸过滤;3.抗坏血酸易被还原;加入的量要严格控制,因为还原剂抗坏血酸会与茚三酮反应;4.水浴锅的液面要高于试管内的液面,使其加热均匀,并在加热后几秒再塞上塞子,水浴锅温度要高于90℃,15min后取出迅速冷却,再加入60%乙醇;5.稀释后要迅速比色;6. 谷物等蛋白质样品可用酸水解法讲蛋白质水解后,用本法测定氨基酸含量,可计算出样品蛋白质含量;7. 反应要在无水、有机、微酸的环境下进行。
最适PH为4.5,是乙醇-乙酸钠缓冲液和醋酸缓和后的PH。
思考题:1.茚三酮与所有氨基酸的反应产物都相同吗?为什么?不相同,因为有些氨基酸的结构不同,不含游离的氨基,如脯氨酸。
2.测定植物组织中游离氨基酸总量有何意义?可以测定植物对氮的根吸收,测定植物的病理和逆境状态和植物的营养、施肥指标等。


植物生理生化指标的监测与评价研究植物的生理生化指标是评估其健康状况和适应性的重要依据。
通过监测和评价这些指标,我们可以了解植物对环境的响应和适应能力,为植物生理学和生态学研究提供有力支持。
本文将综述植物生理生化指标的常用监测技术和评价方法。
一、光合作用相关指标光合作用是植物进行养分合成的关键过程。
通过测量光合作用相关指标,我们可以获得植物的光合效率和养分利用效率等信息。
常用的光合作用相关指标包括净光合速率(Pn)、蒸腾速率(Tr)和光合有效辐射利用率等。
监测这些指标可使用便携式测光仪、气孔仪等设备,评价方法可采用比较分析或建立模型进行预测。
二、叶绿素荧光指标叶绿素荧光是植物光合过程中释放的能量。
通过监测叶绿素荧光指标,我们可以了解植物的光合效率和受逆境胁迫的程度。
常用的叶绿素荧光指标包括最大光化学效率(Fv/Fm)、有效光量子产量(ΦPSII)和非光化学淬灭(NPQ)等。
测量叶绿素荧光指标可使用便携式叶绿素荧光仪,评价方法可采用比较分析或构建响应模型。
三、抗氧化酶活性指标抗氧化酶是植物抵抗氧化胁迫的关键因子。
通过监测抗氧化酶活性指标,我们可以了解植物对氧化应激的防御能力。
常用的抗氧化酶活性指标包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)等。
测量抗氧化酶活性可使用酶活测定试剂盒,评价方法可采用比较分析或建立反应模型。
四、生长代谢指标生长代谢是植物生长发育的基础过程。
通过监测生长代谢指标,我们可以了解植物的营养吸收和有效利用能力。
常用的生长代谢指标包括根系活力、可溶性糖含量和叶片叶绿素含量等。
监测生长代谢指标可使用土壤养分测定仪、高效液相色谱仪等设备,评价方法可采用比较分析或构建模型。
五、生理生化指标的评价方法评价植物生理生化指标常采用比较分析和数理统计方法。
比较分析可通过对不同栽培条件下植物指标的差异进行比较,进而判断其对环境的响应和适应能力。
数理统计方法可通过建立回归模型或分类模型,对监测数据进行拟合和预测,提高评价的准确性。
氮蓝四唑(NBT)法测定超氧物歧化酶(SOD)活力一、原理超氧物歧化酶(superoxidedismutase,SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。
本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生O2,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。
而SOD可清除O2,从而抑制了甲腙的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
二、材料、仪器设备及试剂(一)材料;水稻或小麦叶片(二)仪器设备:1.高速台式离心机;2.分光光度计;3.微量进样器;4.荧光灯(反应试管处照度为4000Lx);5.试管或指形管数支。
(三)试剂 1. 0.05mol/L 磷酸缓冲液(pH7.8);2. 130mmol/L 甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml;3.750μmol/L 氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存;4. 100μmol/L EDT-Na2溶液:称取0.03721gEDTA-Na2用磷酸缓冲液定容至1000ml;5. 20μmol/L 核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml避光保存。
三、实验步骤1. 酶液提取取一定部位的植物叶片(视需要定,去叶脉)0.5g于预冷的研钵中,1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5ml。
取1.5~2ml于1000rpm下离心20min,上清液即为SOD粗提液。
2. 显色反应取5ml指形管(要求透明度好)4支,2支为测定管,另2支为对照管,按下列加入各溶液:试剂(酶)用量(ml)终浓度(比色时)0.05mol/L 磷酸缓冲液1.5130mmol/L Met溶液0.313mmol/L 750μmol/LNBT溶液0.375μmol/L 100μmol/L EDTA-Na2液0.310μmol/L 20μmol/L 核黄素0.320μmol/L 酶液0.05。
李合生. 植物生理生化实验原理和技术李合生(1921~2012),中国植物生理生化学家,被誉为我国植物生理学的奠基人之一。
他的研究成果及其对中国植物生理学发展的贡献不仅在学术界享有盛誉,而且对农业生产的实际应用产生了重大影响。
李合生对植物生理生化实验的原理和技术进行了大量的研究和实践,为植物生理学研究方法的创新和发展作出了重要贡献。
以下是关于李合生. 植物生理生化实验原理和技术的一些介绍。
一、植物生理生化实验原理1. 实验的目的和问题:在进行植物生理生化实验时,首先需要明确实验的目的和解决的问题。
研究植物光合作用的效率提高的方法,研究植物对环境胁迫的响应机制等。
2. 实验的设计和控制:植物生理生化实验需要精确的实验设计和严格的实验控制,以确保实验结果的可靠性和准确性。
实验因素的选取和处理、实验材料的选择和处理、实验条件的控制等。
3. 实验的方案和方法:根据实验的目的和问题,确定合适的实验方案和方法。
测定植物光合作用的速率可以选择光合速率仪、测定植物叶片的光谱特性可以使用光谱仪等。
二、植物生理生化实验技术1. 光合作用的测定:光合作用是植物生命活动的基础,测定植物的光合作用对于研究植物生理生化过程至关重要。
李合生在光合作用的测定方面进行了大量的研究,并开发了一系列的测定技术和仪器。
2. 植物代谢产物的测定:植物代谢产物的测定可以揭示植物的生物化学过程和物质代谢机制。
李合生研究了植物合成蛋白质的方法和代谢产物,提出了一系列的测定技术和方法。
3. 植物生长调控的实验技术:植物生长调控是植物生理生化过程的核心之一,实验技术的发展为植物生长调控的研究提供了有力的支持。
李合生在植物生长调控的实验技术方面做出了重要的贡献。
三、植物生理生化实验的应用李合生的植物生理生化实验原理和技术的应用不仅限于学术研究领域,还广泛应用于农业生产、食品工业等实际生产领域。
1. 农业生产:通过植物生理生化实验原理和技术,可以揭示植物在不同环境条件下的生长规律和适应机制,为农业生产中的种植技术、育种方法等提供科学依据。
植物生理生化实验原理和技术植物生理生化实验旨在研究植物生命过程中的生理和生化相关現象,改进对植物的了解及应用。
以下是实验原理和常用技术。
1. 光合作用测定:光合作用是植物生理的重要过程之一,可使用光合速率仪测量光合速率。
原理是通过测量植物叶片释放或吸收的氧气量,来间接测定光合速率。
2. 蒸腾作用测定:蒸腾作用是植物水分代谢的关键环节。
可利用蒸腾速率仪测量植物叶片释放的水蒸气量,从而确定植物的蒸腾速率。
3. 细胞呼吸测定:细胞呼吸是植物细胞产能的主要途径,可以通过测量释放的二氧化碳量来测定细胞呼吸速率。
常用的测定方法有测量呼吸速率的气体分析仪或密闭系统测定二氧化碳的累积。
4. 酶活性测定:酶是植物生物化学过程中的重要催化剂。
酶活性的测定可以通过测量糖类、蛋白质、核酸等底物的代谢速率,或通过测量底物与产物之间的光学、电化学变化来实现。
常用的方法有光谱法、酶促反应连续监测法等。
5. 色素提取:植物体内的色素对光合作用和其他生化过程至关重要。
常用的色素提取方法包括酒精提取、乙醚提取等。
提取后的色素溶液可以通过紫外-可见光谱仪进行定量测定。
6. 蛋白质测定:蛋白质是植物细胞内的重要有机物。
常用的蛋白质测定方法包括巴雷特试剂法、劳氏试剂法、比色试剂法等。
通过测定样品和标准溶液的吸收值,可以计算出蛋白质的含量。
7. 酶动力学测定:酶动力学是研究酶催化作用速度的科学。
可以通过测定底物浓度、酶浓度、反应时间等因素对酶活性的影响来研究酶的催化机理。
常用的测定方法有Michalis-Menten曲线法、双倒数法等。
8. 膜透性测定:膜透性是指物质穿过细胞膜的能力。
可以通过测定溶液中离子浓度的变化,来评估膜透性的改变。
常用的测定方法有电导率法、吸光度法等。
9. RNA/DNA提取和定量:RNA/DNA是植物遗传信息的主要表达形式。
可以使用相关试剂盒从植物样品中提取RNA/DNA,然后通过紫外-可见光谱仪或荧光定量仪测定其浓度。
植物生理生化实验原理与技术植物生理生化实验是研究植物生命周期、生长发育、代谢物质合成与分解等生理生化过程的重要手段。
通过实验可以揭示植物对外界环境的适应性和调节机制,探究植物体内的生化反应和代谢途径,为植物科学研究提供实证依据。
本文将从植物生理和生化两个方面介绍相关实验原理与技术。
一、植物生理实验原理与技术1. 光合作用实验光合作用是植物体内最重要的代谢过程之一,通过光合作用,植物能够将光能转化为化学能,合成有机物质,并释放出氧气。
光合作用实验可以通过测定氧气释放量、二氧化碳吸收量、光合速率等指标来评估植物的光合能力。
实验中常用的技术包括测气法、光合速率仪等。
2. 呼吸作用实验呼吸作用是植物体内的一种氧化代谢过程,通过呼吸作用,植物能够将有机物质分解为二氧化碳和水,并释放出能量。
呼吸作用实验可以通过测定二氧化碳释放量、氧气消耗量等指标来评估植物的呼吸能力。
实验中常用的技术包括测气法、呼吸速率仪等。
3. 水分逆境实验水分是植物生长发育的重要因素之一,水分逆境实验可以模拟干旱或水浸等环境条件,研究植物对水分胁迫的响应机制。
常用的实验方法包括干旱处理、水浸处理、土壤水分测定等。
4. 盐胁迫实验盐胁迫是植物生长发育中常见的逆境因素之一,盐胁迫实验可以研究植物对盐胁迫的耐受性和适应性。
常用的实验方法包括盐溶液处理、盐浓度测定、生长指标测定等。
二、植物生化实验原理与技术1. 酶活性测定实验酶是植物体内生化反应的催化剂,酶活性测定实验可以评估酶的活力和功能。
常用的实验方法包括酶活性测定试剂盒法、酶底物转化法等。
2. 叶绿素含量测定实验叶绿素是植物体内的一种重要色素,可以吸收光能进行光合作用。
叶绿素含量测定实验可以评估植物的叶绿素合成和光合能力。
常用的实验方法包括乙醇提取法、叶绿素荧光法等。
3. 蛋白质含量测定实验蛋白质是植物体内的重要代谢产物,蛋白质含量测定实验可以评估植物的蛋白质合成和分解能力。
常用的实验方法包括布鲁氏试剂法、Lowry法等。
2.1.8转基因植株在盐胁迫下的超氧化物歧化酶(SOD)活性测定将转基因植株与非转基因对照植株继代于含有0.5% NaCl的MS固体培养上进行胁迫培养,培养条件为27±1℃,每天13 h、3000 lux光照。
胁迫培养4 w后,取其叶片测定其SOD 活性,每个样品设3次重复,求其平均数,并进行多重比较。
2.1.8.1主要试剂及配方(1)0.1 mol/l pH 7.8磷酸钠(Na2HPO4-NaH2PO4)缓冲液A液(0.1 mol/l Na2HPO4溶液):称取Na2HPO4·12H2O 7.163 g,用少量蒸馏水溶解后定容至200 ml,4℃冰箱中保存备用;B液(0.1 mol/l NaH2PO4溶液):称取NaH2PO4·2H2O 0.780 g,用少量蒸馏水溶解后定容至50 ml,4℃冰箱中保存备用;取上述A液183 ml与B液17ml充分混匀后即为0.1 mol/l pH 7.8的磷酸钠缓冲液,4℃冰箱中保存备用。
(2)0.026 mol/l甲硫氨酸(Met)磷酸钠缓冲液称取甲硫氨酸(C5H11NO2S)0.388 g,用少量0.1 mol/l pH 7.8的磷酸钠缓冲液溶解后,再用相同磷酸钠缓冲液定容至100 ml,现用现配,4℃冰箱中保存可用1~2 d。
(3)7.5 × 10-4 mol/l NBT溶液称取NBT(C40H30Cl2N10O6)0.153 g,用少量蒸馏水溶解后,定容至250 ml,现用现配,4℃冰箱中保存可用2~3 d。
(4)含1.0 μmol/l EDTA的20 μmol/l核黄素溶液A液:称取EDTA 0.003 g,用少量蒸馏水溶解;B液:称取核黄素0.075 g,用少量蒸馏水溶解;C液:合并A液和B液,定容至100 ml,此溶液即为含0.1 mmol/l EDTA的2 mmol/l 核黄素溶液,避光保存(可用黑纸将装有该液的棕色瓶包好),4℃冰箱中可保存8~10 d,当测定SOD酶活时,将C液稀释100倍,即为含1.0 μmol/l EDTA的20 μmol/l核黄素溶液。
小黑豆相关生理指标测定1. 表型变化:鲜重、株高、主根长和叶面积鲜重 :取处理好的植株,擦干根和叶表面水分,测量整株植物的重量,每个测 6个重复。
株高 :取处理好的植株,测量从根和茎分隔处到植株最高点的高度,记录,每个测6个重复。
主根长 :取处理好的植株,测量从根和茎分隔处到主根最远点长度,记录,每个测6个重复。
叶面积 :取处理好的植株,选择第二节段的叶片,测量叶面积,叶面积测量方法是测每个叶片最宽处长度作为叶的长, 测叶片最窄处长度作为叶的宽, 叶片长和宽的乘积即为叶表面积。
每个测 6个重复。
2. 总蛋白、可溶性糖、丙二醛(MDA 和 H2O2含量测定样品处理:取 0.5g 样品(叶片要去除叶脉、根要先用清水清洗干净 ,速在液氮中冻存,在遇冷的研钵中加液氮研磨,然后加入 1.5ml 的 Tris-HCl (pH7.4 抽提, 将抽提液转移到 2ml 的 EP 管中, 于 4℃, 12000rpm 离心 15min , 取上清, 保存在 -20℃下,上清液可用于总蛋白、丙二醛(MDA 、可溶性糖和 H2O2含量测定。
总蛋白测定(Bradford 法 :样品反应体系(800ul H2O+200ul Bradford+5ul样品 , 空白对照为(800ul H2O+200ul Bradford 。
测定后带入标准曲线 Y=32.549X-0.224(Y代表蛋白含量, X 代表 OD595 ,计算得出蛋白含量。
可溶性糖测定:样品反应体系(1ml 蒽酮 +180ul ddH2O+20ul样品提取液 ; 空白对照 (1ml 蒽酮 +180ul ddH2O , 测定 OD625后带入标准曲线 :Y=0.0345X+0.0204(Y代表 OD625, X 代表可溶性糖含量(ug蒽酮配方:称取 100mg 蒽酮溶于 100ml 稀硫酸(76ml 浓硫酸 +30mlH2O . 注意:浓硫酸加入水中时,一点一点递加,小心溅出受伤。
2.1.8转基因植株在盐胁迫下的超氧化物歧化酶(SOD)活性测定
将转基因植株与非转基因对照植株继代于含有0.5% NaCl的MS固体培养上进行胁迫培养,培养条件为27±1℃,每天13 h、3000 lux光照。
胁迫培养4 w后,取其叶片测定其SOD 活性,每个样品设3次重复,求其平均数,并进行多重比较。
2.1.8.1主要试剂及配方
(1)0.1 mol/l pH 7.8磷酸钠(Na2HPO4-NaH2PO4)缓冲液
A液(0.1 mol/l Na2HPO4溶液):称取Na2HPO4·12H2O 7.163 g,用少量蒸馏水溶解后定容至200 ml,4℃冰箱中保存备用;
B液(0.1 mol/l NaH2PO4溶液):称取NaH2PO4·2H2O 0.780 g,用少量蒸馏水溶解后定容至50 ml,4℃冰箱中保存备用;
取上述A液183 ml与B液17ml充分混匀后即为0.1 mol/l pH 7.8的磷酸钠缓冲液,4℃冰箱中保存备用。
(2)0.026 mol/l甲硫氨酸(Met)磷酸钠缓冲液
称取甲硫氨酸(C5H11NO2S)0.388 g,用少量0.1 mol/l pH 7.8的磷酸钠缓冲液溶解后,再用相同磷酸钠缓冲液定容至100 ml,现用现配,4℃冰箱中保存可用1~2 d。
(3)7.5 × 10-4 mol/l NBT溶液
称取NBT(C40H30Cl2N10O6)0.153 g,用少量蒸馏水溶解后,定容至250 ml,现用现配,4℃冰箱中保存可用2~3 d。
(4)含1.0 μmol/l EDTA的20 μmol/l核黄素溶液
A液:称取EDTA 0.003 g,用少量蒸馏水溶解;
B液:称取核黄素0.075 g,用少量蒸馏水溶解;
C液:合并A液和B液,定容至100 ml,此溶液即为含0.1 mmol/l EDTA的2 mmol/l 核黄素溶液,避光保存(可用黑纸将装有该液的棕色瓶包好),4℃冰箱中可保存8~10 d,当测定SOD酶活时,将C液稀释100倍,即为含1.0 μmol/l EDTA的20 μmol/l核黄素溶液。
(5)含2% PVP的0.05 mol/l pH7.8磷酸钠缓冲液
取0.1 mol/l pH7.8的磷酸钠缓冲液50 ml,加入2 g PVP(聚乙烯吡咯烷酮),充分溶解后移入100 ml容量瓶中用蒸馏水定容至刻度,充分混匀,4℃冰箱中保存备用。
2.1.8.2提取及测定方法
(1)称取1.0 g样品叶片于预冷的研钵中,加入4 ml预冷的提取介质(含2% PVP的0.05 mol/l pH7.8磷酸钠缓冲液),冰浴研磨匀浆,转入10 ml离心管,并用提取介质定容至
5 ml;
(2)4℃10000 rpm离心10 min,取上清即为酶液提取样品;
(3)取透明度好的10 ml离心管,每个株系3次重复,按照下表加入试剂:
试剂用量(ml)
0.05 mol/l磷酸缓冲液(2% PVP)0.875
0.026 mol/l Met缓冲液 1.5
750 μmol/l NBT 0.3
1 μmol/l EDTA及20 μmol/l核黄素0.3
酶提取液(对照管以磷酸缓冲液代替)0.025
总体积 3.0
(4)设3个对照(CK1、CK2、CK3),将CK1包上铝箔避光,与其它样品管(包括CK2和CK3)同时置于4500 lux日光灯下反应25 min,反应温度28℃;
(5)SOD活性测定与计算:至反应结束,立即用黑布遮蔽以终止反应。
以遮光的对照管CK1作为空白调零,在560nm波长下测定各管的吸光度,CK2和CK3的平均值作为对照,按下例公式计算SOD活性(SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位):SOD活性(U/g)=(OD0 -OD560)×V T/(OD0×0.5×FW×V1)
OD 0——光照对照管的光吸收值;
OD 560——样品管的光吸收值;
V T——样液总体积(ml);
V1——测定时样品用量(ml);
FW——样品鲜重(g)。
2.1.9转基因植株在盐胁迫下的丙二醛(MDA)含量测定
将转基因植株与对照植株继代于含有0.5%NaCl的MS固体培养上进行胁迫培养,培养条件为27±1℃,每天13 h、3000 lux光照。
胁迫培养4 w后,取整株测定其丙二醛含量,每个样品设3次重复,求其平均数,并进行多重比较。
2.1.9.1主要试剂及配方
(1)5%三氯乙酸(TCA):称取5 g三氯乙酸,先用少量蒸馏水溶解,再定容至100ml;
(2)0.5%硫代巴比妥酸(TBA):称取0.5 g硫代巴比妥酸,用5%TCA定容至100 ml。
2.1.9.2提取及测定方法
(1)称取1.0 g材料,加入10 ml 5%三氯乙酸(TCA)和少量石英砂,研磨至匀浆;
(2)3000 rpm离心10 min,取上清即为丙二醛提取液;
(3)取1.5 ml上述提取液(对照管取1.5 ml 5% TCA),加入2.5 ml 0.5% TBA,混匀后于沸水浴中反应15 min,迅速冷却;
(4)1800 g离心10 min;
(5)取上清液测定532和600 nm波长处的吸光度,以蒸馏水调零;
(6)含量计算:
丙二醛含量(nmol/g)=(OD532-OD600)×A×V /(0.155×FW×a)
OD532——样品管在532 nm处的光吸收值;
OD600——样品管在600 nm处的光吸收值;
A——反应液总体积(ml);
V——提取液总体积(ml);
FW——样品鲜重(g);
a——测定用液总体积(ml)。
2.1.10转基因植株在盐胁迫下的脯氨酸含量测定
将转基因植株与对照植株继代于含有0.5%NaCl的MS固体培养上进行胁迫培养,培养条件为27±1℃,每天13 h、3000 lux光照。
胁迫培养4 w后,取其叶片测定其脯氨酸含量,每个样品设3次重复,求其平均数,并进行多重比较。
2.1.10.1主要试剂及配方
(1)6 mol/l 磷酸:量取102.5 ml 85%的磷酸,定容至250 ml;
(2)2.5% 酸性茚三酮:称取2.5 g茚三酮,加入60 ml冰醋酸和40 ml 6 mol/l磷酸,于70℃下加热溶解,冷却后贮存于棕色瓶中尽快使用,4℃可保存3 d。
2.1.10.2提取及测定方法
实验分为脯氨酸标准曲线的制作和植物样品的提取及测定两个部分,具体步骤如下:脯氨酸标准曲线的制作:
(1)称取10 mg脯氨酸溶于少量无水乙醇中,用蒸馏水定容至100 ml,配成100 μg/ml 的母液;
(2)取上述母液0,1.25,2.5,5.0,7.5,10,12.5,15 ml分别放入8个25 ml的容量瓶中,再分别加入蒸馏水定容至25 ml,配制成0,2.5,5.0,10,15,20,25,30 μg/ml 系列浓度的溶液;
(3)分别取上述溶液2 ml,加入2 ml冰醋酸,2 ml酸性茚三酮(注意不要接触皮肤),
摇匀,沸水浴显色15 min,冷却后于520 nm处测OD值;
(4)以OD值为横坐标,脯氨酸含量为纵坐标,绘制标准曲线。
植物样品中脯氨酸的提取及测定:
(1)称取胁迫处理过的植株叶片1.0 g,剪碎,加入5 ml 80% 乙醇于研钵中研磨成匀浆;
(2)将匀浆液体全部转移至25 ml刻度的试管中,加水补足25 ml,混匀,80℃水浴提取20 min;
(3)加入0.5 g人造沸石,0.2 g活性炭,于振荡器上振荡1 min混匀,过滤;
(4)取2.5 ml滤液,按制作标准曲线的方法测定各个样品的OD值;
(5)从制作得到的标准曲线上检出被测样品中脯氨酸的含量,最后换算得到游离脯
氨酸的平均含量:
脯氨酸含量(μg/g)=(C×V/a)/FW
C——曲线查C值(μg);
V——提取液总体积(ml);
a——测定液体积(ml);
FW——样品质量(g)。
2.1.11转基因植株在盐胁迫下的叶绿素含量测定
将转基因植株与对照植株继代于含有0.5%NaCl的MS固体培养上进行胁迫培养,培养条件为27±1℃,每天13 h、3000 lux光照。
胁迫培养4 w后,取其叶片测定其叶绿素含量,每个样品设3次重复,求其平均数,并进行多重比较。
2.1.11.1主要试剂及配方
80% 丙酮:量取80ml丙酮,定容至100 ml。
2.1.11.2提取及测定方法
(1)称取胁迫处理过的植株叶片0.2 g,剪碎至研钵中,加入 5 ml 80% 的丙酮,研成匀浆;
(2) 用一层加丙酮润过的滤纸过滤,再用少量丙酮将滤纸和研钵上的色素冲洗干净,定容至10 ml,摇匀;
(3) 吸取2 ml 含有叶绿素的丙酮提取液,加80% 的丙酮2 ml 稀释后,倒入比色杯中,用分光光度计分别在645 nm、663 nm、652 nm下测吸光度,以80% 丙酮为空白对照。
用下列公式计算:
Ca(mg/l)=12.7OD663-2.69 OD 645
Cb(mg/l)=22.9 OD 645-4.68 OD 663
Ct1(mg/l)= 8.02 OD 663+20.21 OD 645
用下式计算叶绿素在叶片中的含量:
Ct(叶绿素mg/g 鲜重)= Ct1×提取液总量×稀释倍数×10-3/样品(g)。