引物设计OLIGO图解
- 格式:docx
- 大小:23.44 KB
- 文档页数:6
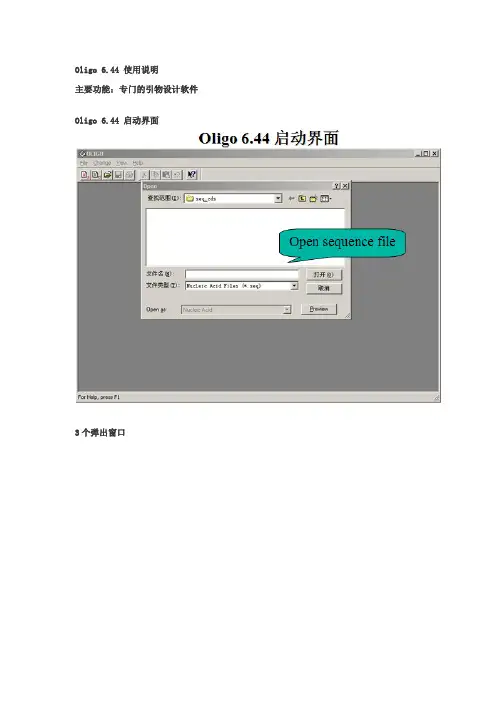
Oligo 6.44 使用说明
主要功能:专门的引物设计软件Oligo 6.44 启动界面
3个弹出窗口
用Oligo 设计引物时的3个标准
Tm 值曲线以选取5’到3’的下降形状有利于引物引发聚合反应。
Frq 曲线宜选用3’端Frq 值相对较低的片段。
ΔG 值在5’端和中间值比较高,而在3’端相对低
选中引物
引物分析
首先检查引物二聚体尤其是3’端二聚体形成的可能性。
二项检查是发夹结构(hairpin);与二聚体相同,发夹结构的能值越低越好。
第三项检查为GC 含量,以45-55%为宜。
Search for primer using Oligo 6.44
随机引物
适用于长的或具有发卡结构的RNA。
适用于rRNA、mRNA、tRNA 等所有RNA的反转录反应。
主要用于单一模板的RT-PCR反应。
Oligo dT
适用于具有PolyA尾巴的RNA。
(原核生物的RNA、真核生物的 Oligo dT rRNA和tRNA不具有PolyA尾巴。
)由于Oligo dT要结合到PolyA 尾巴上,所以对RNA样品的质量要求较高,即使有少量降解也会使全长cDNA合成量大大减少。
PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异
性扩增带与非特异性扩增带。
4. 操作多份样品时,制备反应混合液,先将dNTP、缓冲液、引物和酶混合好,然后分装,这样即可以减少操作,避免污染,又可以增加反应的精确度;
5. 最后加入反应模板,加入后盖紧反应管。

Oligo使用方法介绍作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能:如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word 文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一, 普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。

引物设计软件Oligo使用方法介绍荧光定量PCR仪|荧光定量PCR基因扩增仪作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能,如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1、直接用键盘输入:a、点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b、此时即可键入DNA序列;c、如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2、利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word文件。
html 格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3、如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA 时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5‘端稳定性是否稍高于3’端等。
一、普通引物对的搜索:以Mouse 4E(cDNA序列)为例。

在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence 命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open 的文件格式,如word文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口,以及序列内部碱基稳定性窗口.其中的退火温度窗是我们引物设计的主窗,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一,普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。
1,点击“Search“菜单中的”For Primers and Probes“命令,进入引物搜索对话框;2,由于我们要设计的是一对PCR引物,因此正、负链的复选框都要选上,同时选上Compatible pairs.在Oligo默认的状态下,对此引物对的要求有:a,无二聚体;b,3’端高度特异,GC 含量有限定,d,去除错误引发引物等。
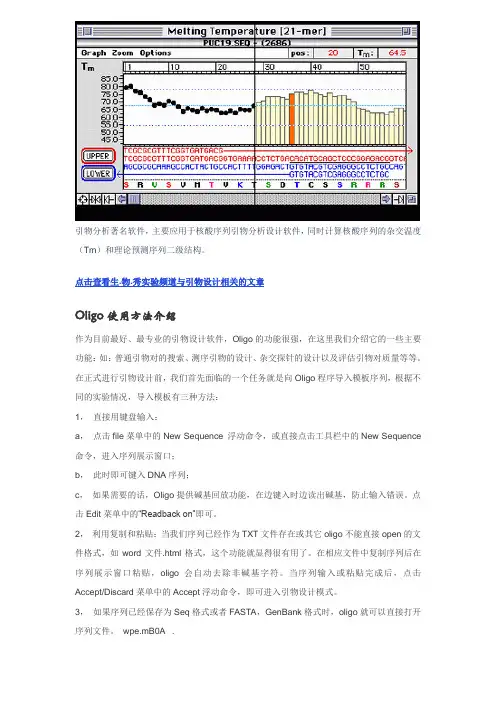
引物分析著名软件,主要应用于核酸序列引物分析设计软件,同时计算核酸序列的杂交温度(Tm)和理论预测序列二级结构。
点击查看生.物.秀实验频道与引物设计相关的文章Oligo使用方法介绍作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能:如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence 命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
wpe.mB0A .点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。


primer5和Oligo的引物设计、使用方法吴乃虎的《基因工程原理》一、引物设计step by step1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的origin中,Copy该编码序列作为软件查询序列的候选对象。
2、用Primer Premier5搜索引物①打开Primer Premier5,点击File-New-DNA sequence, 出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。
点击Primer,进入引物窗口。
②此窗口可以链接到“引物搜索”、“引物编辑”以及“搜索结果”选项,点击Search按钮,进入引物搜索框,选择“PCR primers”,“Pairs”,设定搜索区域和引物长度和产物长度。
在Search Parameters里面,可以设定相应参数。
一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200bp的产物电泳跑得较散,所以可以选择300~500bp.③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。
④对于引物的序列,可以简单查看一下,避免出现下列情况:3’不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配。
此窗口中需要着重查看的包括:T m应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的T m值最好不要相差太多,大概在2度以下较好。
该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置。
若按钮显示为红色,表示存在该二级结构,点击该红色按钮,即可看到相应二级结构位置图示。
最理想的引物,应该都不存在这些二级结构,即这几个按钮都显示为“None”为好。

引物设计软件Oligo使用方法介绍荧光定量PCR仪|荧光定量PCR基因扩增仪作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能,如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1、直接用键盘输入:a、点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b、此时即可键入DNA序列;c、如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2、利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word文件。
html 格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3、如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA 时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5‘端稳定性是否稍高于3’端等。
一、普通引物对的搜索:以Mouse 4E(cDNA序列)为例。

使用Oligo设计QPCR引物—以果蝇LaminC序列为例普通PCR的基础上,加上荧光信号,在扩增目的片段的过程中通过荧光信号的富集来得到Ct值,从而确定基因转录表达含量。
[1]引物设计原则[1]考虑引物与DNA片段结合的特异性、强度以及是否会产生引物二聚体等因素,因此有如下原则:◆引物长度大于16bp,18~24个核苷酸;◆引物与靶序列间的Tm值不应该过低。
两条引物之间尽量接近,差值不超过4℃;◆引物不应该有发夹结构,不能有4bp以上回文序列;◆两引物间不应有大于4bp以上的互补序列或同源序列,在3’端不应有任何互补碱基;◆碱基尽可能均匀分布,GC含量在40~60%;◆引物尽量不形成二级结构。
◆但是qPCR与其他PCR的扩增目的稍微有所不同,qPCR需要通过快速扩增实现对转录本的定量。
因此一般要求扩增的片段比较短,一般在200bp以下,考虑是否会引物特异性高低问题出现杂峰等。
扩增长度,建议在100~300bp 间比较好扩增;引物长度在20~25bp 较好,而且上下游引物间不要相差超过5bp;再就是看看Tm 值,60℃左右,相差不要超过1℃。
●引物长度一般为15-27 bp,最适为18-22 bp(注意此处所指的长度是结合到模板的长度,不包括5'端加修饰后的长度),过长会导致延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。
上下游引物长度差不超过4 bp,Tm差不超过2℃。
●引物序列在模板其他位置应当没有相似性较高的序列,尤其是3'端,否则容易导致错配。
引物3'端避免出现3个以上的连续碱基如GGG或CCC。
●引物3'端的末位碱基对Taq酶合成效率有较大影响,末位碱基为A的错配率明显高于其他碱基,应当避免在引物的3'端使用碱基A。
另外,引物二聚体或发夹结构也可能导致PCR反应失败。
5'端序列对PCR 影响不太大,因此常用来引进修饰位点或标记物。


作为目前最好、最专业得引物设计软件,Oligo得功能很强,在这里我们介绍它得一些主要功能:如:普通引物对得搜索、测序引物得设计、杂交探针得设计以及评估引物对质量等等。
ﻫﻫ在正式进行引物设计前,我们首先面临得一个任务就就是向Oligo程序导入模板序列,根据不同得实验情况,导入模板有三种方法:1,直接用键盘输入:a, 点击file菜单中得New Sequence 浮动命令,或直接点击工具栏中得New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;ﻫc, 如果需要得话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中得“Readbackon”即可。
ﻫ2, 利用复制与粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open得文件格式,如word文件、html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符.当序列输入或粘贴完成后,点击Accept/Discard菜单中得Accept浮动命令,即可进入引物设计模式。
3ﻫ,如果序列已经保存为Se q格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件.点击File菜单中得“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别就是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中得退火温度窗口就是我们引物设计得主窗口,其它得两个窗口则在设计过程中起辅助作用,比如6—碱基频率窗口可以使我们很直观地瞧到所设计引物在相应物种基因组中得出现频率,如果我们得模板就是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物得5'端稳定性就是否稍高于3’端等。
ﻫ一,普通引物对得搜索:ﻫ以Mouse4E(cDNA序列)为例。
我们得目得就是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长得pcr产物.1,点击“Search“菜单中得"ForPrimersand Probes“命令,进入引物搜索对话框;2ﻫ,由于我们要设计得就是一对PCR引物,因此正、负链得复选框都要选上,同时选上patible pairs.在Oligo默认得状态下,对此引物对得要求有:a,无二聚体;b,3’端高度特异,GC含量有限定,d,去除错误引发引物等。
手把手教你设计引物(图文并茂)不知不觉几年下来自己也快毕业了,感谢丁香园这些年来的帮助。
没有什么可回报的东西,就发个帖教教新人如何设计引物吧,尽量做到手把手的教,图文并茂。
引物设计的帖子不少,以前很多战友会推荐Oligo、PrimerPremier、DNA man等等软件。
这些软件设计完最后还是要去BLAST比对下,所以我教大家一种易懂实用的在线设计方法,觉得好的话请投个票。
就以人的PTEN基因为例,首先你要找到他的基因序列,如果你要用的是cDNA,就找它的mRNA序列。
如果你要做的是DNA,就找DNA的序列。
以cDNA为例,普遍的一种方法是上PUBMED中GENE栏搜索找到cDNA那栏,但PUBMED导出序列不太方便,我介绍个网站/index.html1. 输入目的基因,进入2.在左侧栏选择TRANSCRIPT,选择后进入3. 选择PTEN-001中的TRANSCRIPT进入,点击左侧cDNA4. 然后点击CONFIGURE THIS PAGE进入设置你要显示的内容5. 除了第一栏SHOWEXONS选择YES外,其他的都选择NO,然后取个名字保存SAVE CONFIGURATION AS6. 然后在左侧栏点击DOWNLOADVIEW AS RTF可下载你要的cDNA序列,这个文件可以用WORD打开,不同的颜色代表一个外显子间断下载后打开的WORD7. 然后根据可以根据你感兴趣的序列设计引物了,比如我在分别在第6和第7外显子分别设计上下游引物。
选取并复制第6和第7外显子序列8. 登陆/tools/primer-blast/,粘贴这段序列,设置好RANGE和PCR产物的大小,然后在下面点击GET PRIMERS,可以在线设计并比对引物9.最后选择一个比较特异性的引物,条带大小要尽量单一,其他的基因序列尽量不要比对到。
引物设计图⽂教程。
⼀顿操作猛如虎,⼀看战绩0-5。
尽管引物设计是PCR实验成功的前提,但是蛮多⼩伙伴的实战经验稍显不⾜。
今⼉就向⼤家介绍2种引物设计⽅法。
This is the dividing line.引物设计尽管是⽼⽣常谈了,但是⼩编还是想先把引物设计的原则放出来(其实是复制粘贴啦,哪哪都有)。
1、引物应⽤核酸系列保守区设计并具有特异性。
最好位于编码区5\'端的300-400bp区域内,可以⽤DNAMAN,Alignment软件看看结果。
2、不能形成2级结构。
3、引物长度⼀般在17-25bp之间,上下游引物不能相差太⼤。
4、G+C含量在40-60%之间,45-55%最佳。
5、碱基要随机分布,尽量均匀。
6、引物⾃⾝不能有连续4个碱基的互补。
7、引物之间不能有连续4个碱基的互补。
8、引物5‘端可以修饰。
9、3’端不可修饰,⽽且要避开AT,GC富集的区域,避开T/C,A/G连续结构(2-3个)。
10、引物3\'端要避开密码⼦的第三位。
11、引物整体设计⾃由能分布5\'端⼤于3‘端。
12、定量产物长度80-150bp最好,最长是300bp。
原则忒多啦,⼩伙伴们,先别晕,看下⽅。
⽅法⼀:PrimerBank法⽹址:打开以上⽹址,进⼊PrimerBank⽹站界⾯,如下图个⼈觉得这是最便捷的引物获取⽅法,该⽹站可以⾮常迅速地检索到已经他⼈验证的引物序列及相关反应条件。
图中第⼀个⽅框,⼀般选择NCBI Gene ID;第⼆个⽅框选择你所关注的物种,常⽤的就是Mouse和Human了,如果为其它物种,则选择All Species即可;第三个⽅框中需要输⼊你关注的基因ID号码。
如何获取基因ID呢,这⾥就需要打开NCBI⽹站,选择Gene,并输⼊你的⽬的基因如p53 homo,选择第⼀个,可见其ID号为7157。
如下图所⽰。
然后将ID号7157输⼊上⽅PrimerBank⽹站的For text框中,并选择种属为⼈,点击Submit后,跳转页⾯如下。
在专门的引物设计软件中,“Oligo”是最著名的。
它的使用并不十分复杂,但初学者容易被其复杂的图表吓倒。
Oligo 5.0的初始界面是两个图:Tm图和ΔG图;Oligo 6.0的界面更复杂,出现三个图,加了个Frq图。
“Oligo”的功能比“Premier”还要单一,就是引物设计。
但它的引物分析功能如此强大以至于能风靡全世界。
oligo的下载和安装我就不多说了,打开oligo相信也无需多讲。
打开oligo的页面如下:单击file菜单再点open或点击“打开”快捷图标或者用快捷键“CTrl+O”可打开下面的窗口:在打开的OPEN窗口内选择FreqSeq再点“打开”:选择drosfr或者其它一个文件点击“打开”:出现以下窗口,点击“window”再点击“Tile”:出现以下窗口,图中显示的三个指标分别为Tm、ΔG和Frq,其中Frq是6.0版本的新功能,为邻近6至7个碱基组成的亚单位在一个指定数据库文件中的出现频率。
该频率高则可增加错误引发的可能性。
因为分析要涉及多个指标,起动窗口的cascade排列方式不太方便,可从windows菜单改为tile方式。
如果觉得太拥挤,可去掉一个指标,如Frq,这样界面的结构同于Oligo 5.0,只是显示更清楚了:∆G值反映了序列与模板的结合强度,最好引物的∆G值在5'端和中间值比较高,而在3'端相对低(如图)。
Tm值曲线以选取72℃附近为佳,5'到3'的下降形状也有利于引物引发聚合反应。
Frq曲线为“Oligo 6”新引进的一个指标,揭示了序列片段存在的重复机率大小。
选取引物时,宜选用3'端Frq值相对较低的片段:再点击Search再点“Fo'r Primers and probes”或使用快捷键F3:出现以下窗口,点“OK”就OK了。
当然你也可以点击“Prameters”和“SearchRange”选择你要的参数和你上下游引物的位置及你扩增产物的长度:出现Search Status窗口,点“OK”:出现Primer pairs窗口,#代表引物对的编号,依次为引物对所处的位置、产物的长度、最适合的退火温度、和GC的百分含量:点击任一行出现“PCR”窗口,告知你扩增片断的位置,最合适的退火温度等等信息:关掉“PCR窗口”和“primerPairs窗口”回到原来的窗口你就能看到你引物的序列和位置,图中手型鼠标所指即为引物序列:至此引物设计已经完成,你可以用“Analyse”菜单分析你的引物:有无引物二聚体、发卡结构等等:当上下游引物全选好以后,需要对引物进行评价并根据评价对引物进行修改。
使用Oligo 6和Primer Premier 5.0等软件设计PCR引物张新宇(中国医科院肿瘤研究所,北京100021)电子邮件: zhangxy@在当今分子生物学研究中,PCR技术已成为使用最多,最广泛的技术之一。
而引物设计是PCR技术中至关重要的一环。
在PCR扩增以前,一般模板序列已被全部或部分确定。
要想扩增出理想的目的片断,一般都得通过正确设计PCR引物。
也有的人不经过设计直接取模板序列的两个片段作为引物,这样很可能导致实验失败,如扩增出多条带(引发错配所致),不出目的带或出目的带很弱(引物引发效率低下),引物二聚体带(引物与引物之间形成稳定二聚体)等等。
现在PCR引物设计都通过计算机软件进行。
生物信息学发展至今日,具有引物设计功能的软件有很多,其中大部分是免费软件,可直接从网上下载,安装并运行。
这类软件大都简单易用,但其引物设计功能一般不很强,通过它们设计的引物常常不尽如人意,而专门进行引物设计的商业版软件功能强大,但使用起来不太容易。
本文就这一问题进行探讨。
引物设计的原则引物设计有几条基本原则:首先引物要跟模板紧密结合,其次引物与引物之间不能有稳定的二聚体或发夹结构存在,再次引物不能在别的非目的位点引起DNA聚合反应(即错配)。
围绕这几条基本原则,设计引物需要考虑诸多因素,如引物长度(primer length),产物长度(product length),序列Tm值(melting temperature),ΔG值(internal stability),引物二聚体及发夹结构(duplex formation and hairpin),错误引发位点(false priming site),引物及产物GC含量(composition),有时还要对引物进行修饰,如增加限制酶切点,引进突变等。
以使用Oligo软件分析设计引物为例,笔者总结出以下的要点:1.引物的长度一般为15-30bp,常用的是18-27bp,但不能大于38,因为过长会导致其延伸温度大于74℃,即Taq酶的最适温度。
Oligo 设计教程在正式进行引物设计前,我们首先面临的一个任务就是向Oligo 程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一,普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E (2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。
1,点击“Search“菜单中的”For Primers and Probes“命令,进入引物搜索对话框;2,由于我们要设计的是一对PCR引物,因此正、负链的复选框都要选上,同时选上Compatible pairs。
在专门的引物设计软件中,“Oligo”是最著名的。
它的使用并不十分复杂,但初学者容易被其复杂的图表吓倒。
Oligo 5.0的初始界面是两个图:Tm图和ΔG图;Oligo 6.0的界面更复杂,出现三个图,加了个Frq图。
“Oligo”的功能比“Premier”还要单一,就是引物设计。
但它的引物分析功能如此强大以至于能风靡全世界。
oligo的下载和安装我就不多说了,打开oligo相信也无需多讲。
打开oligo的页面如下:
单击file菜单再点open或点击“打开”快捷图标或者用快捷键“CTrl+O”可打开下面的窗口:在打开的OPEN窗口内选择FreqSeq再点“打开”:
选择drosfr或者其它一个文件点击“打开”:
出现以下窗口,点击“window”再点击“Tile”:
出现以下窗口,图中显示的三个指标分别为Tm、ΔG和Frq,其中Frq是6.0版本的新功能,为邻近6至7个碱基组成的亚单位在一个指定数据库文件中的出现频率。
该频率高则可增加错误
引发的可能性。
因为分析要涉及多个指标,起动窗口的cascade排列方式不太方便,可从
windows菜单改为tile方式。
如果觉得太拥挤,可去掉一个指标,如Frq,这样界面的结构同于Oligo 5.0,只是显示更清楚了:
∆G值反映了序列与模板的结合强度,最好引物的∆G值在5'端和中间值比较高,而在3'端相
对低(如图)。
Tm值曲线以选取72℃附近为佳,5'到3'的下降形状也有利于引物引发聚合反应。
Frq曲线为“Oligo 6”新引进的一个指标,揭示了序列片段存在的重复机率大小。
选取引物时,宜选
用3'端Frq值相对较低的片段:
再点击Search再点“Fo'r Primers and probes”或使用快捷键F3:
出现以下窗口,点“OK”就OK了。
当然你也可以点击“Prameters”和“Search
Range”选择你要的参数和你上下游引物的位置及你扩增产物的长度:
出现Search Status窗口,点“OK”:
出现Primer pairs窗口,#代表引物对的编号,依次为引物对所处的位置、产物的长度、最适合的退火温度、和GC的百分含量:
点击任一行出现“PCR”窗口,告知你扩增片断的位置,最合适的退火温度等等信息:
关掉“PCR窗口”和“primer
Pairs窗口”回到原来的窗口你就能看到你引物的序列和位置,图中手型鼠标所指即为引物序列:
至此引物设计已经完成,你可以用“Analyse”菜单分析你的引物:有无引物二聚体、发卡结构等等:
当上下游引物全选好以后,需要对引物进行评价并根据评价对引物进行修改。
首先检查引物二聚体尤其是3‟端二聚体形成的可能性。
需要注意的是,引物二聚体有可能是上游或下游引物自身形成,也有可能是在上下游引物之间形成(cross dimer)。
二聚体形成的能值越高,越不符合要求。
一般的检测(非克隆)性PCR,对引物位置、产物大小要求较低,因而应尽可能选取不形成二聚体或其能值较低的引物。
第二项检查是发夹结构(hairpin);与二聚体相同,发夹结构的能值越低越好。
一般来说,这两项结构的能值以不超过4.5为好。
当然,在设计克隆目的的PCR 引物时,引物两端一般都添加酶切位点,必然存在发夹结构,而且能值不会太低。
这种PCR需要通过灵活调控退火温度以达到最好效果,对引物的发夹结构的检测就不应要求太高。
第三项检查为GC含量,以45-55%为宜。
有一些模板本身的GC含量偏低或偏高,导致引物的GC含量不能
被控制在上述范围内,这时应尽量使上下游引物的GC含量以及Tm值保持接近,以有利于退火温度的选择。
好了,oligo使用的简单介绍到此结束。
在引物设计完之后可以使用软件自带的分析功能,操作如下:
点击“File”菜单中的“New Sequence”命令;
在窗口中输入上游引物;
如果该引物的首位置不是1的话,可以在“Edit”窗口中输入新的5‟端位置数字,如20;
点击Accept/Discard菜单的Accept命令;
如果引物序列长度不同于当前的引物的话,可以从“Change”菜单中改变当前的引物长度;
选取当前序列为上游引物(点击“upper”按钮);
从Edit菜单中选取“Lower Primer”命令,在Edit Lower窗口中输入下游引物的序列;
在Edit窗口的上角处,输入相应的5‟位置;
选取“Accept and Quit”命令;如果想让程序给出最佳退火温度,在此时的对话框中输入PCR
产物的长度以及GC含量所占百分比,一般哺乳动物的cDNA序列中GC大约占44%。
点击OK就可以在“Analyze”菜单中完成各种分析了。
关于引物的评价有几点:
duplex formation:这是评价引物二聚体形成的,包括自身形成二聚体和引物间二聚体,主要
是看引物3…端有无配对碱基(最好没有)。
其中的current oligo是当你对引物进行了编辑(如加入酶
切位点)时,对原始引物进行的分析。
(下同)形成的二聚体要看能值G(得它不会输入啊!),能
值越低越好,最好不要超过4.5(下同)。
hairpin formation:这是看引物自身能否形成发夹结构,主要也是看3‟端不要形成发夹结构。
还要看形成发夹结构的能值,不超过4.5。
如果引物中加入酶切位点,可能会有发夹结构且能值不
会太低,这就需要灵活控制退火温度了。
composition and Tm:分析上下游引物的碱基组成,GC比和Tm值,原则我就不多说了。
false priming site:如果模板不是基因组DNA,而是一个特定模板序列,需要进行错配的分析,看你的引物(尤其3…端)是否与特定模板的其他位点结合。
一般错配的引发效率以不超过100为好,但并不绝对,如果正确结合位点的引发效率为450以上,而有一个错配的引发效率是120左
右的,这个引物也是可以接受的!
PCR:总结性的显示引物位置,产物大小,Tm值等参数,你可以横向比较一下,尤其是给了
一个optimal annealing tem还是可以参照一下地。
也给了简单的评价供参考。
引物主要的评价功能也就这些了,应付一些基本的引物分析足够了。