各个击破:视神经脊髓炎谱系疾病脑内病灶的7种强化模式
- 格式:docx
- 大小:18.64 KB
- 文档页数:6
关于7种颅内环形强化的病变当颅内MRI、CT常规检查发现病变时,常常需要加扫强化序列,病变的强化程度及强化形态对疾病的诊断及鉴别诊断至关重要。
临床中,表现为环形强化表现的颅脑疾病时常遇到,单从这一表现我们就能基本锁定一些常见的病变。
这些病变都有哪些,如何进行记忆呢,在一篇英文的网站中,将颅脑常见疾病总结了以下几种,拼接每个疾病的首字母进行记忆:DR MAGIC。
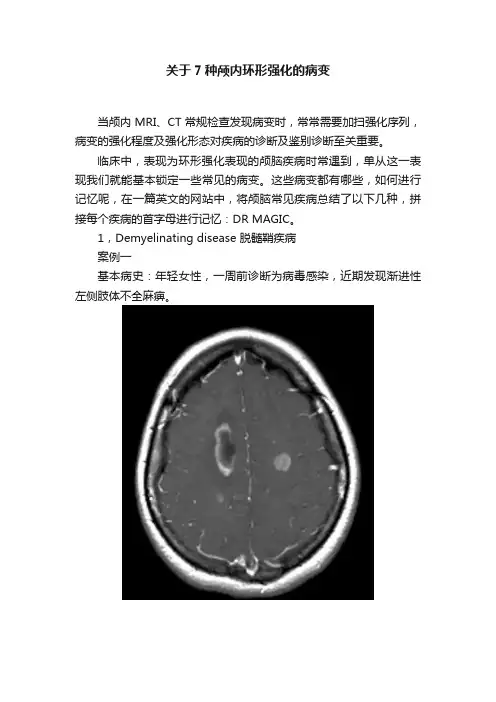
1,Demyelinating disease 脱髓鞘疾病案例一基本病史:年轻女性,一周前诊断为病毒感染,近期发现渐进性左侧肢体不全麻痹。
图 1 颅脑强化MRI轴位和冠状位图像显示双侧放射冠区多发异常强化,右侧较大病灶呈环形强化表现,最终病变证实为急性播散性脑脊髓炎2,Radiation necrosis 或者Resolving haematoma 放射性坏死或者溶解期血肿案例二基本病史:腺癌颅内转移患者,行放射性治疗后复查MRI如下。
图 2-1 颅脑MRI强化轴位及冠状位图显示左侧顶枕交界区环形强化灶,最终证实为脑转移放射治疗后的放射性坏死灶所致图2-2 溶解期血肿环形强化3,Metastasis 转移瘤案例三基本病史:MRI检查发现左侧额叶肿块,行强化扫描。
图3 颅脑MRI检查轴位及冠状位强化图像显示左侧额叶环形强化灶,最终证实为转移瘤4,Abscess 脓肿案例四基本病史:患者头部外伤后,左侧额骨骨折,5周后CT检查发现如下。
图4 颅脑CT强化发现左侧额叶环形强化灶,最终证实为外伤后感染导致的脓肿5,Glioblastoma 胶质母细胞瘤案例五基本病史:女性,60岁,视觉障碍,头痛,表达性语言障碍。
图5-1 颅脑MRI强化显示左侧环形强化病灶图 5-2 六个月后复查CT,强化扫描后发现左侧额叶病变较前明显增大,呈环形强化,最终证实为胶质母细胞瘤6,Infarct (subacute phase) 亚急性期脑梗死案例六基本病史:亚急性期梗死患者,行MRI复查。


【中枢神经系统免疫】视神经脊髓炎谱系疾病1概述视神经脊髓炎谱系疾病(NMOSD)是一种主要累及视神经和脊髓的中枢神经系统(CNS)炎症性疾病。
Devic和Gault首先报道了一系列患者,表现为双侧或相继的视神经炎和脊髓炎。
视神经脊髓炎或Devic病需要视神经炎、脊髓炎和无其他中枢神经系统疾病作为诊断标准。
NMOSD一词最早于2007年引入,除了经典的NMO以外,还包括复发性或双侧视神经炎和纵向广泛性横贯性脊髓炎(LETM)。
在2015年,NMOSD被提议作为一个统一的术语来覆盖该疾病的整个临床谱系,包括局限型NMO,如复发性视神经炎或首次发作的LETM,其复发风险很高,以及不同的脑部表现,例如极后区综合征,脑干综合征和间脑综合征。
近年来,在这一独特的疾病领域取得了一些进展,从更好地了解本病的致病机制和使用新的诊断工具用于亚临床疾病的检测,到开发针对炎症级联反应中不同分子的新型治疗药物。
一些研究表明,根据使用的检测方法,20-30%的NMOSD中可能不存在水通道蛋白4(AQP4)抗体。
借助基于细胞底物的实验(cell-based assay,CBA),已在AQP4血清阴性的NMOSD病例中检测出MOG 抗体。
尽管与AQP4阳性NMOSD有重叠的临床和放射学特征,但MOG抗体相关疾病现已被视为一种独特的疾病实体。
通过光学相干断层扫描(OCT)评估视网膜神经纤维层厚度和黄斑体积,对本病不同亚型的视神经炎的诊断评估和随访有重要影响。
最近的各种随机试验已经证明了针对补体蛋白C5、IL-6受体、CD19等的不同单克隆抗体的有效性;尽管还需要更大规模的研究来证实这些结果。
本综述的目的是根据最新的文献,讨论最新的进展及其对改善疾病结局的影响,并指出未来研究的范围。
2发病机制/病理学2.1 AQP4抗体阳性NMOSDAQP4是一种水通道蛋白,在CNS星形胶质细胞的终足(end-feet)表达,在室管膜细胞中表达较少。



2015年视神经脊髓炎谱系疾病(NMOSD)诊断标准2015年7月14日美国神经病学会neurology杂志发表《视神经脊髓炎谱系疾病(NMOSD)诊断标准国际共识》,来自9个国家的18名专家共同参与了标准制订。
共识决定将视神经脊髓炎(NMO)统一命名为视神经脊髓炎谱系疾病(NMOSD)。
在未来临床工作中,此次标准修改适用的时间可能较2006版更长。
我们先将最新的NMOSD诊断标准、用于鉴别诊断的'红色信号'(Red flags)和NMOSD的影像学表现翻译给大家,供大家了解新标准的变化。
翻译不当之处多加批评。
以后将继续推送共识的全文翻译和解读。
表一:成人NMOSD诊断标准伴AQP4-IgG的NMOSD诊断标准1.至少1个核心临床症状2.应用最佳方法检测AQP4-IgG阳性(强烈推荐细胞检测法)3.排除其它诊断不伴AQP4-IgG或未知AQP4-IgG状态的NMOSD诊断标准1.在1次或数次临床发作中至少有2个核心临床症状,符合以下要求a.至少一个核心临床症状必须是视神经炎、长节段横贯性脊髓炎或极后区综合征b.空间多发(≥2个不同核心临床症状c. 以上症状需满足附加的MRI要求2.应用最佳方法检测AQP4-IgG阴性或不能检测3.排除其它诊断核心临床症状1.视神经炎2.急性脊髓炎3.极后区综合征:不能用其它原因解释的呃逆、恶心、呕吐4.急性脑干综合征5.症状性发作性嗜睡或伴NMOSD典型间脑MRI病变的急性间脑临床综合征(如图3)6.伴NMOSD典型间脑MRI病变的有症状的大脑半球综合征(如图3)不伴AQP4-IgG或未知AQP4-IgG状态NMOSD的附加MRI要求1.急性视神经炎:要求脑MRI显示(a)正常或仅有非特异性白质病变,或(b)视神经MRI有T2高信号或T1强化,病变超过1/2视神经长度或累及视交叉(如图1)2.急性脊髓炎:要求相应的脊髓MRI病变大于3个连续椎体节段(长节段横贯性脊髓炎)或与既往脊髓炎病史相应的大于3个椎体节段的脊髓萎缩(如图1)3.极后区综合征:要求有相应的延髓背侧或极后区病变(如图2)4.急性脑干综合征:要求有相应的室管膜周围脑干病变(如图2)图1:NMOSD的脊髓和视神经MRI表现NMOSD脊髓影像学常表现为长节段横贯性脊髓炎(LETM),病变≥3个椎体节段。

中国视神经脊髓炎谱系疾病诊断与治疗指南一、本文概述视神经脊髓炎谱系疾病(NMOSD)是一种罕见的中枢神经系统自身免疫性疾病,主要影响视神经和脊髓,导致视力下降、肢体无力、感觉异常等症状。
近年来,随着对该疾病的深入研究,越来越多的治疗方法被应用于临床实践。
为了规范我国NMOSD的诊断和治疗,提高患者的生存质量,我们制定了《中国视神经脊髓炎谱系疾病诊断与治疗指南》。
本指南旨在为临床医生提供NMOSD的最新诊断和治疗建议,帮助医生更好地识别和管理NMOSD患者。
本指南基于国内外相关研究和临床实践,结合我国实际情况,对NMOSD的诊断标准、治疗方法、预后评估等方面进行了详细阐述。
本指南也强调了多学科协作在NMOSD诊断和治疗中的重要性,提倡医生与康复科、神经心理科、眼科等多学科团队合作,为患者提供全面的医疗服务。
希望本指南的发布能为我国NMOSD的诊断和治疗提供有益的参考,为患者带来更好的治疗效果和生活质量。
二、疾病定义与分类视神经脊髓炎谱系疾病(NMOSD)是一组以视神经和脊髓为主要受累部位的中枢神经系统自身免疫性疾病。
该疾病谱系涵盖了视神经脊髓炎(NMO)以及其他具有类似临床表现和病理机制的疾病。
NMOSD 的主要特点包括反复发作的视神经和脊髓炎症,以及高血清学阳性率(如抗水通道蛋白4抗体,AQP4-IgG)和高死亡率。
根据临床表现和影像学特征,NMOSD可分为典型NMO和非典型NMOSD。
典型NMO主要累及视神经和脊髓,表现为视力下降、眼痛、肢体无力、感觉异常等。
非典型NMOSD则可能包括其他中枢神经系统的受累,如脑干、间脑、大脑半球等,临床表现多样,可能包括头痛、恶心、呕吐、意识障碍、认知障碍等。
NMOSD的分类主要基于临床表现、影像学特征、血清学标志物以及病理机制。
近年来,随着对NMOSD研究的深入,对疾病的认识和理解也在不断更新和完善,为临床诊断和治疗提供了更加科学的依据。
以上内容仅为概述,具体的疾病定义与分类应根据最新的临床研究和专业指南进行更新和完善。


脑膜强化的10种常见类型“一般而言,颅内病变对比增强主要包括血管内(血管)强化和血管外(间质)强化。
前者主要是由于局部血容量或血流量相对增加;而后者则因血脑屏障缺乏或被破坏导致通透性异常增加和/或局部血管发育不良出现对比剂外渗所致。
根据颅内强化病变所在部位,可分为脑实质外强化和脑实质内强化,前者主要指脑膜强化,也是本次我们一起重点学习的内容。
”一、硬脑膜强化也称为硬脑膜-蛛网膜强化,由于硬脑膜内层含有丰富的毛细血管网,其微血管缺少紧密连接,因此正常硬脑膜可轻度强化,但通常表现纤细、光滑、不连续的线样影,多见于硬脑膜反折处(如海绵窦、麦克尔腔等)和脑凸面。
当硬脑膜强化长度超过3cm时,需高度怀疑硬脑膜病变。
硬脑膜异常强化表现为沿颅骨内侧面走行的弯曲状、连续的线样或增厚的线样强化,累及大脑镰及小脑幕,可伴有结节样强化,但不伸入脑沟和基底部脑池。
硬脑膜强化的病因有许多,主要包括低颅压综合征,感染或自身免疫性疾病,肿瘤(如脑膜瘤、淋巴瘤),转移性病变(乳腺癌或前列腺癌等),短暂性术后改变等。
图1 硬脑膜强化模式图低颅压综合征低颅压综合征是一组以体位性(直立性)头痛和脑脊液压力降低为特征的临床综合征。
可为自发性,也可继发于硬脊膜穿刺后、硬脊膜意外开放或手术大量脑脊液引流后。
该疾病在MRI上有五大特征性表现:硬膜下积液、硬脑膜强化、静脉结构充盈、垂体充血和脑组织下沉。
其中,硬脑膜强化是最具特征性的表现,阳性率最高,出现也最早,表现为弥漫、连续的线样增强,无局限性结节,常伴有硬脑膜增厚和皮层静脉的扩张,但不累及软脑膜。
图2 一例低颅压综合征患者,可见斜坡和小脑幕处硬脑膜增厚并强化图3 另一例低颅压综合征患者A:脑组织下沉;B:硬脑膜强化;C:内听道硬脑膜增厚肥厚性硬脑膜炎该疾病是一种以脑和/或脊髓硬膜局限性或弥漫性纤维性增厚为特征的罕见中枢神经系统疾病,按病因可分为特发性和继发性(感染、自身免疫病、肿瘤、外伤等)两种形式,临床以头痛和颅神经麻痹症状最常见。


视神经脊髓炎谱系疾病诊疗进展详解视神经脊髓炎谱系疾病(NMOSD)是一种自身免疫介导的以视神经和脊髓受累为主的中枢神经系统炎性脱髓鞘疾病,反复存在的AQP4-IgG抗体是其典型特征。
该疾病具有高复发、高致残的特点,可导致视力丧失和瘫痪,预后极差。
概述临床症状NMOSD首次发病见于各年龄阶段,好发于青壮年,女性居多。
临床上多以严重的视神经炎(ON)和纵向延伸的长节段横贯性脊炎(LETM)为特征表现,6组NMOSD的核心临床症候分别为视神经炎、急性脊髓炎、极后区综合征、急性脑干综合征、急性间脑综合征和大脑综合征。
NMOSD为高复发、高致残性疾病(图1);常与一些自身免疫疾病如干燥综合征、系统性红斑狼疮、桥本氏病等发生共病现象。
NMOSD的高复发、高致残性致病机制目前,整体上认为AQP4-IgG是NMOSD致病性抗体。
血清AQP4-IgG主要在外周由浆细胞和浆母细胞产生,并通过内皮胞吞作用或相对血脑屏障通透性或损伤区城穿透进CNS,导致AQP4-IgG与星形胶质细胞上的AQP4蛋白相结合。
抗体依赖性星形胶质细胞损伤涉及CDC、CDCC和ADCC 等机制,并进一步导致炎症反应、少突胶质细胞丢失、脱髓鞘和神经元丢失。
2:NMOSD发病机制遗传影响因素(1)HLA(2)免疫调节基因NMOSD发病风险增加相关基因:CD40、STAT4、GTF2IRD1-GTF21、TNFSF4、CD58;NMOSD发病风险减少相关基因:IRAK1。
NMOSD的诊断谈及对于NMOSD患者的诊断,周红雨教授指出,尽管NMOSD与多发性硬化(MS)在临床表现、影像学具有诸多相似之处,但两者的诊断却“大相径庭”。
MS的诊断基于影像学寡克隆区带,其病灶具有空间多发性,且脊髓MRI多呈短节段病灶。
而NMOSD的诊断(如图3)以“病史+核心临床症候+影像特征+生物标记物”为基本依据,以AQP4-IgG作为分层。
AQP4-IgG对于NMOSD的诊断具有较高的特异性,达90%-95%。
《中国视神经脊髓炎谱系疾病诊断与治疗指南》要点该指南的要点可以总结为以下几方面:1.定义和分类:指南首先对视神经脊髓炎谱系疾病进行了明确的定义和分类,包括多发性硬化症(MS)、免疫介导的脊髓炎(ADEM)、视神经神经炎(ON)等。
2.诊断标准:指南提供了详细的诊断标准,帮助医生了解如何根据临床表现和辅助检查结果进行准确的诊断。
指南还指出了不同疾病之间的鉴别诊断要点。
3.治疗原则:指南列出了治疗视神经脊髓炎谱系疾病的原则,包括控制病情活动、改善症状、预防复发等。
指南还强调了个体化治疗的重要性,根据患者的具体情况选择合适的治疗方案。
4.治疗方法:指南介绍了常用的治疗方法,包括药物治疗、康复治疗、手术治疗等。
指南分别对不同疾病的治疗方法进行了详细说明,指出了治疗的步骤和注意事项。
5.药物选择:指南推荐了一些常用的药物,包括免疫抑制剂、抗病毒药物、激素等。
指南明确了不同药物的适应症和禁忌证,并对剂量和疗程进行了指导。
6.康复治疗:指南强调了康复治疗在视神经脊髓炎谱系疾病中的重要性,包括物理治疗、功能训练、心理支持等。
指南提供了一些建议和措施,帮助患者恢复功能和提高生活质量。
7.随访和复查:指南建议患者在治疗后进行定期的随访和复查,以评估疾病的控制状况和治疗效果。
指南还介绍了常用的评估指标和辅助检查方法。
总之,该指南提供了视神经脊髓炎谱系疾病的诊断和治疗全面的指导,助力医生更准确地诊断和治疗这些疾病。
此外,指南也为患者提供了合理的治疗选择和康复建议,提高了患者的生活质量。
指南的发布有望进一步推动视神经脊髓炎谱系疾病的治疗水平和研究进展。
颅脑疾病基本征象-“强化形态”的深刻解读颅脑疾病基本征象-强化形态根据强化的形态学表现,颅内病变强化可分为均匀强化、不规则强化、斑片状强化、脑回状强化、环状强化等。
不同强化类型见于不同疾病,因此具有一定鉴别诊断价值。
1无匀强化指注射对比剂后病变均匀性密度增高或信号强度增加,表明病变内结构较一致,无明显坏死与囊变、出血等继发改变,见于脑膜瘤、垂体瘤、未囊变及坏死的神经鞘瘤、松果体区肿瘤、未血栓化的动脉瘤。
如图1,颞骨岩部(桥小脑角区)均匀强化的脑膜瘤,增强扫描呈均匀信号增高(箭)及宽基底贴附于颞骨岩部后缘,并见脑膜尾征。
图12不规则强化病变强化程度及形态不一,原因是其病理变化复杂多样,不同成分混合存在,见于恶性肿瘤如多形性胶质母细胞瘤(GBM)、恶性脑膜瘤、肉瘤、转移瘤、肉芽肿性病变、部分脑梗死等。
如图2,不规则强化的右侧颅中窝软骨瘤,增强扫描内部颗粒状、斑片状信号增高,边缘见包膜样强化(箭)。
图23斑片状强化增强扫描病变内片状、边缘模糊或清楚的密度或信号增高,常为轻中度强化,说明病变区BBB破坏及血供增加均较轻,见于低级别神经上皮肿瘤、脑炎、脑梗死等。
如图3,斑片状轻度强化的弥漫性星形细胞瘤(箭)。
图34脑回状强化注射对比剂后病变局部呈近似脑回的密度或信号增高,有时可合并邻近脑膜增厚及强化,常见于累及脑皮质的病变,如脑梗死、脑炎、脑挫裂伤等。
如图4,脑回状强化的急性期脑梗死,发病2天,增强扫描左颞枕叶大片低信号内见脑回状信号增高(无尾箭头),局部脑沟变浅、左侧脑室三角区与枕角受压变窄。
图45环状强化环状强化为注药后病变周边见环周增强,见于各种囊变坏死的肿瘤、脑梗死、脑脓肿等。
病理学上强化环可为肿瘤的实性成分,也可为炎症反应或脑回状强化的部分容积效应形成。
炎性病变(化脓性病变、其他炎症或寄生虫、真菌等)强化环内壁一般光整、有一定张力,外壁可稍不规则,环的厚度较均匀,或近皮质层较厚、近室管膜侧较薄。
视神经脊髓炎的分型-概述说明以及解释1.引言1.1 概述视神经脊髓炎是一种炎症性疾病,主要影响视神经和脊髓。
它是由于免疫系统的异常反应导致的,可能与感染、自身免疫病等因素有关。
视神经脊髓炎的发病机制尚未完全清楚,但目前认为与免疫系统的异常反应密切相关。
大多数视神经脊髓炎患者表现出针对自身组织的免疫攻击,导致病变和炎症的发生。
这些炎症反应可能会损害视神经和脊髓的神经纤维,造成视力障碍和运动功能障碍。
视神经脊髓炎的临床表现多样化,常见症状包括视力模糊、眼球运动异常、视野缺损、肢体无力、感觉异常等。
这些症状的严重程度和持续时间因个体差异而异,有些患者可能只有轻微的视力障碍,而另一些患者可能会出现严重的残疾。
为了更好地理解和诊断视神经脊髓炎,医学界对其进行了不同的分型。
目前常用的分型方法包括按病程分型、按病变部位分型和按临床症状分型等。
病程分型根据疾病的发展进程将其分为急性、亚急性和慢性三种类型。
病变部位分型根据受累的神经系统部位将其分为视神经型、脊髓型和脑脊髓型等。
临床症状分型则根据患者主要的临床表现将其分为视力障碍型、运动功能障碍型和感觉障碍型等。
诊断视神经脊髓炎需要综合分析患者的临床症状、体征、实验室检查和影像学检查等多种信息。
常用的诊断方法包括脑脊液检查、视力检查、视野检查、MRI等。
脑脊液检查可以检测到炎症反应的指标,而视力检查和视野检查可以评估视神经功能的损害程度。
MRI可以帮助确定病变的位置和范围。
目前针对视神经脊髓炎的治疗方法主要包括免疫抑制剂的应用、激素治疗和对症治疗等。
免疫抑制剂可以抑制异常免疫反应,减少病变的发生和进展。
激素治疗可以减轻炎症反应和控制免疫系统的活动。
对症治疗主要包括症状缓解和功能康复的方法,如视力康复训练、物理治疗等。
综上所述,视神经脊髓炎是一种免疫系统异常反应引起的炎症性疾病,其病程分型、临床表现、诊断和治疗方法各有特点。
深入研究视神经脊髓炎的分型有助于提高对该疾病的认识和诊断水平,并为患者提供更有效的治疗策略。
视神经脊髓炎(视神经脑脊髓病,眼脑脊髓病)概述视神经脊髓炎,又称为视神经脑脊髓病,是一种罕见的中枢神经系统疾病,主要表现为视力下降、视野缺损、视神经乳头水肿等症状。
该疾病往往与免疫系统异常有关,导致视神经和脑脊髓的炎症损伤,给患者的视觉功能带来严重影响。
病因视神经脊髓炎的确切病因尚不完全清楚,但大多数病例与免疫系统异常有关。
自身免疫反应误认视神经或脑脊髓中的组织为异物或有害物质,导致免疫细胞攻击这些组织,造成炎症和损伤。
症状•视力下降:患者常感到视力模糊或视物变形。
•视野缺损:可能出现视野中的黑点或模糊区域。
•视神经乳头水肿:眼底检查可见视神经头(乳头)水肿。
•眼球运动异常:可能出现眼球活动受限或眼球震颤等症状。
•眼睑下垂:部分患者可能出现眼睑下垂的症状。
诊断视神经脊髓炎的诊断需综合医学史、检查结果及症状进行判断。
常用的诊断方法包括: - 眼底检查:可观察到视神经乳头水肿情况。
- 视野检查:评估视野是否有缺损。
- 神经影像学检查:如MRI和CT扫描,可用于观察视神经和脑脊髓的情况。
治疗治疗视神经脊髓炎主要包括控制病情发展、缓解症状和改善患者生活质量。
常用的治疗方法有: - 类固醇治疗:以减轻炎症反应。
- 免疫抑制剂治疗:用以抑制免疫系统活性。
- 康复训练:包括眼球运动康复、视觉康复等。
预后视神经脊髓炎的预后取决于病情的严重程度以及治疗的及时性。
一些轻型患者可能经过治疗后康复良好,但重型患者可能有视力永久受损的风险。
定期随访及规范治疗对于预后至关重要。
结语视神经脊髓炎是一种病因尚未完全明确的神经疾病,给患者的视觉功能带来严重影响。
及时诊断和治疗对于延缓疾病进展、改善患者生活质量至关重要。
希望本文能够帮助读者更好地了解视神经脊髓炎,提高对该疾病的认识。
各个击破:视神经脊髓炎谱系疾病脑内病灶的7种强化模式视神经脊髓炎(NMO)是中枢神经系统急性或亚急性炎性脱髓鞘性疾病。
以往的NMO 诊断标准要求视神经和脊髓受累,但临床也可能出现较局限的或较广泛的 CNS 受累。
2007 年 Wingerchuk 等提出了视神经脊髓炎谱系疾病(NMOSD)的概念。
2015 年国际 NMO 诊断小组(IPND)制定了新的 NMOSD 诊断标准,取消了NMO 的单独定义,将NMO 整合入更广义的NMOSD 疾病范畴中。
自此,NMO 与 NMOSD 统一命名为 NMOSD,是一组主要由体液免疫参与的抗原-抗体介导的CNS 炎性脱髓鞘疾病谱。
NMOSD 有 6 组核心临床症候,其中视神经炎、急性脊髓炎、延髓最后区综合征的临床及影像表现最具特征性。
不强化的脑内病灶在NMOSD 中更为常见,先前的一些研究报道9%~36% 的患者头颅MRI 上可出现病灶强化,可能与血脑屏障破坏有关,其有一定的特征性,或有助于本病的诊断,下面我们就来梳理下 NMOSD 可能出现的几种脑内强化模式。
脑实质片状强化(「云雾状」强化)为 NMOSD 脑内病灶最常见的强化模式,表现为多发边界不清、模糊的片状强化,如同云雾,由 Ito 等于 2009 年首先报道。
这有助于与多发性硬化鉴别,后者多为结节性或环形强化,边界清楚。
「云雾状」强化有时伴有室管膜周线状强化,是 NMOSD 更具特征性的表现,形似「火焰」(图1)或「口中冒烟(smoke coming out of mouth)」(图 2)。
图 1 「云雾状」强化。
57 岁女性,AQP-4 抗体阳性的 NMOSD。
T1 增强可见片状,边界不清的脑实质强化病灶[箭];同时可见脊髓受累 [箭头]图2 「云雾状」强化伴室管膜周线状强化。
62 岁男性,AQP-4 抗体阳性的 NMOSD。
T1 增强可见室管膜周强化伴边界不清的脑实质轻度强化,看上去像「口中冒烟」室管膜周线状强化表现为环绕侧脑室,三脑室,四脑室和(或)导水管的较细的线状强化(铅笔杆样病灶)。
可能与室管膜细胞富含 AQP-4 有关。
疾病复发时上述区域常出现强化,较有特征性。
常伴有脑室周围FLAIR 上线状高信号。
室管膜周线状强化以及FLAIR 上脑室周围线状高信号可能反映了疾病的更早期过程。
随着病情进展,室管膜周线状强化可变粗,形态可不规则,甚至延伸累及脑实质。
室管膜周强化的鉴别诊断包括感染性脑室炎以及淋巴瘤和结节病等。
图 3 室管膜周线状强化。
A、C:FLAIR;B、D:T1 增强;A-B:21 岁女性,AQP-4 抗体阳性的NMOSD。
可见沿侧脑室前角的室管膜周线状高信号和线状强化 [箭];C-D:35 岁女性,AQP-4 抗体阳性的 NMOSD。
可见环导水管的室管膜周线状高信号和线状强化 [箭]图 4 25 岁男性 NMOSD 患者。
a:T2WI;b-d:T1 增强;可见胼胝体线状强化;侧脑室室管膜表面较细的线状强化图5 室管膜周线状强化。
A:FLAIR;B:T1 增强;73 岁男性,NMOSD 后期复发时可见较厚的室管膜周线状强化软脑膜强化软脑膜强化可能与软脑膜和软脑膜下表面 AQP-4 功能受损有关,可表现为线状或较粗的,弥漫的病灶。
脑干周围的软脑膜强化近期也有报道。
软脑膜强化需除外感染性疾病,肉芽肿性疾病(如结节病)以及肿瘤性疾病等。
表现为软脑膜强化的 NMOSD 患者可有脑病样症状,使得临床上诊断难度加大,需小心鉴别。
图 6 28 岁女性,AQP-4 抗体阳性的 NMOSD。
A:T2WI 可见右侧大脑半球皮质高信号,脑沟显示不清,无白质病变;B:T1 增强提示较粗的软脑膜和皮质强化图 7 1 例 NMOSD 患者 T1 增强可见脑桥周围软脑膜强化脑干、下丘脑和锥体束病灶强化除了脑室旁区域,下丘脑,四脑室延髓底部,极后区等也富含AQP-4。
因此,这些部位的病灶也是 NMOSD 的特点之一。
下丘脑受累在 NMOSD 患者中较急性播散性脑脊髓炎和多发性硬化更为常见。
近来研究发现,双侧下丘脑受累有助于 NMOSD 与多发性硬化的鉴别。
上述区域病灶通常轻度强化,边界不清。
皮质脊髓束受累可为单侧或双侧,病灶可能从大脑半球深部的白质通过内囊后肢延伸至中脑的大脑脚或者脑桥。
这些病灶连续,常为长节段,沿锥体束分布。
一些关于 NMOSD 患者的队列研究报道,约 23-44% 的患者存在皮质脊髓束的病灶,在其他研究中也偶有发现。
有意思的是,和脑室周围不同,皮质脊髓束并不是 AQP-4 高表达的区域,因此至今尚不清楚 NMOSD 患者这一区域常累及的原因。
锥体束受累目前尚无病灶强化的报道。
图8 双侧下丘脑受累。
A:FLAIR;B:T1 增强;21 岁女性,AQP-4 抗体阳性的 NMOSD。
可见下丘脑高信号病灶呈边界模糊的轻微强化 [箭]图 9 延髓背侧病灶。
A:FLAIR;B:T1 增强;28 岁女性,AQP-4 抗体阳性的NMOSD。
可见延髓背侧高信号病灶呈边界模糊的轻微强化 [箭]脑实质血管周围强化此种强化模式罕见报道,可能也与软脑膜和软脑膜下表面AQP-4 功能受损有关。
表现为脑实质线状和(或)点状强化。
血管周围强化的鉴别诊断包括各种病因引起的血管炎,感染和肿瘤等。
图 10 49 岁女性 NMOSD 患者。
A:FLAIR 上可见右侧颞叶线状高信号 [箭];B-C:T1 增强可见线状强化 [箭];D:同侧视神经增粗强化 [箭]图11 A:FLAIR 上可见半卵圆中心线状,点状高信号[箭];B:T1 增强可见对应区域点状强化,沿血管周围分布孤立的、环形或开环样强化孤立强化,环形或开环强化,更多时候是多发性硬化的特征性表现,罕见于NMOSD,但仍有报道,特别是AQP-4 抗体阴性的NMOSD 患者。
图 12 2 例 AQP-4 抗体阳性的 NMOSD 患者 T1 增强上呈现多发性硬化样强化。
A:57 岁女性,可见脑桥孤立的边界清楚的结节样强化病灶;B:65 岁男性,可见开环强化病灶视神经和视交叉强化NMOSD 和多发性硬化均可有视神经炎,其临床影像学表现相似。
但是长节段强化病灶,延伸累及视交叉甚至视束,双侧均有受累更多提示 NMOSD 的诊断。
图 13 44 岁女性,视神经和视交叉强化。
A:FLAIR 上可见视神经后段,视交叉和视束高信号[箭],同时可见导水管周围高信号[箭头];B:T1 增强可见病灶明显强化 [箭]推荐阅读:视神经炎诊断中的这些误区你需要当心编辑 | 李晴投稿及合作|**********参考文献1. 中国免疫学会神经免疫学分会, 中华医学会神经病学分会神经免疫学组, 中国医师协会神经内科分会神经免疫专业委员会. 中国视神经脊髓炎谱系疾病诊断与治疗指南. 中国神经免疫学和神经病学杂志.2016 年 3 期。
2. Kim HJ, Paul F, Lana-Peixoto MA, T enembaum S, Asgari N, Palace J, Klawiter EC, Sato DK, de Seze J, Wuerfel J, Banwell BL, Villoslada P, Saiz A, Fujihara K, Kim SH; Guthy-Jackson Charitable Foundation NMO International Clinical Consortium & Biorepository.MRI characteristics of neuromyelitis optica spectrum disorder: an international update.Neurology. 2015 Mar 17;84(11):1165-73.3. Pekcevik Y, Orman G, Lee IH, Mealy MA, Levy M, IzbudakI.What do we know about brain contrast enhancement patterns in neuromyelitis optica?Clin Imaging. 2016 May-Jun;40(3):573-80.4. Pekcevik Y, Izbudak I.Perivascular Enhancement in a Patient with Neuromyelitis Optica Spectrum Disease during an Optic Neuritis Attack.J Neuroimaging. 2015 Jul-Aug;25(4):686-7.5. Sahraian MA, Moghadasi AN, Owji M, Naghshineh H, Minagar A.Neuromyelitis optica with linear enhancement of corpus callosum in brain magnetic resonance imaging with contrast: a case report.J Med Case Rep. 2015 Jun 10;9:137.6. Long Y, Chen M, Zhang B, Gao C, Zheng Y, Xie L, Gao Q, Yin J.Brain gadolinium enhancement along the ventricular and leptomeningeal regions in patients with aquaporin-4 antibodies in cerebral spinal fluid.J Neuroimmunol. 2014 Apr 15;269(1-2):62-7.。