2016届高考化学一轮复习课时跟踪检测24弱电解质的电离平衡和水的电离新人教版
- 格式:doc
- 大小:143.50 KB
- 文档页数:6
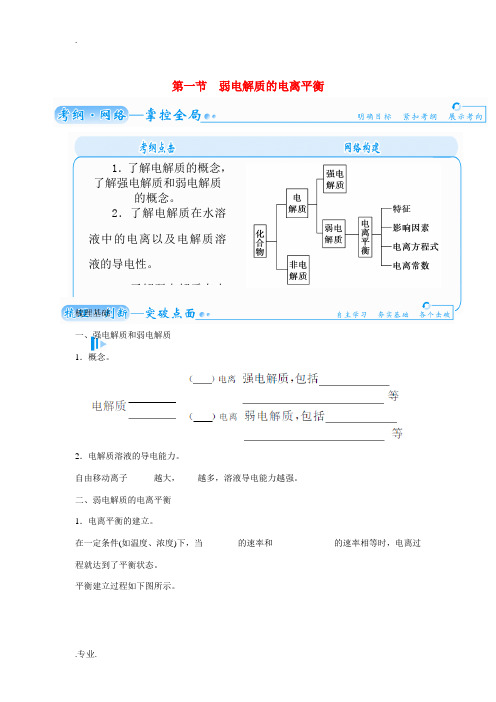
第一节弱电解质的电离平衡1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离以及电解质溶液的导电性。
3.了解弱电解质在水梳理基础一、强电解质和弱电解质1.概念。
2.电解质溶液的导电能力。
自由移动离子______越大,____越多,溶液导电能力越强。
二、弱电解质的电离平衡1.电离平衡的建立。
在一定条件(如温度、浓度)下,当________的速率和______________的速率相等时,电离过程就达到了平衡状态。
平衡建立过程如下图所示。
2.电离平衡的特征。
(如下图)3.电离平衡常数。
(1)概念:在一定温度下,当弱电解质在水溶液中达到电离平衡时,溶液中离子浓度幂之积与分子浓度的比值是一个常数。
(2)表达式:对于HA H++A-,Ka=________;对于BOH B ++OH-,Kb=__________。
(3)特点。
①电离平衡常数只与温度有关,升温,K值______。
②多元弱酸的各级电离平衡常数的大小关系是_____,故其酸性取决于第一步。
(4)意义。
4.外界条件对电离平衡的影响。
(1)温度。
弱电解质的电离是______过程,升高温度,电离程度______。
(2)浓度。
稀释溶液,离子相互碰撞结合成分子的机会________,弱电解质的电离程度________。
(3)外加强电解质。
加入含有弱电解质的组成离子的强电解质,弱电解质的电离程度减小。
(4)已知CH3COOH CH3COO-+H+ΔH > 0,完成下面表格:改变条件平衡移动方向n(H+) c(H+)c(CH3COO-)c(CH3COOH)电离程度(α)导电能力Kα加水稀释加入少量冰醋酸加HCl(g)加NaOH(s)K越大越电离酸(碱)性越加入醋酸钠固体加入镁粉升高温度判断弱电解质的三个思考点思考一、弱电解质的定义,即弱电解质不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
思考二、弱电解质溶液中存在电离平衡,条件改变,平衡移动,如pH=1的CH3COOH加水稀释10倍1<pH<2。

第一节弱电解质的电离平衡和水的电离1.下列说法正确的是( )A.将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半B.如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍C.强电解质溶液的导电能力一定比弱电解质溶液强D.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需NaOH和醋酸所需NaOH 相等解析:选D 氨水是弱碱,存在电离平衡,稀释促进电离,所以氨水中OH-浓度大于原来的一半,A不正确。
醋酸是弱酸,存在电离平衡,所以盐酸中的H+浓度大于醋酸中的H+浓度的两倍,B不正确。
溶液导电能力强弱与溶液中离子浓度大小和离子所带电荷数有关系,C不正确。
所以正确的答案选D。
2.下列有关溶液的说法正确的是( )A.向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,混合液的pH=7 B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3C.NH4Cl溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH-)D.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶解析:选B 醋酸是弱酸,pH=3的醋酸溶液的浓度大于0.001 mol/L,向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,醋酸过量,混合液的pH<7,A不正确;NH4HCO3溶液显碱性,说明碳酸的电离程度小于一水合氨的电离程度。
CH3COONH4溶液显中性,说明醋酸的电离程度和一水合氨的电离程度相等,所以酸性CH3COOH>H2CO3,B正确;在NH4Cl 溶液中,根据电荷守恒可知,在氯化铵溶液中存在c(H+)+c(NH+4)=c(OH-)+c(Cl-),根据物料守恒可知c(Cl-)=c(NH3·H2O)+c(NH+4),则c(H+)=c(OH-)+c(NH3·H2O),C不正确;只要溶液中c(Ag+)·c(Cl-)>K sp(AgCl),溶液中就有沉淀生成,而与氯化银和碘化银的溶解度相对大小并无直接关系,AgI比AgCl更难溶,D不正确。

第七章水溶液中的离子平衡第一节弱电解质的电离平衡一、单项选择题1.有关电解质与非电解质的陈述,合理的是()A.在水溶液中能导电的化合物都是电解质B.在熔融状态下不导电的化合物都是非电解质C.氨水为混合物,不属于电解质D.硫酸溶于水能导电,所以浓硫酸为电解质解析:在水溶液中能导电,且导电的离子全部来自化合物自身,这样的化合物为电解质。
共价化合物有的虽为电解质,但由于熔融时不能电离成自由移动的离子,所以不能导电。
浓硫酸是混合物,不属于电解质,纯硫酸才是电解质。
答案:C1题变式1-1.电解质有强弱之分,二者的区别在于其电离程度的差异。
下列对强、弱电解质的描述,不正确的是()A.强电解质是指在水溶液中能完全电离的电解质B.在水溶液中离子浓度小的电解质为弱电解质C.在水溶液中只能部分电离的电解质为弱电解质D.强酸、强碱和绝大部分盐类为强电解质解析:离子浓度的大小并不能作为判断电解质强弱的依据,因为起始浓度小的电解质,即使完全电离,电离产生的离子浓度也很小。
答案:B2.下列实验事实不能证明醋酸是弱酸的是()A.常温下,测得醋酸钠溶液的pH>7B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和解析:证明是弱电解质可以从电离和所对应的盐溶液是否水解两个角度解题。
A项是所对应的溶液发生水解,可以;B项说明醋酸在水溶液中不完全电离,可以;C项是加水促进醋酸的电离,可以;D项只能证明醋酸是一元酸,不能证明其是弱酸,D 项错。
答案:D2题变式2-1.下列事实可证明NH3·H2O是弱碱的是()A.NH3·H2O能跟氯化亚铁溶液反应生成氢氧化亚铁B.铵盐受热易分解C.0.1 mol·L-1 NH3·H2O溶液可以使酚酞试液变红D.0.1 mol·L-1氯化铵溶液的pH约为5解析:证明NH3·H2O是弱电解质的原理有两个:一是证明NH3·H2O 不能完全电离,溶液中存在电离平衡;二是证明NH3·H2O与强酸反应所对应的盐溶液水解具有弱酸性。

第八章 水溶液中的离子平衡 第26讲 弱电解质的电离平衡1.下列说法不正确的是( )A .强电解质在溶液中完全电离,不存在电离平衡B .导电能力强的溶液其溶质是强电解质C .溶质为同一弱电解质的溶液,当温度不同时,其导电能力也不相同D .强电解质在液态时,有的导电,有的不导电 2.H 2S 水溶液中存在电离平衡H 2SH ++HS -和HS-H ++S 2-。
若向H 2S 溶液中( )A .加水,平衡向右移动,溶液中氢离子浓度增大B .通入过量SO 2气体,溶液pH 增大C .滴加新制氯水,溶液pH 减小D .加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 3.25 ℃时,向0.2 mol·L-1的氨水中加水稀释,则图中的y 轴可以表示( )①电离程度 ②c (NH 3·H 2O) ③c (NH +4)④c (H +) ⑤溶液的导电能力 ⑥pH ⑦c (OH -)·c (NH +4)c (NH 3·H 2O ) ⑧c (H +)·c (OH -)A .①②③⑤B .②③⑤⑥C .②③⑥⑦D .①②⑤⑥4.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。
以下是某温度下这四种酸在冰醋酸中的电离常数,从表格中数据判断以下说法中不正确的是( )A B .在冰醋酸中高氯酸是这四种酸中最强的酸C .在冰醋酸中硫酸的电离方程式为H 2SO 4===2H ++SO 2-4D .水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱5.pH =12的X 、Y 两种碱溶液各10 mL ,分别稀释至1000 mL ,其pH 与溶液体积(V )的关系如图所示,下列说法正确的是( )A .若10<a <12,则X 、Y 都是弱碱B .X 、Y 两种碱的物质的量浓度一定相等C .完全中和pH 相同的X 、Y 两溶液时,消耗同浓度盐酸的体积V (X)>V (Y)D .稀释后,X 溶液的碱性比Y 溶液的碱性强6.(2017·海淀区期末)常温下,下列有关两种溶液的说法不正确的是( )A .①②两溶液中B .①溶液的物质的量浓度为0.01 mol·L -1C .①②两溶液分别加水稀释到原体积的10倍,稀释后溶液的pH :①>②D .等体积的①、②两溶液分别与0.01 mol·L -1的盐酸完全中和,消耗盐酸的体积:①>②7.(2017·武汉市高三调研)浓度均为0.1 mol/L 、体积均为V 0的HX 、HY 溶液,分别加水稀释至体积V ,pH 随lg VV 0的变化关系如图所示。

回夺市安然阳光实验学校课时跟踪检测(三十一)弱电解质的电离平衡1.(2020·菏泽期末)在氨水中存在电离平衡:NH3·H2O NH+4+OH-。
下列情况能引起电离平衡正向移动的有( )①加水②加NaOH溶液③通入HCl ④加CH3COOH⑤加NH4Cl固体A.②③⑤B.①④⑤C.①③④ D.③④⑤解析:选C 加水稀释促进NH3·H2O的电离,电离平衡正向移动,①符合题意;加NaOH溶液,溶液中c(OH-)增大,NH3·H2O的电离平衡逆向移动,②不符合题意;通入HCl或加CH3COOH,均有H+与OH-反应生成H2O,溶液中c(OH-)减小,NH3·H2O的电离平衡正向移动,③、④符合题意;加NH4Cl固体,溶液中c(NH+4)增大,NH3·H2O的电离平衡逆向移动,⑤不符合题意。
2.(2020·上海调研)室温时,0.1 mol·L-1某一元酸HA溶液的pH=3。
关于该溶液叙述正确的是( )A.溶质的电离方程式为HA===H++A-B.升高温度,溶液的pH增大C.若加入少量NaA固体,则c(A-)降低D.该溶液稀释10倍后,pH<4解析:选D 室温时,0.1 mol·L-1某一元酸HA溶液的pH=3,则溶液中c(H+)=10-3mol·L-1,该酸为弱酸,溶质的电离方程式为HA H++A-,A错误;电离过程为吸热过程,升高温度,平衡右移,c(H+)增大,溶液的pH减小,B错误;若加入少量NaA固体,虽然平衡左移,但是移动过程微弱,c(A-)增大,C 错误;弱酸稀释10n倍时,溶液的pH变化小于n个单位,所以将该溶液稀释10倍后,pH介于3至4之间,D正确。
3.(2020·怀化质检)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( )A.氢硫酸的还原性强于亚硫酸B.氢硫酸的导电能力低于相同浓度的亚硫酸C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4和1.5D.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以解析:选A 氢硫酸的还原性强于亚硫酸,不能用于比较酸性的强弱,故A 符合题意;氢硫酸的导电能力低于相同浓度的亚硫酸,可说明亚硫酸的电离程度大,则亚硫酸的酸性强,故B不符合题意;0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4和1.5,可说明亚硫酸的电离程度大,酸性较强,故C不符合题意;氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以,符合强酸制备弱酸的特点,可说明亚硫酸的酸性比氢硫酸强,故D不符合题意。

课时29 弱电解质的电离平衡一、单项选择题1. 下列物质的水溶液能导电,但属于非电解质的是 ( )A. CH3CH2COOHB. Cl2C. NH4HCO3D. SO22. (2015·各地模拟组合)下列电离方程式的书写正确的是( )A. 在水溶液中NaHCO 3电离:NaHCO3Na++HC-3 OB. H 2CO3的电离:H2CO32H++C2-3 OC. Al(OH)3的电离:Al(OH)3Al3++3OH-D. 水溶液中的NaHSO4电离:NaHSO4Na++HS-4 O3. 稀氨水中存在着下列平衡:NH 3·H2O N4H +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是 ( )①NH4Cl固体②硫酸③NaOH固体④水⑤加热⑥加入少量MgSO4固体A. ①②③⑤B. ③⑥C. ③D. ③⑤4. 在0.1 mol·-1L CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )A. 加入水时,平衡向逆反应方向移动B. 加入少量NaOH固体,平衡向逆反应方向移动C. 加入少量0.1 mol·-1L HCl溶液,溶液中c(H+)减小D. 加入少量CH3COONa固体,平衡向逆反应方向移动5. 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图表示混合溶液有关量或性质的变化趋势,其中错误的是 ( )6. (2013·上海卷)H 2S 水溶液中存在电离平衡H 2S H ++HS -和HS -H ++S 2-。
若向H 2S 溶液中( )A. 加水,平衡向右移动,溶液中氢离子浓度增大B. 通入过量SO 2气体,平衡向左移动,溶液pH 增大C. 滴加新制氯水,平衡向左移动,溶液pH 减小D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小7. 下列能说明醋酸是弱电解质的依据是 ( ) A. 醋酸溶液能使石蕊试液变红B. 常温下0.1 mol ·L -1的醋酸溶液其pH 约为3 C. 用醋酸溶液做导电性实验时,灯泡暗D. 体积相同,pH 相同的盐酸和醋酸溶液,在用氢氧化钠中和时两者消耗氢氧化钠的物质的量一样多8. 向0.1 mol ·L -1氨水中逐渐加入一定量的水,始终保持增大趋势的是 ( )A. c (NH 3·H 2O)B. c (N4H +) C. c (OH -)D.432(NH )(NH H )n c O +⋅二、 非选择题9. 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。
回夺市安然阳光实验学校第八章第一节弱电解质的电离水的电离一、选择题(本题包括10小题,每小题5分,共50分)1.下列说法中不.正确的是( )①将BaSO4放入水中不能导电,所以BaSO4是非电解质②氨溶于水得到的溶液氨水能导电,所以氨水是电解质③固态共价化合物不导电,熔融态的共价化合物可以导电④固态的离子化合物不导电,熔融态的离子化合物也不导电⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强A.①④B.①④⑤C.①②③④ D.①②③④⑤解析:BaSO4属于难溶性电解质,溶解的部分完全电离.NH3·H2O是电解质,氨水是电解质溶液,熔融的共价化合物分子中没有离子不可以导电,熔融态的离子化合物存在自由移动离子能导电.相同条件下强电解质的导电能力一定比弱电解质的导电能力强.答案:D2.在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )A.加入水时,平衡逆向移动B.加入少量NaOH固体,平衡正向移动C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)减小D.加入少量CH3COONa固体,平衡正向移动解析:CH3COOH是弱酸,当加水稀释时,CH3COOH的电离程度增大,平衡正向移动;加入少量NaOH固体,中和H+,使c(H+)减小,平衡正向移动;加入少量0.1 mol/L HCl溶液,由于HCl是强电解质,故溶液中c(H+)增大;虽然CH3COONa水解显碱性,但由于CH3COO-离子浓度增大,平衡将逆向移动.答案:B3.水的电离过程为H2O H++OH-,在25℃时水的离子积为K W=1.0×10-14,在35℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )A.c(H+)随着温度的升高而降低B.35℃时c(H+)>c(OH-)C.35℃时的水比25℃时的水电离程度小D.水的电离是个吸热过程解析:35℃时水的离子积大于25℃时水的离子积,说明35℃时水中c(H+)、c(OH-)大于25℃时水中c(H+)、c(OH-),但c(H+)仍等于c(OH-);亦说明升高温度,水的电离程度增大,即水的电离是吸热过程.答案:D4.用水稀释0.1 mol/L氨水时,溶液中随水量的增加而减小的是( )A.c(OH-)/c(NH3·H2O)B.c(NH3·H2O)/c(OH-)C.c(H+)和c(OH-)的乘积D.n(OH-)解析:加水促进NH3·H2O的电离,使n(NH3·H2O)减小,n(OH-)增大,因此c(NH3·H2O)/c(OH-)=n(NH3·H2O)/n(OH-)减小.答案:B5.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )A.相同浓度的两溶液中c(H+)相同B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠C.pH=3的两溶液稀释100倍,pH都为5D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小解析:A项盐酸和醋酸浓度相同时,因两者电离能力不同,c(H+)盐酸>c(H+)醋酸;B项两者均为一元酸,在同体积、同浓度时,其中和氢氧化钠的能力相同;C项稀释后,盐酸的pH=5,而醋酸继续电离出H+,其pH<5;D 项盐酸中c(H+)几乎不变.答案:B6.室温下,某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定不.能大量存在的是( )A.Cl-B.HCO-3C.Na+ D.NO-3解析:由水电离的H+、OH-的浓度相等,所以c(H+)水=c(OH-)水=1×10-26 mol/L=1×10-13mol/L,此溶液可能是pH=1的酸溶液,也可能是pH=13的碱溶液,所以HCO-3一定不能大量存在.答案:B7.相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )A.弱酸溶液产生较多的氢气B.强酸溶液产生较多的氢气C.两者产生等量的氢气D.无法比较两者产生氢气的量解析:本题考查强电解质和弱电解质的性质.pH=3的强酸完全电离c(H+)=10-3mol/L,随着反应的进行,c(H+)不断减小;而pH=3的弱酸,开始时c(H+)也是10-3 mol/L,但由于弱酸是部分电离,随着反应的进行,弱酸不断电离出H+来补充消耗的H+.也就是说,上述条件下,弱酸含可电离的H+比强酸多,故与足量镁完全反应放出氢气较多的应该是弱酸.答案:A8.25℃时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol/L和B mol/L,则A与B的关系为( )A.A>B B.A=10-4BC.B=10-4A D.A=B解析:25℃,纯水中,水电离出极c(H+)=c(OH-)=1×10-7mol/L,当向纯水中加入酸或碱时,增大了溶液中H+的浓度或OH-的浓度,水的电离程度减小,水自身电离出的c(H+)和c(OH-)必然减小.当向纯水中另加入能水解的盐时,由于盐能促进水的电离,水电离出的c(H+)和c(OH-)必然增大.在pH=9的NaOH溶液中,c(H+)溶液=c(H+)水=10-9 mol/L,而c(H+)水=c(OH-)水=1×10-9mol/L.在pH=9的CH3COONa溶液中,c(OH-)溶液=c(OH-)水=K Wc H +=10-1410-9mol/L=10-5 mol/L,A=10-4B.答案:B9.下列实验事实不.能证明醋酸是弱酸的是( )A.常温下,测得醋酸钠溶液的pH>7B.常温下,测得0.1 mol/L醋酸溶液的pH=4C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和解析:常温下CH3COONa溶液的pH>7,说明CH3COO-水解显碱性,CH3COOH 为弱酸.若为强酸,常温下0.1 mol/L的一元酸pH=1,醋酸溶液的pH=4,说明醋酸未电离完全,是弱酸.醋酸在稀释过程中可以继续电离,则pH=1的醋酸稀释1000倍,pH<4.答案:D10.(2008·广东高考)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )解析:HCl为强电解质,CH3COOH为弱电解质,滴加的NH3·H2O弱电解质先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液中离子浓度减小,所以电导率开始下降;当HCl被中和完后,加入的NH3·H2O 溶液继续与CH3COOH弱电解质反应,生成强电解质CH3COONH4,所以电导率逐渐增大;HCl与CH3COOH均反应完后,继续滴加NH3·H2O溶液,溶液中离子浓度变化不大,因此溶液电导率变化不大.答案:D二、非选择题(本题包括4小题,共50分)11.(11分)现有25℃时0.1 mol/L的氨水.请回答以下问题:(1)若向氨水中加入少量硫酸铵固体,此时溶液中c OH -c NH3·H2O________(填“增大”“减小”或“不变”).(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________________________;所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因____________________________________________________________ ______.(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH+4)=a mol/L,则c(SO2-4)=________________.解析:(1)加入NH+4会抑制NH3·H2O的电离,使c(NH3·H2O)变大,c(OH -)变小.(2)NH+4水解显酸性.(3)根据电荷守恒c(NH+4)+c(H+)=2c(SO2-4)+c(OH-),c(H+)=c(OH-)得:c(NH+4)=2c(SO2-4).答案:(1)减小(2)NH3·H2O+H+===NH+4+H2O<NH+4+H2O NH3·H2O+H +(3)a/2 mol/L12.(15分)为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol/L氨水、0.1 mol/L NH4Cl 溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水.(1)甲用pH试纸测出0.010 mol/L氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”),并说明理由____________________________________________________________ ________________________________________________________________________ __________.(2)乙取出10 mL 0.010 mol/L氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL ,再用pH试纸测出其pH为b,若要确认NH3·H2O 是弱电解质,则a、b值应满足的关系______________________.(用等式或不等式表示).(3)丙取出10 mL、0.010 mol/L氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变_______________________________________________(填“深”或“浅”).你认为这一方法能否证明NH3·H2O是弱电解质?并说明原因:_______________________________________________________________ ______________________________________________________________________________________________________________________________________________ ___________.(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:_______________________________________________________________ ______________________________________________________________________ ________________________________________________________________________ ___________.解析:(1)0.010 mol/L氨水的pH为10,则其c(OH-)为10-4mol/L,说明NH3·H2O部分电离,是弱电解质,若是强电解质,pH应为12.(2)若NH3·H2O是弱电解质,则存在电离平衡,稀释pH=a的氨水102倍,则其pH变化小于2.(3)向滴有酚酞的氨水中加NH4Cl晶体,使溶液颜色变浅,有两种可能,一是NH4Cl在水溶液中水解显酸性,使溶液pH降低;二是NH4Cl电离出的NH+4影响NH3·H2O的电离平衡使之左移,溶液pH降低.两者都证明NH3·H2O 是弱电解质.(4)可利用NH+4的水解来证明,即强酸的铵盐显酸性,也可以测相同条件下,NH3·H2O溶液和NaOH溶液的导电性来证明,设计两方案中的一个即可.答案:(1)是若是强电解质,则0.010 mol/L氨水溶液中c(OH-)应为0.010 mol/L,pH=12(2)a-2<b<a(3)浅能,因为0.010 mol/L氨水(滴有酚酞)中加入氯化铵晶体后颜色变浅,有两种可能:一是氯化铵在水溶液中水解显酸性,加入氨水中使溶液的pH降低;二是NH+4使NH3·H2O的电离平衡NH3·H2O NH+4+OH-逆向移动,从而使溶液的pH降低.两种可能均证明了NH3·H2O是弱电解质(4)取一张pH试纸,再用玻璃棒蘸取0.1 mol/L NH4Cl溶液,滴在pH试纸上,显色后跟比色卡比较测出pH,pH<7(方案合理即可)13.(13分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,请回答:(1)“O”点导电能力为0的理由是__________________________________________________________________________________________________ __________.(2)a、b、c三点溶液中c(H+)由小到大的顺序为_______________________________.(3)a、b、c三点中醋酸电离程度最大的是________.(4)若使c点溶液中c(CH3COO-)增大,溶液c(H+)减小,可采取的措施是:①__________________________________________________________ _________;②__________________________________________________________ ___________;③__________________________________________________________ __________.解析:(1)冰醋酸中没有水,不发生电离,不存在自由移动的离子,导电能力为0.(2)溶液导电能力的变化主要是c(H+)、c(CH3COO-)的变化,由图可知,c(H+)由小到大的顺序是c<a<b.(3)在加水稀释过程中,CH3COOH的电离程度不断增大.(4)可以加CH3COO-,使平衡逆方向移动,或加OH-(或Zn、Fe)消耗H+,促进CH3COOH的电离.答案:(1)冰醋酸中无水,不发生电离,不存在自由移动的离子(2)c<a<b (3)c (4)①加CH3COONa晶体②加NaOH晶体③加Zn粉等14.(11分)(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH 3NH+4+NH-2据此判断以下叙述中错误的是________.A.液氨中含有NH3、NH+4、NH-2等粒子B.一定温度下液氨中c(NH+4)·c(NH-2)是一个常数C.液氨的电离达到平衡时c(NH3)=c(NH+4)=c(NH-2)D.只要不加入其他物质,液氨中c(NH+4)=c(NH-2)(2)完成下列反应的化学方程式或离子方程式:①在液氨中投入一小块金属钠,放出气体:________________________________________________________________________________________ _______.②NaNH2溶于水:________________________________________________.③类似于“H++OH-===H2O”的反应:________________________________________________________________________________________ ________.解析:把握水电离的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并迁移到液NH3的电离及电离平衡的建立.NH3分子电离产生H+和NH-2,H+与NH3结合生成NH+4,液氨电离产生等量的NH-2与NH+4,一定温度下离子浓度乘积为一常数:NH+4类似于H+,NH-2类似于OH-,具备上述知识后,即可顺利完成本题.答案:(1)C (2)①2Na+2NH3===H2↑+2NaNH2②NaNH2+H2O===NaOH+NH3↑或NH-2+H2O===OH-+NH3↑③NH-2+NH+4===2NH3↑或NH4Cl+NaNH2===2NH3↑+NaCl。
弱电解质的电离平衡1.下列关于电解质的叙述正确的是( )A.电解质溶液的浓度越大,其导电性能肯定越强B.强酸和强碱肯定是强电解质,不管其水溶液浓度的大小,都能完全电离C.强极性共价化合物不肯定都是强电解质D.多元酸、多元碱的导电性肯定比一元酸、一元碱的导电性强解析:C项,HF是强极性共价化合物,但是弱电解质。
答案:C2.常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示。
下列说法正确的是( )A.HA为强酸B.该混合溶液pH=7.0C.该混合溶液中:c(A-)+c(Y)=c(Na+)D.图中X表示HA,Y表示OH-,Z表示H+解析:若HA为强酸,按题意两溶液混合后,所得溶液中c(A-)=0.1 mol·L-1。
由图知A-浓度小于0.1 mol·L-1,表明A-发生水解。
依据水解原理,溶液中主要微粒的浓度大小关系应为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),可以推断X表示OH-,Y表示HA,Z表示H+。
则A、B、D项错误,C项满意物料守恒,正确。
答案:C3.常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )A.加入水时,平衡向右移动,CH3COOH电离常数增大B.加入少量CH3COONa固体,平衡向右移动C.加入少量NaOH固体,平衡向右移动,c(H+)削减D.加入少量pH=5的硫酸,溶液中c(H+)增大解析:加水稀释,使醋酸的电离平衡向右移动,但CH3COOH电离常数不变,A项错误;加入少量CH3COONa固体,c(CH3COO-)增大,使醋酸的电离平衡向左移动,B项错误;加入的少量NaOH固体与H+中和,c(H+)减小,使醋酸的电离平衡向右移动,C项正确;加入少量pH=5的硫酸,溶液中c(H+)不变,D项错误。
课时跟踪检测(二十四) 弱电解质的电离平衡和水的电离1.下列说法正确的是( )A.将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半B.如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍C.强电解质溶液的导电能力一定比弱电解质溶液强D.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需NaOH和醋酸所需NaOH 相等2.下列有关溶液的说法正确的是( )A.向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,混合液的pH=7 B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3C.NH4Cl溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH-)D.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶3.对室温下100 mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )A.加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4B.温度都升高20℃后,两溶液的pH不再相等C.加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小D.加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示4.25℃时,水的电离达到平衡:H2++OH-,下列叙述正确的是( )A.将纯水加热到95℃时,K W变大,pH不变,水仍呈中性B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,K W变小C.向纯水中加入少量碳酸钠固体,c(H+)减小,K W不变,影响水的电离平衡D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,K W不变5.某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。
据图判断错误的是( )A.a的数值一定大于9B.Ⅱ为氨水稀释时溶液的pH变化曲线C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大D.完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)6.最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。
下列关于水的说法中正确的是( )A.水的电离过程是放热的过程B.水的电离和电解都需要电C.冰熔化成水是一个吸热的过程D.加入电解质一定会破坏水的电离平衡7.有关水的电离平衡的说法正确的是( )A.水的离子积通常用K W来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离C. 盐溶于水对水的电离平衡没有影响D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响8.下列各组数据关系,前者比后者大的是( )A.纯水100 ℃和50 ℃时的pHB.0.1 mol·L-1的盐酸与0.1 mol·L-1的醋酸的pHC.100 mL 0.1 mol·L-1的CH3COOH溶液与10 mL 0.1 mol·L-1的CH3COOH溶液中的H +数目D.0.1 mol·L-1的氨水中NH+4浓度与OH-浓度9.科学实验证明通常状态下并不存在NaAlO2,Al(OH)3溶于强碱溶液形成的阴离子实际是因为Al(OH)3分子中的铝原子最外层电子数未达到饱和,能与OH-离子形成配位键,结合生成[Al(OH)4]-,因此1 mol Al(OH)3与碱反应时只能中和1 mol OH-,表现为一元酸。
(1)据此请写出Al(OH)3的两性电离的方程式_______________________________________________________________________________________________________________。
(2)硼与铝是同族元素,试推测H3BO3是________元酸,酸性是________(强或弱)酸;并写出其电离的方程式_____________________________________________________________ ___________________________________________________________________________ 10.水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH =7,则Ba(OH)2与盐酸的体积比为________。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g ,其饱和溶液密度设为 1 g/mL ,Ca(OH)2的离子积为________。
(4))25℃时,在等体积的 ①pH=0的H 2SO 4溶液、②0.05 mol/L 的Ba(OH)2溶液,③pH =10的Na 2S 溶液,④pH=5的NH 4NO 3溶液中,发生电离的水的物质的量之比是________11.(2014·郑州模拟)电离平衡常数(用K a 表示)的大小可以判断电解质的相对强弱。
25℃时,有关物质的电离平衡常数如下表所示: 化学式HF H 2CO 3 HClO 电离平衡常数(K a )7.2×10-4 K 1=4.4×10-7 K 2=4.7×10-11 3.0×10-8(1)已知25℃时,①HF(aq)+OH -(aq)===F -(aq)+H 2O(l) ΔH =-67.7 kJ/mol ,②H+(aq)+OH -(aq)===H 2O(l) ΔH=-57.3 kJ/mol ,氢氟酸的电离方程式及热效应可表示为________________________________________________________________________。
(2)将浓度为0.1 mol/L HF 溶液加水稀释一倍(假设温度不变),下列各量增大的是________。
A .c (H +)B .c (H +)·c (OH -) C.c +c D.c -c +(3)25℃时,在20 mL 0.1 mol/L 氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH 变化曲线如图所示,下列说法正确的是________。
A .pH =3的HF 溶液和pH =11的NaF 溶液中,由水电离出的c (H +)相等B .①点时pH =6,此时溶液中,c (F -)-c (Na +)=9.9×10-7 mol/LC .②点时,溶液中的c (F -)=c (Na +)D .③点时V =20 mL ,此时溶液中c (F -)<c (Na +)=0.1 mol/L12.与纯水的电离相似,液氨中也存在着微弱的电离:2NH 3+4+NH -2 据此判断以下叙述中错误的是( )A .液氨中含有NH 3、NH +4、NH -2等微粒B .一定温度下液氨中c (NH +4)·c (NH -2)是一个常数C.液氨的电离达到平衡时c(NH3)=c(NH+4)=c(NH-2)D.只要不加入其他物质,液氨中c(NH+4)=c(NH-2)13.(2014·南昌中学)已知25℃时弱电解质电离平衡常数:K a(CH3COOH)=1.8×10-5,K a(HSCN)=0.13(1)将20 mL、0.10 mol/L CH3COOH溶液和20 mL、0.10 mol/L的HSCN溶液分别与0.10 mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。
反应开始时,两种溶液产生CO2的速率明显不同的原因是________________________________________________________________________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或“<”)。
(2)2.0×10-3 mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如下图。
则25℃时,HF电离平衡常数为:K a(HF)=______________________________________ (列式求值)。
答案1.D 2.B 3.B4.选C 水的电离吸热,将纯水加热,电离平衡正向移动,c(H+)、c(OH-)均增大但仍相等,因此K W变大,pH变小,水仍呈中性,A错;向纯水中加入稀氨水,溶液中c(OH-)增大,电离平衡逆向移动,但K W只与温度有关,因此保持不变,B错;向纯水中加入少量Na2CO3固体,溶液中c(H+)减小,水的电离平衡正向移动,但K W不变,C对;当向纯水中加入醋酸钠时,促进水的电离,D错。
5.选C pH=11的氨水和NaOH溶液分别加水稀释100倍,氨水稀释过程中电离程度增大,因此氨水的pH改变比NaOH溶液的pH改变小,故I为NaOH溶液的pH变化曲线,Ⅱ为氨水的pH变化曲线,B正确;pH=11的NaOH溶液稀释100倍后溶液的pH=9,故a>9,A 正确;稀释后氨水电离出的c(OH-)大于NaOH电离出的c(OH-),因此氨水中水的电离程度小于NaOH溶液中水的电离程度,C错误;pH=11的氨水和NaOH溶液,NH3·H2O的物质的量浓度大于NaOH的物质的量浓度,因此中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水),D正确。
6.选C 电离是吸热的,A不正确。
电离不需要通电,B不正确。
熔化需要吸热,C正确。
水能电离出氢离子和OH-,所以酸或碱能抑制水的电离,盐类的水解能促进水的电离,但并不是所有的电解质都能破坏水的电离平衡,例如:氯化钠等,D不正确。
7.D8.选C A选项中温度升高促进水电离,使得c(H+)100℃>c(H+)50℃,pH100℃<pH50℃。
B选项中HCl是强电解质,CH3COOH是弱电解质,前者pH小于后者。
C选项中物质的量浓度相同的醋酸,体积大者H+的数目多,所以C选项正确。
D选项中发生NH3·H2+4+OH-,同时又有H2++OH-,可以看出OH-有两个来源,所以c(OH-)>c(NH+4)。
9.(1) 碱式电离:Al(OH)33++3OH-酸式电离: Al(OH)3+H24]-+H+(2)一元弱B(OH)3+H24]-+H+10.(1)10-1410-12(2)2∶9(3)0.004(4)1∶10∶1010∶10911.解析: (1)利用盖斯定律将①-②可得,-(aq)+H+(aq) ΔH=-10.4 kJ·mol-1;(2)将浓度为0.1 mol/L HF溶液加水稀释一倍,c(H+)减小,根据水的离子积常数,c(OH-)增大,D选项正确。