核外电子排布
- 格式:ppt
- 大小:489.54 KB
- 文档页数:24

【21】以第1、2、3周期的元素为例,了解原子核外电子排布规律。
1.核外电子排布的一般规律。
(1)各电子层最多容纳的电子数目为2n2。
(2)最外层不超过8个电子(K层例外)。
(3)次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
核外电子排布规律的依据:(1)核外电子运动的特点①电子的质量很小,运动空间很小,但电子的运动速度很快,接近于光速。
②在高速的运动时,不能找到运动轨迹,不能准确地测量和计算出电子的确切位置。
(2)核外电子总是尽先排布在能量最低电子层里,然后由里到外,依次排布在能量逐步升高的电子层里。
总之,是核外电子运动的客观事实。
2.元素的性质与元素的原子核外电子排布的关系。
(1)稀有气体的不活泼性。
稀有气体元素的原子最外层有8个电子(氦是2个)处于稳定结构,因此化学性质稳定,一般不跟其它物质发生化学反应。
(2)非金属性与金属性(一般规律)最外层电子数得失电子趋势元素的性质金属元素4易得非金属性3.第1、2、3周期的元素(短周期元素)微粒结构特点(1)稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同(所谓电子层结构相同是指:电子层数相同;电子总数相同;各层电子数相同)。
①与He核外电子排布相同的离子有:H-、Li、Be2②与Ne电子层结构相同的离子有:F-、O2-、N3-、Na、Mg2、A3③与Ar原子电子层结构相同的离子有:C-、S2-、和Y n-的核外电子排布相同,则下列关系式中正确的是()A a=b+m+nB a=b-m+nC a=b+m-nD a=b-m-n【解析】由元素X、Y的核电荷数分别是a和b,离子X m和Y n-的核外电子排布相同,可得:a-m=b+n,即a=b+m+n。
【答案】A【点评】离子X m和Y n-可表示为:a X m和b Y n-。
a X m意为a X原子失去m个电子形成的阳离子,所以a X m的电子数为a-m;b Y n-意为b Y原子得到n个电子形成的阴离子,所以b Y n-的电子数为b+n。

核外电子排布式
核外电子排布式,也称电子构型,是描述一个原子中每个电子的分布位置和能级的一种方式。
在化学中,它是预测元素化学性质和反应的重要工具。
电子构型可以使用不同的方法来表示。
以下是两种最常见的方法:
1. 填充原理
填充原理基于保护壳层和最高占据能级原理,从原子核外层(能量最低的电子壳层)的1s电子开始,依次填充每一层的能级,直到所有的电子都填满。
例如,氧的电子构型为:1s²2s²2p⁴。
这意味着氧原子有8个电子,其中2个在1s能级,2个在2s能级,4个在2p能级。
2. 带点数的能级表示法
在这种表示法中,电子分布在各个能级上,每个能级代表一个水平或子能量。
每个具有特定能量的能级用数字和字母表示,如1s、2p、3d等。
每个能级可容纳不同数量的电子,最多容纳的电子数由能级的带点数决定。
例如,氧的电子构型为:1s²2s²2p⁴。
这可以表示为2-6。
2代表氧原子的第二能级,6代表从1s开始的总电子数。
电子构型与元素的原子序数有关,因此可以预测元素的化学性质和反应。
例如,元素的电子结构可以告诉我们它对电子轻松丢失或获得的可能性,这是一个元素是否会发生化学反应的关键因素。
总之,核外电子排布式是描述原子中电子分布位置和能级的一种方式,它对化学性质和反应的预测非常重要。
填充原理和带点数的能级表示法是最常用的表示方式。


核外电子的排布规律多
电子原子核外电子的排布应遵循以下三个原理:①能量最低原理,核外电子总是首先占据能量最低的轨道,按照近似能级图,电子由低到高进入轨道的顺序为
1s2s2p3s3p4s3d4p5s4d5p……。
因能级交错,其中E4s<E3d……,电子先排满4s后再进入3d,例如钪元素核外21个电子依次填充的轨道为1s22s22p63s23p64s23d1。
②保里不相容原理,在同一原子中没有运动状态完全相同的电子,即同一个原子中的电子,描述其运动状态的四个方面不可能完全相同,在同一轨道上的电子必须自旋方向相反,每个轨道只能容纳2个电子。
根据保里不相容原理,各电子层最多容纳的电子总数为2n2;周期表中各周期含有元素的数目以及填充的能级如下:
③洪特规则,电子进入同一亚层的各个轨道(也称等价轨道)时,总是尽先分占不同轨道,而且自旋方向相同,例如氮原子核外电子排布的轨道表示式为:N原子的价电子中有3个未成对电子,这与N原子的成键情况和化合物的组成、结构有密切的关系。
洪特还指出,等价轨道上的电子排布处于以下状态比较稳定。
例如铬原子的电子排布式是ls22s22p63s23p63d54s1,而不是ls22s22p63s23p63d44s2。

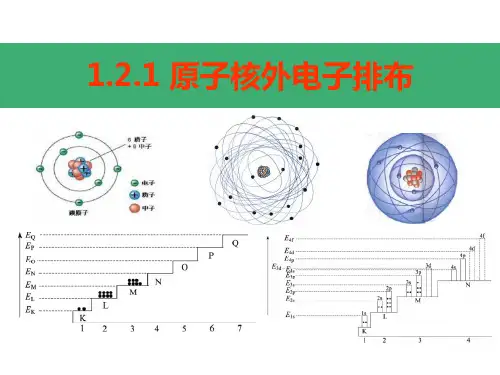


原子核外电子排布
⑴电子层——能量高低不同的区域,并非真实存在
⑵核外电子的分层排布:
通常用电子层形象地表示电子离核远近的不同,离核越近,电子能量越低;离核越远,电子能量越高。
⑶核外电子排布的规律:
第一层最多容纳2个电子;第二层最多容纳8个电子;最外层电子数不超过8个。
注意点:核外电子排布是由内到外排,尽量排在能量较低的电子层里,即排满第一层才轮到第二层,以此类推。
⑷原子结构与性质的关系:(依照元素周期表)
①每一横行,核电荷数即质子数依次增加,电子层数相同,每一横行的开头是金属原子(H 除外),靠近结尾是非金属原子,结尾是稀有气体原子;
②每一纵列,电子层数依次增加,最外层电子数相同;
③最外层电子数与原子性质的关系:
A 金属原子——最外层电子一般< 4个(H、He除外);~易失电子
B 非金属原子——最外层电子一般≥4个;~易得电子
C 稀有气体原子——一般为8个(He是2个)~不易得失电子
原子的化学性质主要取决于原子最外层电子数。
原子最外层电子数是相对稳定结构的,该原子的性质就稳定。
1。

核外电子的排布规律之一首先,各电子层最多容纳的电子数目是2n2。
其次,最外层电子数目不超过8个(K层为最外层时不超过2个)。
第三,次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
核外电子总是尽先排布在能量最低的电子层里,然后再由里往外依次排布在能量逐步升高的电子层里。
以上几点是互相联系的,不能孤立地理解。
核外电子的排布规律之二核外电子排布遵循泡利不相容原理、能量最低原理和洪特规则。
能量最低原理就是在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道。
也就是尽可能使体系能量最低。
洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
后来量子力学证明,电子这样排布可使能量最低,所以洪特规则可以包括在能量最低原理中,作为能量最低原理的一个补充。
在同一个原子中,离核越近、n越小的电子层能量越低。
在同一电子层中,各亚层的能量按s、p、d、f的次序增高的。
因此,E1s<E2s<E3s……;E4s<E4p <E4d……。
在多电子的原子里的各个电子之间存在相互作用,研究某个外层电子的运动状态时,必须同时考虑到核及其它电子对它的作用。
由于其它电子的存在,往往减弱了原子核对外层电子的作用力,从而使多电子原子的电子能级产生交错现象核外电子的排布规律之三(1)泡利不相容原理泡利不相容原理是奥地利物理学家泡利提出来的。
他指出,在同一个原子中,不可能有运动状态完全相同的两个电子存在。
或者说,运动状态完全相同的电子在同一原子里是不能并存的、是互不相容的。
如果同一原子中的电子前三种运动状态完全一样,那么处于同一轨道上的电子其第四种运动状态——自旋方向必然不同。
由此,可以推论:同一原子中每一个轨道上只能容纳两个自旋方向相反的电子。
根据泡利不相容原理可推算出各个电子层可能容纳的电子数为2n2个。

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布一样,如钠离子、镁离子、铝离子和氖的核外电子排布是一样的。
阴离子更同一周期稀有气体的电子排布一样:负氧离子,氟离子和氖的核外电子排布是一样的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N-3、NH-2、NH3、NH+4、O-2、OH-、H2O、H3O+、F-、HF、Ne、Na+、Mg+2、Al+3等。
②18电子粒子:SiH4、P-3、PH3、S-2、HS-、H2S、Cl-、HCl、Ar、K+、Ca+2、PH+4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数与质子总数均一样的阳离子有:Na+、NH+4、H3O+等;阴离子有:F-、OH-、NH-2; HS-、Cl-等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、 Li、Na;最外层有2个电子的元素:Be、Mg、He(3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
简述核外电子排布规则
核外电子排布所遵循的三个规则是:能量最低原理、泡利不相容原理和洪特规则。
1、最低能量原理:
电子可看作是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。
当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有要回到基态的趋势。
2、泡利不相容原理:
在同一个原子中没有也不可能有运动状态完全相同的两个电子存在。
3、洪特规则:
有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于∶全满(s2、p6、d10、f14)半满(s1、p3、d5、f7)。
扩展资料:
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这
24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层。
每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。
最外层电子到底怎样排布,还要参考洪特规则,24号元素铬的24个核外电子依次排列为:1s(2)2s(2)2p(6)3s(2)3p(6)4s(2)3d(4)。
核外电子的排布规律一、能量最低原理所谓能量最低原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:1•当n相同,l不同时,轨道的能量次序为sVpVdVf。
例如,EVEVE。
3S3P3d 2•当n不同,l相同时,n愈大,各相应的轨道能量愈高。
例如,EVEVEo2S3S4S3.当n和l都不相同时,轨道能量有交错现象。
即(n—1)d轨道能量大于ns轨道的能量,(n-1)f 轨道的能量大于np轨道的能量。
在同一周期中,各元素随着原子序数递增核外电子的填充次序为ns,(n—2)f,(n—1)d,np。
核外电子填充次序如图1所示。
图1电子填充的次序□3S□2iI.L6d1.L J4di i!i 4P 3d2P□图2多电子原子电子所处的能级示意图最外层最多能容纳8电子,次外层最多能容纳18电子。
每个电子层最多容纳的电子数为2m个(n为电子层数的数值)如:各个电子层中电子的最大容纳量电子层(n) K(1) L⑵M(3) N(4)电子亚层s s P s P d s P d f亚层中的轨道数1 1 3 1 3 5 1 3 5 7亚层中的电子数2 2 6 2 6 10 2 6 10 14K 最多能容:(2逖:MN0P18.315011-(2迸码(苏®4$(2豁弓(2毬沖弓从表可以看出,每个电子层可能有的最多轨道数为m,而每个轨道又只能容纳2个电子,因此,各电子层可能容纳的电子总数就是2m。
、鲍利(Pauli)不相容原理鲍利不相容原理的内容是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。
例如,氦原子的Is轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,—1/2,即两个电子的其他状态相同但自旋方向相反。