原子核外电子的排布
- 格式:ppt
- 大小:975.00 KB
- 文档页数:48

原子核外电子排布1、核外电子的运动特征:(1)质量很小,带负电荷(2)运动速度高(接近光速)(3)运动空间范围很小(相对于宏观物体而言)结论:不遵循宏观物质的运动特征.2、电子云:电子云是电子在原子核外空间概率密度分布的形象描述,电子在原子核外空间的某区域内出现,好像带负电荷的云笼罩在原子核的周围,人们形象地称它为”电子云”.在这个模型里,某个点附近的密度表示电子在该处出现的机会的大小.密度大的地方,表明电子在核外空间单位体积内出现的机会多;反之,则表明电子出现的机会少.s轨道p轨道d轨道3、原子核外电子排布原则:1)泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对.2)能量最低原理:电子尽可能占据能量最低的轨道.3)Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子.另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的:全充满﹣﹣﹣p6或d10或f14半充满﹣﹣﹣﹣p3或d5或f7全空﹣﹣﹣﹣﹣p0或d0或f04、核外电子能级分布(构造原理):5、核外电子排布表示方法:表示方法举例原子结构示意图电子排布式S :1s 22s 22p 63s 23p 4简化电子排布式[Ne]3s 23p 4轨道表示式(或电子排布图)价电子排布式(最外层电子排布式)3s 23p 41)重要概念:①价电子排布式:主族元素的价层电子指最外层电子,价电子排布式即外围电子排布式.例如:Al :3s 23p 1②简化排布式:电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示,以简化电子排布式.以稀有气体的元素符号加方括号的部分称为“原子实”.如碳、氧、钠、钙原子的电子排布式分别是1s 22s 22p 2、1s 22s 22p 4、1s 22s 22p 63s 1、1s 22s 22p 63s 23p 64s 2,其简化的电子排布式可以分别表示为[He]2s 22p 2、[He]2s 22p 4、[Ne]3s 1、[Ar]4s 2.2)1~36号排布式[1]H 氢1s 1[2]He 氦1s 2[3]Li 锂1s 22s 1[4]Be 铍1s 22s 2[5]B硼1s22s22p1[6]C碳1s22s22p2[7]N氮1s22s22p3[8]O氧1s22s22p4[9]F氟1s22s22p5[10]Ne氖1s22s22p6[11]Na钠1s22s22p63s1[12]Mg镁1s22s22p63s2[13]Al铝1s22s22p63s23p1[14]Si硅1s22s22p63s23p2[15]P磷1s22s22p63s23p3[16]S硫1s22s22p63s23p4[17]Cl氯1s22s22p63s23p5[18]Ar氩1s22s22p63s23p6[19]K钾1s22s22p63s23p64s1[20]Ca钙1s22s22p63s23p64s2[21]Sc钪1s22s22p63s23p63d14s2[22]Ti钛1s22s22p63s23p63d24s2[23]V钒1s22s22p63s23p63d34s2[24]Cr铬1s22s22p63s23p63d54s1[25]Mn锰1s22s22p63s23p63d54s2[26]Fe铁1s22s22p63s23p63d64s2[27]Co钴1s22s22p63s23p63d74s2[28]Ni镍1s22s22p63s23p63d84s2[29]Cu铜1s22s22p63s23p63d104s1[30]Zn锌1s22s22p63s23p63d104s2[31]Ga镓1s22s22p63s23p63d104s24p1[32]Ge锗1s22s22p63s23p63d104s24p2[33]As砷1s22s22p63s23p63d104s24p3[34]Se硒1s22s22p63s23p63d104s24p4[35]Br溴1s22s22p63s23p63d104s24p5[36]Kr氪1s22s22p63s23p63d104s24p63)轨道式(前18号):【命题方向】本考点主要考察原子核外电子的排布式和轨道式,需要重点掌握.题型一:核外电子能量特点的考察典例1:在基态多电子原子中,关于核外电子能量的叙述错误的是()A.最易失去的电子能量最高B.电离能最小的电子能量最高C.p轨道电子能量一定高于s轨道电子能量D.在离核最近区域内运动的电子能量最低分析:A.根据原子核外电子能量与距核远近的关系判断;B.根据电离能的定义判断;C.没有指明p轨道电子和s轨道电子是否处于同一电子层;D.根据电子首先进入能量最低、离核最近的轨道判断.解答:A.能量越高的电子在离核越远的区域内运动,也就越容易失去,故A正确;B.电离能是失去电子时所要吸收的能量,能量越高的电子在失去时消耗的能量也就越少,因而电离能也就越低,故B正确;C.同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高,故C错误;D.电子首先进入能量最低、离核最近的轨道,故D正确.故选C.点评:本题考查原子核外电子排布规律,题目难度不大,本题注意原子核外电子的排布和运动特点.题型一:电子排布原则的考察典例1:基态碳原子的最外能层的各能级中,电子排布的方式正确的是()A .B .C .D .分析:原子核外电子排布,应满足能量最低原理,洪特规则以及泡利不相容原理,以此进行判断.解答:A.2p 能层有3个电子,应在3个不同的轨道,不符合洪特规则,故A 错误;B.2p 能层有2个电子,应在2个不同的轨道,不符合洪特规则,故B 错误;C.2p 能层有2个电子,在2个不同的轨道,符合洪特规则,故C 正确;D.2s 轨道应有2个电子,2p 轨道有2个电子,不符合能量最低最低原理,故D 错误.故选C .点评:本题考查原子核外电子排布原则,题目难度不大,本题注意把握核外电子的排布规律即可解答该题.典例3:基态原子的4s 能级中只有1个电子的元素共有()A .1种B .A .2种C .A .3种D .A .8种分析:根据该元素最外层仅有的一个电子位于4s 能级解题.解答:该元素最外层仅有的一个电子位于4s 能级,即4s 1.该原子4s 能级未填充满,情况之一是按照能级顺序正常填充的结果,1s 22s 22p 63s 23p 64s 1,此为19K 元素;情况之二是按照洪特规则的特例填充的结果,1s 22s 22p 63s 23p 63d 54s 1,1s 22s 22p 63s 23p 63d 104s 1,此为24Cr 和29Cu .故选C .点评:本题考查原子核外电子排布,题目难度不大,注意根据洪特规则解题.题型三:排布式的考察典例3:下列基态原子与离子的电子排布式错误的是()A .K :1s 22s 22p 63s 23p 64s 1B .F ﹣:1s 22s 22p 6C .Fe :1s 22s 22p 63s 23p 63d 54s 2D .Kr :1s 22s 22p 63s 23p 63d 104s 24p 6分析:原子核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理,结合原子或离子的核外电子数解答该题.解答:题中K、F﹣和Kr的核外电子排布都符合构造原理,为能量最低状态,而Fe的核外电子排布应为1s22s22p63s23p63d64s2,电子数目不正确.故选:C.点评:本题考查基态原子的电子排布的判断,是基础性试题的考查,侧重对学生基础知识的巩固和训练,该题的关键是明确核外电子排布的特点,然后结合构造原理灵活运用即可,难度不大.题型四:根据核外电子排布式推断元素典例5:若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是()A.该元素基态原子中共有3个电子B.该元素原子核外有5个电子层C.该元素原子最外层共有3个电子D.该元素原子M能层共有8个电子分析:某原子在处于能量最低状态时,外围电子排布为4d15s2,应为Y元素,位于周期表第ⅢB族,第N层的电子排布为4s24p64d1,以此解答该题.解答:根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2.由此可见:该元素原子中共有39个电子,分5个电子层,其中M能层上有18个电子,最外层上有2个电子.A.该元素基态原子中共有39个电子,故A错误;B.该元素原子核外有5个电子层,故B正确;C.该元素原子最外层上有2个电子,故C错误;D.该元素原子M能层共有18个电子,故D错误.故选B.点评:本题考查核外电子排布规律,难度中等,注意构造原理写出元素基态原子的电子排布式.题型五:结构示意图、轨道表示式、电子排布式、简化电子排布式和价电子排布式的区别典例:下列表示式错误的是()A.Na+的轨道表示式:B.Na+的结构示意图:C.Na的电子排布式:1s22s22p63s1D.Na的简化电子排布式:[Na]3s1分析:钠原子的电子排布式为1s22s22p63s1,或写为[Ne]3s1,Na+的原子核内有11个质子,核外有10个电子,结合洪特规则解答该题.解答:钠原子的电子排布式为1s22s22p63s1,或写为[Ne]3s1,Na+的原子核内有11个质子,核外有10个电子,结构示意图为,则A、B、C正确,D错误.故选:D.点评:本题考查原子核外电子排布,为高考常见题型,难度不大,注意把握原子核外电子的排布规律,把握电子排布式和轨道式的书写方法.【解题思路点拨】1)注意半充满或全充满的情况:如Cr的电子排布式为24Cr原子的电子排布式是:1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2,因为半充满轨道能量较低;又如25Mn 原子的电子排布式是:1s22s22p63s23p63d54s2,而不是1s22s22p63s23p63d64s1.2)四个量子数(描述原子轨道):1、主量子数(n)主量子数是描述核外电子距离核的远近,电子离核由近到远分别用数值n=1,2,3,…有限的整数来表示,而且,主量子数决定了原子轨道能级的高低,n越大,电子的能级越大,能量越高.n是决定电子能量的主要量子数.n相同,原子轨道能级相同.一个n值表示一个电子层,与各n值相对应的电子层符号如下:n1234567电子层第一层第二层第三层第四层第五层第六层第七层名称K L M N O P Q电子层符号2、角量子数(l)在同一电子层内,电子的能量也有所差别,运动状态也有所不同,即一个电子层还可分为若干个能量稍有差别、原子轨道形状不同的亚层.角量子数就是用来描述原子轨道或电子云的形态的.l的数值不同,原子轨道或电子云的形状就不同,l的取值受n的限制,可以取从0到n﹣1的正整数.n123400,10,1,20,1,2,3每个值代表一个亚层.第一电子层只有一个亚层,第二电子层有两个亚层,以此类推.亚层用光谱符号等表示.角量子数、亚层符号及原子轨道形状的对应关系如下:1234亚层符号s p d f圆球形哑铃形花瓣形花瓣形原子轨道或电子云形状同一电子层中,随着的增大,原子轨道能量也依次升高,即Ens<Enp<End<Enf,即在多电子原子中,角量子数与主量子数一起决定电子的能级.每一个值表示一种形状的电子云.与主量子数决定的电子层间的能量差别相比,角量子数决定的亚层间的能量差要小得多.3、磁量子数(m)原子轨道不仅有一定的形状,并且还具有不同的空间伸展方向.磁量子数m就是用来描述原子轨道在空间的伸展方向的.磁量子数的取值受角量子数的制约,它可取从+l到﹣l,包括0在内的整数值,l确定后,m可有2+1个值.当l=0时,m=0,即s轨道只有1种空间取向;当l=1时,m=+1、0、﹣1,即p轨道有3种空间取向;当l=2时,m=+2、+1、0、﹣1、﹣2,即d轨道有5种空间取向.通常把n、l、m都确定的电子运动状态称原子轨道,因此s亚层只有一个原子轨道,p 亚层有3个原子轨道,d亚层有5个原子轨道,f亚层有7个原子轨道.磁量子数不影响原子轨道的能量,n、l都相同的几个原子轨道能量是相同的,这样的轨道称等价轨道或简并轨道.例如l相同的3个p轨道、5个d轨道、7个f轨道都是简并轨道.n,l和m的关系见下表.1234主量子数K L M N电子层符号0010120123角量子数(l)1s2s2p3s3p3d4s4p4d4f电子亚层符号磁量子0000000000数(m)±1±1±1±1±1±1±2±2±2±3综上所述,用n,l和m三个量子数即可决定一个特定原子轨道的大小、形状和伸展方向.4、自旋量子数(ms)电子除了绕核运动外,还存在自旋运动,描述电子自旋运动的量子数还称为自旋量子数ms,由于电子有两个相反的自旋运动,因此自旋量子数取值为+1/2、﹣1/2,符号用“↑”和“↓”表示.知道了四个量子数的意义和它们之间相互联系又相互制约的关系.在四个量子数中,n,l和m三个量子数三个量子数可确定电子的原子轨道;n、l两个量子数可确定电子的能级;n这一个量子数只能确定电子的电子层.量子数的数据分析:(1)主量子数(n)n=1,2,3…正整数,它决定电子离核的远近和能级.n=1为第一电子层或称K层,距核最近,n=2为第二电子层或称L层,余类推.离核近,电子的能量较低,离核远则电子能量较高.因此主量子数n对于确定电子的能量具有决定性的作用.(2)角量子数(l)l=0,1,2,3…n﹣1,以s,p,d,f对应的能级表示亚层,角量子数l代表角动量的大小,是决定原子轨道(或电子云)的形状的量子数,表示每一主层中不同的能级.对于氢原子,核外电子能量完全由n决定;(3)磁量子数(m)原子轨道在空间的不同取向,m=0,±1,±2,±3…±l,一种取向相当于一个轨道,共可取2l+1个数值.m值反应了波函数(原子轨道)或电子云在空间的伸展方向.磁量子数m有(2l+1)个取值,例如:l=0时,m有一个取值,即m=0,s轨道球形对称,在空间只有一个取值,轨道无方向性.l=1时,m有三个取值,即m=0,±1,分别代表在空间沿x,y,z三个相互垂直的伸展方向上的三个p轨道px、py、pz,通常它们具有完全相同的能量.l=2时,m=0,±1,±2,表明d轨道在空间有五个伸展方向.l=3时,m有七个取值,m=0,±1,±2,±3,f轨道在空间有七个伸展方向.以上n,l,m三个量子数结合起来,便确定了核外电子的一个空间运动状态(即原子轨道),包括轨道的大小、形状和空间取向.(4)自旋量子数(ms)ms=±1/2,表示同一轨道中电子的二种自旋状态,它只有+1/2和﹣1/2两个取值,分别代表电子顺时针和逆时针的两个自旋方向,表示为“↓”和“↑”.。

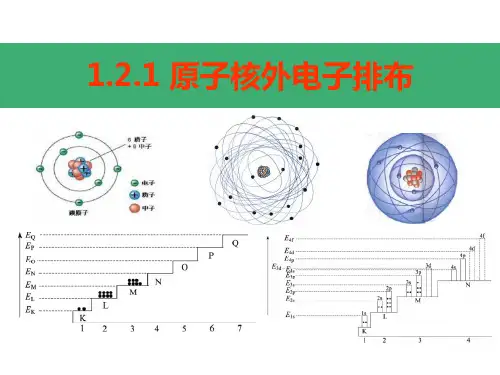
原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH H2O、H3O F HF、Ne、Na Mg2、Al3等。
②18电子粒子:SiH4、P3、PH3、S2、HS H2S、Cl HCl、Ar、K Ca2、PH4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na NH4、H3O F OH NH2;HS Cl前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He (3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、、、NH3、、O2、、H2O、、、HF、Ne、、、等。
②18电子粒子:SiH4、、PH3、、、H2S、、HCl、Ar、、、等。
特殊情况:F2、H2O2、C2H6、CH3OH ③核外电子总数及质子总数均相同的阳离子有:、、等;阴离子有:、、;、等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H (2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He(3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。






①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH、H2O、H3O、F、HF、Ne、Na、Mg2、Al3等。
②18电子粒子:SiH4、P3、PH3、S2、HS、H2S、Cl、HCl、Ar、K、Ca2、PH4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na、NH4、H3O等;阴离子有:F、OH、NH2;HS、Cl等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He (3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子核外电子的排布遵循的原理和规则
原子核外电子的排布原理和规则:
一、原子层次原理
1、原子周期:化学元素按其原子结构的稳定性遵循周期性变化的规律。
2、原子 cano 量:原子核外电子能量随电子层数增加而增加,电子结构越稳定电子能量越接近原子核,在元素周期表中按顺序增加。
二、修正的 Aufbau 原理
1、Hund-Mulliken 多电子定律:原子核外的电子从最低能量排布开始,每个电子层赋给相同的自旋状态,以尽可能利用自旋回忆力,可使元素电子结构更加稳定。
2、coulom 势调节原理:由于质子和电子之间的结合作用,原子核外电子受外界电场影响,且能量分布得到调节。
三、Pauli 排斥原理
1、不同同子异极子效应:由于质子和电子不具有相同电荷,所以当两个质子靠近时,它们吸引的电子形成己经存在的双轨,从而使第三个与双轨不同的电荷的质子无法结合,这称为不同同子异极子效应。
2、电子冲突原理:原子核外电子会出现重复的电子态,由于重复的态会出现争夺的情况,即涉及的原子的电荷最低,它不能在合适的空间中拥有两个原子,从而导致电子冲突,这称为电子冲突原理。
四、离子半径。
1、负离子半径:气态分子中硬面离子半径大于软面离子半径,其阳离子半径显著小于其化合物中所引起的负离子半径。
2、正离子半径:正离子半径是物质结构及其配位模式决定因素,配位数增加时,正离子半径也随之增加;温度增加时,正离子半径也增加。
总之,原子核外电子的排布遵循的原理和规则是:原子层次原理、修正的Aufbau原理、Pauli排斥原理以及离子半径,这些原理和规则对于化学元素的原子结构和电子分布具有重要影响。