预防接种异常反应鉴定
- 格式:ppt
- 大小:368.50 KB
- 文档页数:2


预防接种异常反应鉴定办法(完整版)预防接种异常反应鉴定办法第一章总则为规范预防接种异常反应鉴定工作,根据《疫苗流通和预防接种管理条例》和《医疗事故处理条例》的规定,制定本办法。
预防接种异常反应是指合格疫苗在实施规范接种过程中或者实施规范接种后,造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应。
受种者或者监护人(以下简称受种方)、接种单位、疫苗生产企业对预防接种异常反应调查诊断结论有争议申请预防接种异常反应鉴定的,适用本办法。
预防接种异常反应鉴定工作应当遵循公开、公正的原则,坚持实事求是的科学态度,做到事实清楚、定性准确。
预防接种异常反应鉴定由设区的市级和省、自治区、直辖市医学会负责。
第二章鉴定专家库省、自治区、直辖市医学会建立预防接种异常反应鉴定专家库,为省级、设区的市级医学会的预防接种异常反应鉴定提供专家。
专家库由临床、流行病、医学检验、药学、法医等相关学科的专家组成,并依据相关学科设置专业组。
具备良好的业务素质和执业品德,受聘于医药卫生机构或者医药卫生教学、科研等机构并担任相应专业高级技术职务3年以上的医药卫生等专业技术人员可以作为专家库候选人。
流行病学专家应当有3年以上免疫预防相关工作经验;药学专家应当有3年以上疫苗工作经验。
健康状况能够胜任预防接种异常反应鉴定工作的人员也可以成为专家库候选人。
省、自治区、直辖市医学会可以根据预防接种异常反应鉴定的实际情况,对专家库学科专业组予以适当增减,对专家库成员进行调整。
省、自治区、直辖市医学会原则上聘请本行政区域内的专家进入专家库;当本行政区域内的专家不能满足建立专家库需要时,可以聘请本行政区域外的专家进入专家库。
第八条规定了医药卫生机构、教学、科研机构和专业学会应按照医学会的要求推荐专家库候选人,同时符合条件的个人也可以直接向组建专家库的医学会申请进入专家库。
医学会会对专家库成员进行审核,审核合格的会发给XXX统一格式的聘书和证件。

预防接种异常反应鉴定服务指南一、办理依据《预防接种异常反应鉴定办法》(2008年9月11日卫生部令第60号)《山东省预防接种异常反应鉴定实施细则(试行)》(2012年4月6日鲁卫疾控发(2012)3号)二、受理单位及办理地点受理单位:临沂市医学会预防接种异常反应鉴定工作办公室【以下简称“医学会鉴定办公室”】办理地点:临沂市北城新区北京路3号公共卫生大楼0704室三、办理条件(一)受种者或监护人、接种单位、疫苗生产企业对预防接种异常反应调查诊断结论有争议的,可在收到调查诊断结论之日起60日内,向临沂市医学会申请进行预防接种异常反应鉴定。
(二)有下列情形之一的,医学会不予受理预防接种异常反应鉴定:1、无预防接种异常反应调查诊断结论的;2、已向人民法院提起诉讼的(人民法院、检察院委托的除外),或者已经人民法院调解达成协议或者判决的;3、受种方、接种单位、疫苗生产企业未按规定提交有关材料的;4、提供的材料不真实的;5、不缴纳鉴定费的;6、省级卫生行政部门规定的其他情形。
四、提交材料(一)申请材料1、书面申请:申请人的基本情况、有关事实、具体请求及理由;2、身份证明受种方:身份证、户口本、直系亲属关系证明、委托书等;接种单位:医疗单位执业许可证正副本,预防接种单位资质证书,接种相关医务人员执业证书、身份证、预防接种上岗证;疫苗生产企业:营业执照,药品生产许可证;(二)鉴定材料依据提出鉴定主体的不同,有关预防接种异常反应鉴定材料应当包括以下内容:1、预防接种异常反应调查诊断结论;2、受种者健康状况、知情同意告知以及医学建议等预防接种有关记录;3、与诊断治疗有关的门诊病历、住院志、体温单、医嘱单、化验单(检验报告)、医学影像检查资料、病理资料、护理记录等病历资料;4、疫苗接收、购进记录和储存温度记录等;5、相关疫苗该批次检验合格或者抽样检验报告,进口疫苗还应当由批发企业提供进口药品通关文件;6、与预防接种异常反应鉴定有关的其他材料。

预防接种异常反应鉴定服务指南一、事项名称预防接种异常反应鉴定二、办理依据(一)《预防接种异常反应鉴定办法》(2008年9月11日卫生部第60号令公布);(二)《关于进一步做好全省预防接种异常反应鉴定补偿工作的通知》(鲁卫疾控字[2011]54号);(三)《山东省预防接种异常反应鉴定实施细则》(鲁卫疾控发[2012]3号,省卫生厅、财政厅联合发文);(四)《山东省人民政府办公厅转发省卫生厅等部门关于完善预防接种异常反应补偿和做好关爱救助工作的意见的通知》(鲁政办发〔2012〕63号);(五)《山东省物价局山东省财政厅关于预防接种异常反应鉴定费标准的复函》(鲁价费函[2013]29号)。
三、受理单位及办理地点淄博市医学会医鉴办(淄博市张店区人民西路科技巷1号)四、办理条件拟申请预防接种异常反应鉴定、预防接种异常反应伤残等级鉴定的受种方、接种方、疫苗生产企业均可按规定程序办理。
五、申请材料(一)预防接种异常反应调查诊断结论;(二)受种者健康状况、知情同意告知以及医学建议等预防接种有关记录;(三)与诊断治疗有关的门诊病历、住院志、体温单、医嘱单、化验单(检验报告)、医学影像检查资料、病理资料、护理记录等病历资料;(四)疫苗接收、购进记录和储存温度记录等;(五)相关疫苗批次检验合格或者抽样检验报告,进口疫苗还应由批发企业提供进口药品通关文件;(六)与预防接种异常反应鉴定有关的其他材料。
六、基本流程(一)负责组织鉴定的医学会对符合受理条件的申请、委托,自受理之日起5日内向申请人、委托人发送受理通知书,并通知相关当事人。
(二)受种方、接种方、疫苗生产企业在接到通知后10日内提交书面陈述、答辩及其他鉴定材料。
(三)负责组织鉴定的医学会应在自收到各方预防接种异常反应鉴定材料之日起45日内组织鉴定,并出具鉴定书,情况特殊的可延长至90日。
(四)医学会应当在作出鉴定结论10日内将预防接种异常反应鉴定书送达申请人,并报送所在地同级卫生行政部门和药品监督管理部门。

疑似预防接种异常反应鉴定要点预防接种是一种重要的公共卫生措施,通过给予人体疫苗,提高人体对某些传染病的免疫力,从而降低感染风险。
然而,个别人在接种疫苗后可能会出现异常反应。
为了准确判断这些异常反应是否与疫苗接种有关,需要进行疑似预防接种异常反应鉴定。
本文将从几个要点出发,介绍疑似预防接种异常反应鉴定的相关内容。
一、异常反应的定义和分类我们需要明确什么是异常反应。
在预防接种过程中,异常反应是指接种后出现的与预期效果不符的不良体验或症状。
根据反应的性质和严重程度,异常反应可以分为局部反应和全身反应两大类。
局部反应多表现为接种部位红肿、疼痛等症状,全身反应则包括发热、恶心、呕吐等症状。
二、异常反应的时间窗口在进行异常反应鉴定时,我们需要关注异常反应出现的时间窗口。
根据接种疫苗后反应的出现时间,可以将异常反应分为即时反应、迟发反应和远期反应三种类型。
即时反应指接种后立即出现的反应,一般在接种后30分钟内发生。
迟发反应指接种后数小时至数天内出现的反应。
远期反应则是指接种后数天至数个月甚至数年内发生的反应。
三、异常反应与疫苗关系的评估在进行异常反应鉴定时,我们需要评估异常反应与接种的疫苗之间的关系。
这涉及到判断异常反应是否与疫苗接种有因果关系。
通常,我们可以使用Bradford Hill因果关系的判断原则,包括时间关系、一致性、剂量效应和实验研究等因素。
通过综合评估这些因素,可以初步判断异常反应与疫苗接种的关系。
四、异常反应的病因鉴定在进行异常反应鉴定时,我们还需要进行异常反应的病因鉴定。
这包括对异常反应可能的病因进行评估,例如过敏反应、疫苗成分导致的反应等。
通过仔细分析异常反应的症状、发生时间、持续时间等信息,结合疫苗的成分和接种过程的操作等因素,可以初步确定异常反应的病因。
五、异常反应的处理和管理我们需要对异常反应进行处理和管理。
对于轻微的异常反应,一般采取观察和支持性治疗即可。
对于严重的异常反应,需要进行及时处理并采取相应的治疗措施。

预防接种异常反应鉴定结论
预防接种异常反应的鉴定结论通常由专业医疗团队进行。
以下是一般情况下可能涉及的步骤和注意事项:
1.医疗观察:对于接种后出现的任何异常反应,个体通常会在医
疗机构接受观察和治疗。
医疗团队会对病人的症状、病程和医疗记录进行详细评估。
2.异常反应鉴定:医疗专业人员将根据患者的症状、病史和实验
室检查等信息,判断是否存在与疫苗接种相关的异常反应。
这需要专业医生的判断和临床经验。
3.病例报告:如有必要,医疗机构会向相关卫生部门报告疫苗接
种后的异常反应。
这有助于卫生部门对接种计划的安全性进行监测和评估。
4.专业会诊:对于复杂的病例,可能需要进行专业会诊,医疗团
队会邀请其他专业医生参与,以获得更全面的诊断和鉴定。
5.文献回顾:医疗团队可能会回顾相关的科学文献和疫苗的药品
说明书,以了解是否有类似的报道或研究支持与疫苗接种相关的异常反应。
6.公共卫生评估:在出现多例异常反应的情况下,卫生部门可能
会进行公共卫生评估,以判断是否存在特定疫苗或接种计划的安全性问题。
请注意,对于疫苗接种后的异常反应鉴定,需要由专业医疗团队进行,包括接种医生、临床医生和其他医疗专业人员。
如果你或他人怀
疑与接种相关的异常反应,建议及时就医并向医生报告,以便得到专业的评估和处理。



疑似预防接种异常反应如何进行鉴定随着疫苗应用的普及,疫苗接种已成为预防疾病的重要措施之一。
然而,在接种过程中少数个体可能出现异常反应,疫苗接种后反应的征兆不同,如发热、局部红肿痛、轻微不适等,一些特异性反应更加罕见,而这些不良反应是否由于接种引起尚需进一步鉴定。
接下来将重点介绍疑似预防接种异常反应如何进行鉴定。
一、了解不良反应种类及常见症状疫苗接种后反应常见的表现包括:发热、红肿痛、皮肤瘙痒、头痛、恶心、腹泻、嗜睡、失眠等,以及较严重的过敏反应、神经系统反应等。
应对接种后反应的发生进行关注和区别。
了解不良反应的发生率及严重程度,有助于提高人们对接种方法的信心。
二、确定疫苗接种与异常反应的可能性在出现不良反应后,需要对疫苗接种与反应之间的因果关系进行诊断和鉴别。
疫苗是一种强有力的药品,包含疫苗成分中的毒素和其他成分均具有剂量依赖性毒性,人体对于剂量小的毒素会有较小程度的刺激和反应,但人体对于能够引起免疫反应的剂量要小得多。
所以必须保证疫苗接种按照剂量和规律进行,否则疫苗接种后引起的不良反应可能与其他因素有关,而不是由疫苗引起的。
三、诊断疫苗接种异常反应的诊断方法1.检查病史在接种疫苗后出现异常反应的患者,首先需要进行病史采集。
了解患者的症状、接种情况、病史等等是否与疫苗接种有关。
对于过去有过过敏反应病史的患者,需要特别注意。
2.临床表现在病史采集后,医生将通过患者的临床表现来判断是否有疑似接种异常反应的征兆,并根据病情判断是否需要进一步检查。
3.实验室检查对于疑似异常反应,可以进行实验室检查,寻找出异常反应的病因。
可以通过对血样的检查,包括肝肾功能、免疫指标、炎症指标等方面的相关检查以确定病因。
4.研究病例对于确实存在疑似异常反应的病例,医生可以研究相关病例,结合查阅有关文献资料,来评估疫苗接种行为是否与患者的异常反应有关。
四、如何防止接种异常反应1.注射疫苗前进行个体状况评估,对检查结果不佳的个体需时时重点关注。

预防接种异常反应鉴定办法第一章文件发布与施行本鉴定办法经国家卫生健康委员会审议通过,现予发布,自发布之日起施行。
各级卫生健康部门、疾病预防控制机构、接种单位等应严格按照本办法执行,确保预防接种异常反应能够得到及时、公正、科学的鉴定和处理。
第二章总则与定义第一条为了规范预防接种异常反应的鉴定工作,保障公民的健康权益,提高预防接种工作的安全性和有效性,特制定本办法。
第二条预防接种异常反应,是指在预防接种过程中或者接种后造成组织器官、功能损害,相关各方对是否存在因果关系存在争议的反应。
第三条预防接种异常反应鉴定,是指由卫生健康部门组织专家,根据本办法和相关医学知识,对预防接种过程中或者接种后发生的异常反应进行调查、分析、评估,提出鉴定意见的活动。
第三章争议申请与鉴定第四条预防接种异常反应争议的申请人可以是接种者、接种单位、疫苗生产企业等。
申请人应向所在地的县级卫生健康部门提出鉴定申请,并提供相关证据材料。
第五条县级卫生健康部门收到鉴定申请后,应及时组织专家进行初步审查,认为有必要进行鉴定的,应当报请上级卫生健康部门组织专家进行鉴定。
第四章调查诊断依据第六条预防接种异常反应鉴定应以事实为依据,以医学科学原理为准绳。
专家鉴定组应全面收集、审查有关证据,包括病历资料、医学检查报告、疫苗接种记录等。
第七条预防接种异常反应鉴定应考虑疫苗接种时的身体状况、疫苗接种规范、疫苗质量等因素,综合分析判断异常反应与疫苗接种之间的因果关系。
第五章事故技术鉴定第八条对于预防接种过程中发生的严重异常反应或事故,应当组织事故技术鉴定,明确事故原因和责任。
第九条事故技术鉴定由省级以上卫生健康部门组织,邀请相关领域的专家进行,确保鉴定结论的科学性和公正性。
第六章疫苗质量争议第十条对于涉及疫苗质量问题的争议,应当首先由疫苗生产企业所在地的省级药品监督管理部门进行调查核实。
第十一条疫苗质量争议的调查结果,应作为预防接种异常反应鉴定的重要依据。
疑似预防接种异常反应如何进行鉴定一、申请(一)申请时限受种方、接种方、疫苗生产企业对预防接种异常反应调查诊断结论有争议时,应在收到预防接种异常反应调查诊断结论之日起60日内,向接种单位所在地设区的市级医学会提出预防接种异常反应鉴定申请,提交预防接种异常反应鉴定所需的材料,预交鉴定费。
经调查诊断或鉴定,已确定为预防接种异常反应的,受种方需进行伤残等级鉴定。
脊灰疫苗相关病例的受种方应在出现麻痹临床表现满1年后的1年内,其他预防接种异常反应的受种方应在预防接种异常反应调查诊断或鉴定专家组判定其病情稳定后(原则上为发病6个月后)的1年内,向接种单位所在地设区的市级医学会申请预防接种异常反应伤残等级鉴定。
负责组织鉴定的医学会对符合受理条件的申请、委托,自受理之日起5日内向申请人、委托人发送受理通知书,并通知相关当事人。
受种方、接种方、疫苗生产企业在接到通知后10日内提交书面陈述、答辩及其他鉴定材料。
受种方、接种方、疫苗生产企业对市级医学会预防接种异常反应鉴定结论或伤残等级鉴定结论不服的,可在收到首次鉴定书之日起15日内,向山东省医学会申请再次鉴定。
(二)材料预防接种异常反应鉴定材料应包括下列内容:1.预防接种异常反应调查诊断结论;2.受种者健康状况、知情同意告知以及医学建议等预防接种有关记录;3.与诊断治疗有关的门诊病历、住院志、体温单、医嘱单、化验单(检验报告)、医学影像检查资料、病理资料、护理记录等病历资料;4.疫苗接收、购进记录和储存温度记录等;5.相关疫苗批次检验合格或者抽样检验报告,进口疫苗还应由批发企业提供进口药品通关文件;6.与预防接种异常反应鉴定有关的其他材料。
受种方应当提供上述1.2.3.6所规定的材料;接种方应当提供1.2.4.5.6所规定的材料;疫苗生产、批发企业应当提供4.5.6所规定的材料。
各方应当主动提供由自己保存或者掌握的与预防接种异常反应鉴定有关的材料,否则承担相关责任。
预防接种异常反应伤残等级鉴定材料应包括预防接种异常反应调查诊断或鉴定结论以及上述2.3.6所规定的材料。
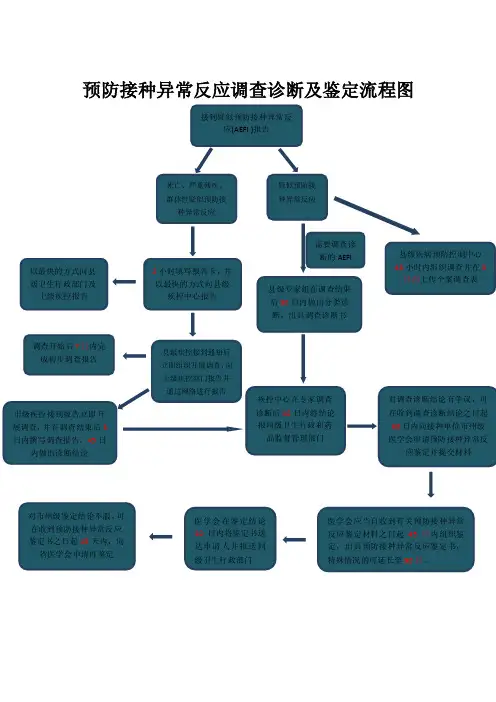
疑似预防接种异常反应及处置一、疑似预防接种异常反应监测(一)监测病例定义疑似预防接种异常反应(简称AEFI)是指在预防接种后发生的怀疑与预防接种有关的反应或事件。
(二)报告1、报告范围——24小时内:如过敏性休克、不伴休克的过敏反应(荨麻疹、斑丘疹、喉头水肿等)、中毒性休克综合征、晕厥、癔症等。
——5天内:如发热 (腋温≥38.6℃)、血管性水肿、全身化脓性感染(毒血症、败血症、脓毒血症)、接种部位发生的红肿(直径>2.5cm)、硬结(直径>2.5cm)、局部化脓性感染(局部脓肿、淋巴管炎和淋巴结炎、蜂窝组织炎)等。
——15天内:如麻疹样或猩红热样皮疹、过敏性紫癜、局部过敏坏死反应(Arthus反应)、热性惊厥、癫痫、多发性神经炎、脑病、脑炎和脑膜炎等。
——6周内:如血小板减少性紫癜、格林巴利综合征、疫苗相关麻痹型脊髓灰质炎等。
——3个月内:如臂丛神经炎、接种部位发生的无菌性脓肿等。
——接种卡介苗后1—12个月:如淋巴结炎或淋巴管炎、骨髓炎、全身播散性卡介苗感染等。
——其他:怀疑与预防接种有关的其他严重疑似预防接种异常反应。
2、报告单位和报告人。
医疗机构、接种单位、疾病预防控制机构、药品不良反应监测机构、疫苗生产企业、疫苗批发企业及其执行职务的人员为疑似预防接种异常反应的责任报告单位和报告人。
3、报告程序(1)一般情况下及时向县级卫生行政部门、药品监督管理部门报告。
(2)发现怀疑与预防接种有关的死亡、严重残疾、群体性疑似预防接种异常反应、对社会有重大影响的疑似预防接种异常反应时,应当在发现后2小时内报告;县级卫生行政部门和药品监督管理部门在2小时内逐级向上一级卫生行政部门、药品监督管理部门报告。
(3)发现疑似预防接种异常反应后48小时内填写疑似预防接种异常反应个案报告卡,向县级疾病预防控制机构报告;发现怀疑与预防接种有关的死亡、严重残疾、群体性疑似预防接种异常反应、对社会有重大影响的疑似预防接种异常反应时,在2小时内填写疑似预防接种异常反应个案报告卡或群体性疑似预防接种异常反应登记表,以电话等最快方式向受种者所在地的县级疾病预防控制机构报告。
预防接种异常反应鉴定结论近年来,随着疫苗接种的普及,人们对于疫苗的安全性和有效性越来越关注。
虽然疫苗接种可以有效预防多种传染病,但有时也会出现异常反应。
为了确保接种的安全性,我们需要进行异常反应的鉴定。
异常反应鉴定是指通过对接种者的症状和体征进行观察和分析,确定是否与疫苗接种有关,并给出结论。
在进行异常反应鉴定时,我们应该遵循以下几点原则。
需要进行详细的病史询问和体格检查。
通过了解接种者的病史和体征,可以帮助我们初步判断症状是否与疫苗接种有关。
同时,还需要了解接种者的过敏史和家族遗传史,这些信息对于异常反应的鉴定非常重要。
需要进行疫苗接种相关性评估。
接种者接种疫苗后出现的症状是否与接种时间和接种疫苗相关,是判断异常反应的关键。
一般来说,疫苗接种后出现的症状在接种后数小时至数天内出现,持续时间一般不超过一周。
如果接种者的症状与接种时间和接种疫苗相关,那么就可以初步判断为异常反应。
然后,需要进行鉴别诊断。
有些症状可能不是由疫苗接种引起的,而是由其他原因导致的。
因此,在进行异常反应鉴定时,需要排除其他可能性,如感染、基础疾病等。
这需要医生根据接种者的具体情况进行综合分析和判断。
需要给出异常反应鉴定结论。
根据以上的观察和分析,我们可以得出结论,判断接种者的症状是否与疫苗接种有关。
如果判断为异常反应,需要及时采取相应的治疗和处理措施;如果判断不是异常反应,则需要进一步寻找其他原因并进行相应的治疗。
预防接种异常反应鉴定结论是非常重要的,它可以帮助我们判断接种者的症状是否与疫苗接种有关,并采取相应的处理措施。
通过严谨的观察和分析,我们可以确保疫苗接种的安全性和有效性,为人们的健康保驾护航。