化学实验报告对氯苯氧乙酸的合成
- 格式:doc
- 大小:133.00 KB
- 文档页数:5
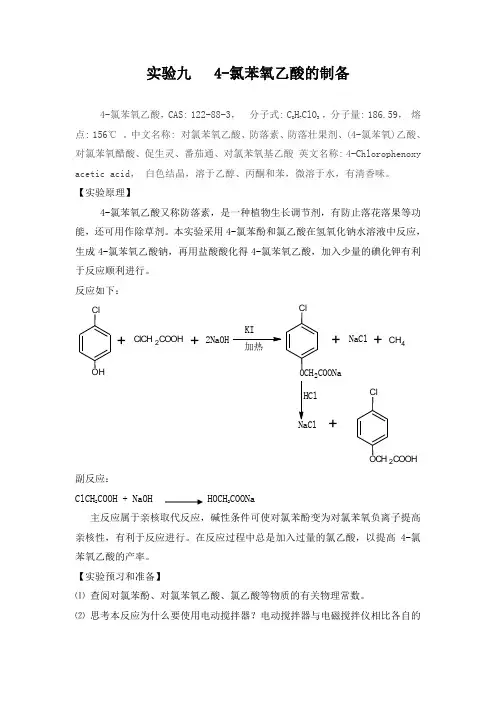
实验九 4-氯苯氧乙酸的制备4-氯苯氧乙酸,CAS: 122-88-3,分子式: C8H7ClO3 ,分子量: 186.59,熔点: 156℃。
中文名称: 对氯苯氧乙酸、防落素、防落壮果剂、(4-氯苯氧)乙酸、对氯苯氧醋酸、促生灵、番茄通、对氯苯氧基乙酸英文名称: 4-Chlorophenoxy acetic acid,白色结晶,溶于乙醇、丙酮和苯,微溶于水,有清香味。
【实验原理】4-氯苯氧乙酸又称防落素,是一种植物生长调节剂,有防止落花落果等功能,还可用作除草剂。
本实验采用4-氯苯酚和氯乙酸在氢氧化钠水溶液中反应,生成4-氯苯氧乙酸钠,再用盐酸酸化得4-氯苯氧乙酸,加入少量的碘化钾有利于反应顺利进行。
反应如下:C lO H +ClCH2COOH+2NaOHKI加热C lOCH2COONa+NaCl+C H4NaCl+C lOCH2COOH副反应:ClCH2COOH + NaOH HOCH2COONa主反应属于亲核取代反应,碱性条件可使对氯苯酚变为对氯苯氧负离子提高亲核性,有利于反应进行。
在反应过程中总是加入过量的氯乙酸,以提高4-氯苯氧乙酸的产率。
【实验预习和准备】⑴查阅对氯苯酚、对氯苯氧乙酸、氯乙酸等物质的有关物理常数。
⑵思考本反应为什么要使用电动搅拌器?电动搅拌器与电磁搅拌仪相比各自的优缺点是什么?⑶本反应加入的碘化钾的作用是什么?试写出其催化的反应机理。
⑷本反应为什么要滴加氯乙酸和氢氧化钠?如果把他们一次性加入反应瓶可能会发生什么?试预测之。
⑸在有机化学教科书中是如何讨论此类反应的?什么样的条件可以加快反应速度?【实验试剂】4-氯苯酚6.4g(0.05mol)、氯乙酸5.3g(0.05mol)、20%氢氧化钠溶液25mL、碘化钾0.5g、浓盐酸适量、pH试纸若干。
【实验步骤】按图9-1安装反应装置,下置电热套。
在100mL三口烧瓶中加入10ml20%的NaOH水溶液和6.4g 4-氯苯酚,搅拌溶解后,再加入0.5g碘化钾。


苯氧乙酸的合成方案苯氧乙酸是一种常用的有机化合物,广泛应用于医药、染料、涂料、塑料等领域。
本文将介绍一种合成苯氧乙酸的方案,以满足标题描述的要求。
以下是具体步骤:1. 原料准备:为了合成苯氧乙酸,我们需要准备苯酚、乙酸和催化剂。
苯酚是合成苯氧乙酸的原料之一,乙酸则是另一个原料,而催化剂用于促进反应的进行。
2. 反应条件设定:为了提高反应效率,并达到预期的产率,我们需要设定合适的反应条件。
在本方案中,我们选择使用无水醋酸作为溶剂,并加入适量的催化剂。
反应温度设定在80°C,反应时间为2小时。
3. 反应步骤:下面是合成苯氧乙酸的具体步骤:步骤一:将苯酚和乙酸按照摩尔比例混合,并加入适量的催化剂到无水醋酸中。
步骤二:将混合溶液置于反应器中,并加热至80°C。
步骤三:在80°C下反应2小时,期间可以进行搅拌以提高反应效率。
步骤四:反应结束后,将反应溶液进行冷却,并用水洗涤以除去无机盐和杂质。
步骤五:将洗涤后的产物进行浓缩、结晶、干燥等处理步骤,得到纯度较高的苯氧乙酸。
4. 结果分析与改进:通过上述的合成方案,我们可以得到苯氧乙酸作为产物。
然而,在实际操作中,仍然可能会遇到一些问题。
例如,产率不高、杂质较多等。
为了改进合成方案,可以尝试调整反应条件、优化溶剂体系、选择更有效的催化剂等。
总结:苯氧乙酸是一种重要的有机化合物,其合成方案的优化对于提高产率和纯度具有重要意义。
本文介绍了一种常用的合成苯氧乙酸的方案,通过准备原料、设定反应条件,并进行若干步骤的反应操作,可以得到目标产物。
然而,值得注意的是实际操作中可能会遇到各种问题,因此随时调整和改进合成方案是至关重要的。

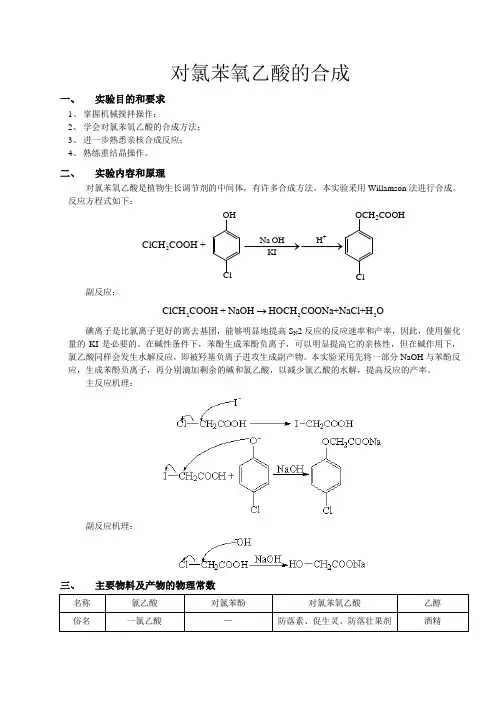
对氯苯氧乙酸的合成一、 实验目的和要求1、 掌握机械搅拌操作;2、 学会对氯苯氧乙酸的合成方法;3、 进一步熟悉亲核合成反应;4、 熟练重结晶操作。
二、 实验内容和原理对氯苯氧乙酸是植物生长调节剂的中间体,有许多合成方法,本实验采用Willamson 法进行合成。
反应方程式如下:副反应:222ClCH COOH + NaOH HOCH COONa+NaCl+H O →碘离子是比氯离子更好的离去基团,能够明显地提高S N 2反应的反应速率和产率,因此,使用催化量的KI 是必要的。
在碱性条件下,苯酚生成苯酚负离子,可以明显提高它的亲核性,但在碱作用下,氯乙酸同样会发生水解反应,即被羟基负离子进攻生成副产物。
本实验采用先将一部分NaOH 与苯酚反应,生成苯酚负离子,再分别滴加剩余的碱和氯乙酸,以减少氯乙酸的水解,提高反应的产率。
主反应机理:副反应机理:三、 主要物料及产物的物理常数OHCl+Na OHH KI−−−→−−→OCH 2COOHCl2ClCH COOH +四、主要仪器设备仪器100mL三口烧瓶;滴液漏斗;电热包(或油浴装置);机械搅拌器(或磁力搅拌器);球形冷凝管;吸滤装置;250mL烧杯;10mL量筒;50mL量筒;胶头滴管。
试剂对氯苯酚;氯乙酸;20%NaOH;碘化钾;1:1盐酸;95%乙醇;pH试纸。
五、操作方法和实验步骤实验装置图:六、 实验结果与分析重结晶前的粗产物质量为11.72g ,粗产率为11.72100%124.2%6.50186.59/128.56/m gm gg molM g molM ⨯==⨯粗产品对氯苯酚对氯苯氧乙酸对氯苯酚粗产率超过100%,显然其中混有大量杂质。
根据实验过程分析,由于未趁热加酸,导致酸化不充分,粗产品抽滤时没有充分洗涤,这两个原因导致产物中混入大量对氯苯氧乙酸盐杂质。
重结晶提纯的产物经干燥后质量为4.76g ,产率为4.76100%50.5%6.50186.59/128.56/m gm gg molM g molM ⨯==⨯产物对氯苯酚对氯苯氧乙酸对氯苯酚提纯干燥产物的熔程两次测量分别为155.6℃~157.0℃,155.7℃~157.2℃,平均为155.6℃~157.1℃,比文献值157℃~159℃偏低,分析其原因可能为混入脱羧产物或(和)乙醇,或者干燥不充分所致。
![试验5对氯苯氧乙酸的制备[收集]](https://uimg.taocdn.com/34b6a1ef951ea76e58fafab069dc5022aaea4637.webp)
实验5 对氯苯氧乙酸的制备(一)实验目的1.复习巩固芳香醚的制备和芳环上的氯代反应,掌握利用苯酚制备对氯苯氧乙酸的原理及方法。
2.熟练掌握电动搅拌装置的使用,掌握固体酸性产物的纯化方法。
(二)实验原理ClCH223ClCH2COONaOCH2COOH OCH2COONaClOCH2COONa22FeCl3HClNaOH该实验为两步反应:第一步,酚钠和氯乙酸在碱性中通过Williamson合成法制得苯氧乙酸。
第二步是在三氯化铁的催化下发生苯环上的氯化反应生成对氯苯氧乙酸。
但该实验不是直接通氯气,而是通过双氧水氧化盐酸生成氯,紧接着就发生氯化反应。
最后的产品经重结晶纯化。
对氯苯氧乙酸是一个常用的植物生长调节剂,俗称“防落素”,可以减少农作物或瓜果蔬菜的落花落果,有明显的增产作用。
(三)实验试剂及物理常数药品名称分子量(mol wt) 性状熔点(℃)沸点(℃)比重(d420)溶解性氯乙酸94.5无色晶体61~63 188 1.58 易溶于水,乙醇和乙醚苯酚94.11无色晶体42~43 181.75 1.071 热溶于水,易溶于乙醇和乙醚苯氧乙酸152无色晶体98~100 285 热溶于水,能溶于乙醇和乙醚三氯化铁162.22 橙红色固体282 - 2.898 易溶于水乙醚74.12 无色液体- 34.51 0.7138微溶于水,易溶于乙醇(四)实验装置图反应装置抽滤装置干燥装置布氏漏斗抽滤瓶(五)实验步骤在装有搅拌器、回流冷凝管和滴液漏斗的50ml 三口瓶中,加入3.8克氯乙酸和5毫升水,开动搅拌,慢慢滴加饱和碳酸钠溶液,至溶液的pH=7~8,然后加入2.5克苯酚,再慢慢滴加35%氢氧化钠溶液至pH=12,沸水浴加热搅拌反应半个小时,继续用氢氧化钠调PH =12,再加热反应15分钟。
移去水浴,用浓盐酸调pH=3~4,这时候会析出固体,抽滤,用水洗2~3次,在60~65℃下烘干,备用。
反应装置同上,加入3克上述制备的对氯苯氧乙酸,和10ml冰乙酸,升温至55℃,加入少量三氯化铁(大约1粒绿豆大小)和10毫升浓盐酸(不要过量)。

苯氧乙酸和对氯苯氧乙酸制备YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】化学与化学工程学院有机化学实验报告实验项目:苯氧乙酸和对氯苯氧乙酸制备实验日期:实验目的:了解对氯苯氧乙酸和苯氧乙酸的制备方法;:复习机械搅拌,分液漏斗使用,重结晶等操作。
实验原理:先缩合苯氧乙酸的合成,再采用浓盐酸加过氧化氢在酸性介质中的氯化来制备对氯苯氧乙酸。
:反应式第一步是制备酚醚,这是一个亲核取代反应,在碱性条件下易于进行。
第二步是苯环上的亲电取代,FeCl3作催化剂,氯化剂是Cl+,引入第一个Cl。
2HCl + H2O2→ Cl2 + 2H2O Cl2 + FeCl3→ [ FeCl4 ]- + Cl+实验药品:物学常数名称:苯酚 CAS号:108-95-2 分子式:C6H6O分子量: 熔点: 沸点:相对密度:折射率: 价格:元/吨用途:苯酚可作杀菌剂、麻醉剂、防腐剂。
(Lister J)最早将其用于外科手术消毒;但由于苯酚的毒性,这一技术最终被取代。
现在苯酚可用于制备消毒剂,如TCP;或用其稀溶液直接进行消毒。
苯酚是多种化工产品的原料,用来合成阿司匹林等药品,以及一些农药、香料、染料。
亦用来合成树脂,最主要的一种是和甲醛缩合而成的。
尽管苯酚的浓溶液毒性很强,它仍在整形外科手术中充当脱皮剂。
性质:可混溶于、醚、氯仿、甘油、二硫化碳、凡土林、挥发油、强碱水溶液。
室温时稍溶于水,与大约8%水混合可液化,65℃以上能与水混溶,几乎不溶于石油醚。
名称:氯乙酸 CAS号:79-11-8分子式:C2H3ClO2分子量:熔点:61沸点:188相对密度:折射率 :------- 价格:元/吨用途:用于制和作中间体。
性质:溶于水、乙醇、乙醚、氯仿、二硫化碳。
名称:苯氧乙酸CAS号:122-59-8分子式:C8H8O3分子量:152 熔点:97-99 沸点: 285 相对密度:----折射率-----价格:元/吨用途:苯氧乙酸是重要的化工原料,可以用来生产青霉素V、除草剂、染料杀虫剂、杀菌剂、植物激素和中枢神经兴奋药物的中间体等。

2,4-⼆氯苯氧⼄酸的合成和含量分析2,4-⼆氯苯氧⼄酸的合成和含量分析(实验时间:14⼩时)⼀、实验⽬的1.掌握芳环上的温和条件下的卤化反应及Williamson 醚合成法2.熟练酸碱滴定分析产物含量的检测⽅法。
⼀、基本原理苯氧⼄酸可作为防腐剂,⼀般由苯酚钠和氯⼄酸通过Williamson 醚合成法制备。
通过它的次氯酸氧化,可得到对氯苯氧⼄酸和2,4-⼆氯苯氧⼄酸(简称2,4-D)。
前者⼜称防落素,能减少农作物落花落果。
后者⼜名除莠剂,⼆者都是植物⽣长调节剂。
ClCH 2CO 2H ClCH 2CO 2Na HCl +HCl H 2O 22NaOCl ++H +Na 2CO 3FeCl 3Cl ClCl Cl OCH 2CO 2Na OCH 2COOH OCH 2COOHOCH 2COOH OCH 2COOHOCH 2COOH芳环上的卤化作为的芳环亲电取代反应,⼀般是在氯化铁催化下与氯⽓反应。
本实验通过浓盐酸加过氧化氢和⽤次氯酸钠在酸性介质中氯化,避免了直接使⽤氯⽓带来的危险和不便。
其反应原理如下:2HCl H 2O 2+Cl 22H 2OHOClCl 2O H +++H 2OCl +2HOCl +H 2O H 2O +Cl 和Cl 2O 也是良好的氧化试剂。
三、主要仪器与药品氯⼄酸3.8g(0.04mol),苯酚2.5g(0.027mol),饱和碳酸钠溶液,35%氢氧化钠溶液,冰醋酸,浓盐酸,过氧化氢(30%),次氯酸钠,⼄醇,⼄醚,四氯化碳,可控温电磁搅拌器,可控温电热套。
四、操作步骤1、苯氧⼄酸的制备在装有可控温电磁搅拌器,回流冷凝管和滴液漏⽃的100mL三颈瓶中,加⼊3.8g氯⼄酸和5mL⽔。
开动搅拌器,慢慢滴加饱和碳酸氢钠溶液(1)(约需7mL),⾄溶液pH为7-8。
然后加⼈2.5g苯酚,再慢慢滴加35%的氢氧化钠溶液⾄反应混合物pH为12。
将反应物在沸⽔浴中加热约0.5⼩时。
反应过程中PH值会下降,应补加氢氧化纳溶液,保持pH值为12,在沸⽔浴上再继续加热15分钟。

实 验 教 学 教 案 用 纸 苯氧乙酸衍生物的合成与含量测定(12学时)一、实验目的1、 掌握芳环上的温和条件下的卤化反应及Williamson 醚合成法。
2、 熟练酸碱滴定分析产物含量的检测方法。
二、实验原理苯氧乙酸可作为防腐剂,一般由苯酚钠和氯乙酸通过 Williamson 醚合成法制备。
通过它的次氯酸氧化,可得到对氯苯氧乙酸和 2,4-二氯苯氧乙酸(简称 2,4—D ) 。
前者又称防落素,能减少农作物落花落果。
后者又名除莠剂,二者都是植物生长调节剂。
芳环上的卤化作为的芳环亲电取代反应,一般是在氯化铁催化下与氯气反应。
本实验通 过浓盐酸加过氧化氢和用次氯酸钠在酸性介质中氯化, 避免了直接使用氯气带来的危险和不 便。
其反应原理如下:H 2O +Cl 和Cl2O 也是良好的氧化试剂。
实验教学教案用纸三、实验仪器与试剂仪器:有机合成制备仪,可控温电磁搅拌器,可控温电热套。
试剂:氯乙酸3.8g(0.04mol),苯酚2.5g(0.027mol),饱和碳酸钠溶液,35%氢氧化钠溶液,冰醋酸,浓盐酸,过氧化氢(30%),次氯酸钠,乙醇,乙醚,四、实验步骤1、苯氧乙酸的制备在装有可控温电磁搅拌器,回流冷凝管和滴液漏斗的100mL 三颈瓶中,加入3.8g 氯乙酸和5mL 水。
开动搅拌器,慢慢滴加饱和碳酸氢钠溶液(约需7mL),至溶液pH为7-8。
然后加人2.5g 苯酚,再慢慢滴加35%的氢氧化钠溶液至反应混合物PH 为12。
将反应物在沸水浴中加热约0.5 小时。
反应过程中PH 值会下降,应补加氢氧化纳溶液,保持PH 值为12,在沸水浴上再继续加热15 分钟。
反应完毕后,将三颈瓶移出水浴,趁热转入锥型瓶中在搅拌下用浓盐酸酸化至PH 为3-4。
在冰浴中冷却,析出固体,待结晶完全后,抽滤,粗产物用冷水洗涤2-3 次,在60-65℃下干燥,产量约 3.5-4g,测熔点。
粗产物可直接用于对氯苯氧乙酸的制备。
纯苯氧乙酸的熔点为98-99℃。


实验十三苯氧乙酸及对氯苯氧乙酸的制备
一、实验背景
苯氧乙酸即苯酚乙酸,是一种有机化合物,分子式为C8H8O2。
它是白色结晶,易溶于水和乙醇,具有苯醇的芳香味和乙酸的刺激气味。
苯氧乙酸可以用作医药、染料、食品添加剂等方面;它还可以作为合成材料的原料,用于制备其他有机化合物。
二、实验原理
1.苯氧乙酸的制备方法
苯氧乙酸可以通过苯酚和乙酸酐反应制得。
具体步骤如下:
(1)将20g苯酚加入25 mL的1mol/L氢氧化钠溶液中溶解,加入20 mL的乙酸酐,反应混合物加热至50℃,反应2h;
(2)反应混合物降温后加入适量的浓盐酸酸化,棕色固体沉淀,过滤并用水洗净;
(3)把得到的白色固体晾干,即为苯氧乙酸。
(3)将得到的白色固体溶于热乙醇,在加热的过程中逐渐加入少量水,冷却后过滤,得到白色结晶体,即为对氯苯氧乙酸。
三、实验步骤
(4)过滤并用水洗净,晾干得到苯氧乙酸。
四、实验注意事项
1.操作时应注意安全,避免接触到皮肤和眼睛。
2.反应要在通风良好的地方进行。
3.制备时要注意温度和反应时间,反应过程中不得外出。
4.反应混合物酸化时应逐滴添加盐酸,避免添加过量。
5.使用前应检查药品的质量和纯度。
五、实验总结
本实验通过对苯氧乙酸及对氯苯氧乙酸的制备,让我们更加深入的了解了有机合成方法。
实验中我们学习了苯酚与乙酸酐反应制备苯氧乙酸及对氯苯酚与乙酸酐反应制备对氯
苯氧乙酸的方法,同时也学会了过滤、酸化等基本实验操作技能。
在实践中,我们也发现了操作时细节的重要性,小心谨慎才是一名合格的化学实验者。
苯氧乙酸和对氯苯氧乙酸制备The document was finally revised on 2021化学与化学工程学院有机化学实验报告实验项目:苯氧乙酸和对氯苯氧乙酸制备实验日期:实验目的:了解对氯苯氧乙酸和苯氧乙酸的制备方法;:复习机械搅拌,分液漏斗使用,重结晶等操作。
实验原理:先缩合苯氧乙酸的合成,再采用浓盐酸加过氧化氢在酸性介质中的氯化来制备对氯苯氧乙酸。
:反应式第一步是制备酚醚,这是一个亲核取代反应,在碱性条件下易于进行。
第二步是苯环上的亲电取代,FeCl3作催化剂,氯化剂是Cl+,引入第一个Cl。
2HCl + H2O2→ Cl2 + 2H2O Cl2 + FeCl3→ [ FeCl4 ]- + Cl+实验药品:物学常数名称:苯酚 CAS号:108-95-2 分子式:C6H6O分子量: 熔点: 沸点:相对密度:折射率: 价格:元/吨用途:苯酚可作杀菌剂、麻醉剂、防腐剂。
(Lister J)最早将其用于外科手术消毒;但由于苯酚的毒性,这一技术最终被取代。
现在苯酚可用于制备消毒剂,如TCP;或用其稀溶液直接进行消毒。
苯酚是多种化工产品的原料,用来合成阿司匹林等药品,以及一些农药、香料、染料。
亦用来合成树脂,最主要的一种是和甲醛缩合而成的。
尽管苯酚的浓溶液毒性很强,它仍在整形外科手术中充当脱皮剂。
性质:可混溶于、醚、氯仿、甘油、二硫化碳、凡土林、挥发油、强碱水溶液。
室温时稍溶于水,与大约8%水混合可液化,65℃以上能与水混溶,几乎不溶于石油醚。
名称:氯乙酸 CAS号:79-11-8分子式:C2H3ClO2分子量:熔点:61沸点:188相对密度:折射率 :------- 价格:元/吨用途:用于制和作中间体。
性质:溶于水、乙醇、乙醚、氯仿、二硫化碳。
名称:苯氧乙酸CAS号:122-59-8分子式:C8H8O3分子量:152 熔点:97-99 沸点: 285 相对密度:----折射率-----价格:元/吨用途:苯氧乙酸是重要的化工原料,可以用来生产青霉素V、除草剂、染料杀虫剂、杀菌剂、植物激素和中枢神经兴奋药物的中间体等。
实验七 苯氧乙酸及对氯苯氧乙酸的制备2002年月日一、实验目的:1、了解Williamson 醚合成法的机理及其应用;2、掌握苯氧乙酸及对氯苯氧乙酸的制备方法和应用;3、掌握电动搅拌器的使用。
二、实验原理:OHCH 2Cl COOH.OCH 2COOH+OCH 2COOH+HCl/H 2O 2OCH 2COOHCl2HCl H 2O 2Cl 2H 2O ++主要副反应:CH 2Cl COOH.+2NaOHHOCH 2COONaOCH 2COOH+OCH 2COOH+ClHClCl 2四、主要试剂用量及规格:氯乙酸 7.6g (0.08mol ) 苯酚 5g (0.053mol ) 过氧化氢 8ml (30%) 浓盐酸 28ml (分析纯) 冰醋酸 25ml (分析纯) 三氯化铁 催化量(28mg ) NaOH 适量(35%溶液) Na 2CO 3 约15ml (饱和溶液) 五、仪器装置图:七、实验流程图:00081004 段赛OCH 2COONa,HOCH 2COONa,H 2O,NaOH,NaCl ↓浓盐酸OCH 2COOH,HOCH 2COOH, H 2O,NaCl,HCl ↓过滤母液┌────────────────┐固体HOCH 2COOH, H 2O,NaCl,HCl OCH 2COOH│①FeCl 3,H 2O 2 ↓②浓盐酸OCH 2COOH Cl ,OCH 2COOHCl,H 2O 2,Cl 2,FeCl 3 ↓过滤母液┌──────────────────┐固体OCH 2COOHCl, H 2O 2,Cl 2,FeCl 3 OCH 2COOHCl八、产率计算:理论产量= 0.053×152=8.06g 实际产量= g 产率=100%⨯实际产量理论产量=8.06100%⨯= % 九、讨论:1、加药品的顺序要注意,避免氯乙酸的水解,提高产率。
2、若第三步没有沉淀生成,可以加点浓盐酸和过氧化氢。
对氯苯氧乙酸对氯苯氧乙酸的制备的制备一、实验目的1、加深对芳环卤化反应原理的理解及掌握其合成方法。
2、学习电动搅拌器的使用。
二、主要试剂和产物的物理常数三、主要试剂苯氧乙酸(自制)四、实验操作、现象及注意事项名称分子量性状折光率(n 20D)密度熔点(℃)沸点(℃)溶解度水乙醇乙醚苯氧乙酸152无色针状//98.5285不溶可溶可溶对氯苯氧乙酸186无色晶体//156.5/不溶可溶可溶实验操作及现象现象的解释及注意事项(1)在三颈瓶中放入粗产品苯氧乙酸和冰醋酸。
(2)安装电动搅拌装置,回流冷凝管和滴液漏斗。
开动搅拌器,用水浴加热。
(2)水浴温度升至55℃时,关热源,加入浓盐酸和绿豆大的FeCl 3。
(3)控制水浴温度60~70℃,20min 内滴加入冰醋酸的目的:使苯氧乙酸溶解且在极性溶剂中有利亲电取代反应。
所有的仪器必须固定在一个铁架台上,搅拌棒上应包一层胶布后套到电机的接口上,旋紧紧固螺母,使搅拌棒牢固固定在电机的接口内。
搅拌棒要垂直安装,并与三颈瓶中间直口四周等距离。
搅拌棒下端应比三颈瓶底高5mm 左右。
安装好后,先用手转动搅拌,观察搅拌器是否灵活顺当(不触玻璃壁,少声响)。
再开动电动搅拌器试转(先慢后快)。
搅拌器可正常旋转后,才能进行反应。
若搅拌器和搅拌器套管没套好,不能开电动搅拌器。
滴液也可从回流管上滴加。
FeCl 3不可加入太多否则影响产品的颜色。
滴加过氧化氢要慢,否则反应太激烈或加过氧化氢,滴完后再搅拌反应30min,可观察到白色沉淀生成。
(4)升温溶解固体,乘热转移至烧杯中,冷却,结晶,抽滤,洗涤。
有大量氯气产生而来不及吸收反应,使液体冲溅出。
若无沉淀产生可能是反应温度太高,或氯气挥发。
可降低温度或再加入适量的浓盐酸和过氧化氢。
实验名称:2,4 - 二氯苯氧乙酸的制备一、实验目的1、了解2,4-二氯苯氧乙酸的制备方法;2、复习机械搅拌,分液漏斗使用,重结晶等操作。
二、实验原理本实验遵循先缩合后氯化的合成路线,采用浓盐酸加过氧化氢和次氯酸钠在酸性介质中的分步氯化来制备2,4-二氯苯氧乙酸。
其反应式如下:1、ClCH223ClCH2COONa OH+NaOHOCH2COONaHClOCH2COOH 2、OCH2COOH+HCl+H2O2FeCl3OCH2COOHCl3、OCH2COOHCl +2NaOClHOCH2COOHCl Cl第一步是制备酚醚,这是一个亲核取代反应,在碱性条件下易于进行。
第二步是苯环上的亲电取代,FeCl3作催化剂,氯化剂是Cl+,引入第一个Cl。
2HCl + H2O2→Cl2 + 2H2O Cl2 + FeCl3→[ FeCl4 ]- + Cl+第三步仍是苯环上的亲电取代,从HOCl产生的H2O+Cl和Cl2O作氯化剂,引入第二个Cl。
HOCl + H+H2O+Cl HOCl Cl2O + H2O三、基本操作训练【操作步骤】(一)苯氧乙酸的制备1、成盐向0.8g氯乙酸和10mL水的混合液中慢慢滴加2mL饱和的Na2CO3溶液,调PH值到7-8,使氯乙酸转变为氯乙酸钠。
2、取代在搅拌下向上述氯乙酸钠溶液中加入0.5g苯酚,用35%NaOH溶液调PH值到12,并在沸水浴上加热20min。
期间保持PH为12。
3、酸化沉淀向上述的反应液中滴加浓HCl,调PH值至3-4,此时苯氧乙酸结晶析出。
经过过滤、洗涤、干燥即得苯氧乙酸粗品。
(二)对氯苯氧乙酸的制备0.6g苯氧乙酸粗品和2mL冰醋酸的混合液在水浴上加热到55︒C,搅拌下加入4mgFeCl3和2mLHCl。
在浴温升至60-70︒C时,在3min内滴加0.6mL33%H2O2溶液。
滴完后,保温10min,有部分固体析出。
升温重新溶解固体,并经过冷却、结晶、过滤、洗涤、重结晶等操作即得精品氯苯氧乙酸。
苯氧乙酸的合成原理苯氧乙酸是一种有机化合物,化学式为C8H8O3。
它可以通过乙酸与苯酚反应而合成。
具体的合成原理如下:首先,将苯酚与乙酸按照一定的比例混合,然后加入一定催化剂。
这个催化剂可以是一种酸性物质,如磷酸或硫酸等。
酸性催化剂的作用是加速反应的进行,提高反应速率。
在催化剂的作用下,苯酚分子中的羟基(-OH)与乙酸分子中的羧基(-COOH)发生酯化反应。
具体的反应机理可以简化为如下几个步骤:第一步,苯酚中的羟基接受乙酸分子中的羧基上的氢离子,生成一个中间物质——酯化中间体。
这个中间体由苯酚的一个氧原子、乙酸的一个氧原子和一个氢原子组成。
第二步,酯化中间体经历进一步的质子传递步骤。
即,质子从中间体的氧原子移动到苯酚的羟基氧原子上。
第三步,中间体中的氧原子上的质子再移动到乙酸分子的羧基氧原子上。
第四步,经过第三步的质子转移,生成的中间体中的氧原子形成一个O-C键,把苯酚和乙酸连接在一起,生成苯氧乙酸酯。
最后,通过加热反应混合物,除去剩余的水分和有害物质,得到最终的苯氧乙酸产物。
总之,苯氧乙酸的合成是通过苯酚与乙酸的酯化反应进行的。
在酸性催化剂的催化下,苯酚中的羟基与乙酸中的羧基发生质子转移,最终形成苯氧乙酸酯。
这个合成过程较为简单,但需要控制反应条件和催化剂的使用以提高反应速率和产率。
此外,该反应也可逆,所以需要进一步的操作以驱使反应向产物的方向进行。
总结起来,苯氧乙酸的合成分为以下几个步骤:混合苯酚和乙酸、加入酸性催化剂、进行酯化反应、除去剩余的水分和有害物质、得到苯氧乙酸产物。
这个合成原理不仅适用于苯氧乙酸,也适用于其他化学物质的酯化合成过程。
对氯苯氧乙酸的合成
一、 实验目的和要求
1、 掌握机械搅拌操作;
2、 学会对氯苯氧乙酸的合成方法;
3、 进一步熟悉亲核合成反应;
4、 熟练重结晶操作。
二、 实验内容和原理
对氯苯氧乙酸是植物生长调节剂的中间体,有许多合成方法,本实验采用Willamson 法进行合成。
反应方程式如下:
副反应:
222ClCH COOH + NaOH HOCH COONa+NaCl+H O →
碘离子是比氯离子更好的离去基团,能够明显地提高S N 2反应的反应速率和产率,因此,使用催化量的KI 是必要的。
在碱性条件下,苯酚生成苯酚负离子,可以明显提高它的亲核性,但在碱作用下,氯乙酸同样会发生水解反应,即被羟基负离子进攻生成副产物。
本实验采用先将一部分NaOH 与苯酚反应,生成苯酚负离子,再分别滴加剩余的碱和氯乙酸,以减少氯乙酸的水解,提高反应的产率。
主反应机理:
副反应机理:
三、 主要物料及产物的物理常数
OH
Cl
+
Na OH
H KI
−−−→−−→
OCH 2COOH
Cl
2ClCH COOH +
四、主要仪器设备
仪器100mL三口烧瓶;滴液漏斗;电热包(或油浴装置);机械搅拌器(或磁力搅拌器);球形冷凝管;吸滤装置;250mL烧杯;10mL量筒;50mL量筒;胶头滴管。
试剂对氯苯酚;氯乙酸;20%NaOH;碘化钾;1:1盐酸;95%乙醇;pH试纸。
五、操作方法和实验步骤
实验装置图:
六、 实验结果与分析
重结晶前的粗产物质量为11.72g ,粗产率为
11.72100%124.2%6.50186.59/128.56/m g
m g
g mol
M g mol
M ⨯=
=⨯粗产品
对氯苯酚
对氯苯氧乙酸
对氯苯酚
粗产率超过100%,显然其中混有大量杂质。
根据实验过程分析,由于未趁热加酸,导致酸化不充分,粗产品抽滤时没有充分洗涤,这两个原因导致产物中混入大量对氯苯氧乙酸盐杂质。
重结晶提纯的产物经干燥后质量为4.76g ,产率为
4.76100%50.5%6.50186.59/128.56/m g
m g
g mol
M g mol
M ⨯=
=⨯产物
对氯苯酚
对氯苯氧乙酸
对氯苯酚
提纯干燥产物的熔程两次测量分别为155.6℃~157.0℃,155.7℃~157.2℃,平均为155.6℃~157.1℃,比文献值157℃~159℃偏低,分析其原因可能为混入脱羧产物或(和)乙醇,或者干燥不充分所致。
七、 思考题
1、 为什么要在搅拌下滴加氯乙酸?
答: 防止氯乙酸的瞬时浓度过大增加副反应的发生。
2、 为什么将对氯苯酚先溶于NaOH 溶液中,作用何在?
答:在碱性条件下,苯酚生成苯酚负离子,可以明显提高它的亲核性,但在碱作用下,氯乙酸同样会发生水解反应,即被羟基负离子进攻生成副产物。
本实验先将对氯苯酚溶于NaOH 溶液中,生成对氯苯酚负离子,再分别滴加剩余的碱和氯乙酸,以减少氯乙酸的水解,提高反应的产率。
八、 讨论、心得
1、 实验操作注意点
(1) 试管中的对氯苯酚加入适量NaOH 溶液适当加热后倒出,然后用少量NaOH 溶液洗涤试管。
(2)氯乙酸稍过量可以提高反应产率,但同时也会增加副反应的发生,因此过量应适当。
另外,在稍过
量的同时提高了氯乙酸溶液的浓度。
滴加时,先滴加几滴NaOH,使它和对氯苯酚反应生成对氯苯酚负离子,再滴加几滴氯乙酸,这样可以降低副反应发生的可能。
(3)在时间允许的情况下,适当延长加热回流的时间可以大大地提高产率,据文献报道,反应2~2.5h
产率可以高达95%。
(4)盐酸滴加速度可以稍慢,同时要注意不断搅拌,使其充分发挥酸化作用。
适当延长酸化时间也可提
高产率。
酸化不完全会大大降低产率,并引入大量对氯苯氧乙酸盐杂质,给下一步重结晶带来困难。
(5)冰水的迅速冷却虽然得到细小的晶体,但可以提高粗产率。
如要得到更好的晶体,可以在重结晶一
步采取保温冷却的方法。
(6)抽滤得到粗结晶后,一定要用冰水充分洗涤,将被对氯苯氧乙酸黏附或包裹的盐杂质全部除去,否
则重结晶时加入过量乙醇也不能完全溶解,加大操作难度,又会导致产物损失。
(7)粗产物用乙醇溶解回流时,若温度过高,会使羧酸脱羧,产生颜色,因此最好用油浴回流,并且温
度控制在乙醇的沸点78℃以下。
(8)重结晶后抽滤时,要用冰水洗净产物中的乙醇,否则会使产物的纯度下降,测定的熔点也会下降。
(9)最后一步冷却要缓慢进行,最好用保温冷却,确保产生好的晶形。
另外,如果乙醇-水混合溶液中
有较多的对氯苯氧乙酸盐杂质,最好不要采用冰水浴冷却,防止盐杂质析出。
(10)在包晶体的纸上可以看到有挥发出来的油状物,推断可能是乙醇溶解回流时的脱羧产物,它在产物
中的存在会使产物的熔点下降,因此,延长干燥时间,使油状物完全除去,可以提高产物的纯度。
2、实验方法改进及其他合成方法
(1)提高溶剂NaOH的浓度可以缩短反应时间,例如用30%或50%的NaOH溶液做反应溶剂。
(2)除KI以外,氯化三乙基苄基铵( TEBA)、聚乙二醇-600(PEG-600)、四丁基溴化铵(TBA)也可用作此
合成反应的催化剂,其中以TEBA为催化剂时产率最高。
参考文献:《对氯苯氧乙酸合成工艺的改进》,河北医科大学药学院,张忠敏、张二巧、郝存书、张敬革。