人教版九年级上册 第三单元 课题2 原子的结构 第2课时 离子 教学设计
- 格式:docx
- 大小:26.34 KB
- 文档页数:4




原子的结构究与交问题1离子如何形成的?什么是离子?阳离子?阴离子?问题2 离子符号书写常见的离子阳离子Na+ Ca2+ Mg2+ Al3+ H+NH4+阴离子Cl- O2- OH- NO3-SO42 - CO32-问题3 粒子结构示意图观看flash动画,化抽象为直观。
形象理解钠离子和氯离子的形成过程。
再借助图表模型,加深对离子形成的理解。
知道离子也是构成物质的一种粒子。
在上述过程中,钠原子因失去1个电子而带上1个单位的正电荷;氯原子因得到1个电子而带上1个单位的负电荷。
这种带电的原子或原子团叫离子。
(带电的粒子叫离子)带负电的离子为阴离子。
带正电的离子为阳离子。
诊断练1.某粒子由12个质子、12个中子和10个电子构成,该粒子是(D )A.分子 B.原子 C.阴离子 D.阳离子2.下列对分子、原子、离子的认识,正确的是( B )A. 原子是最小的粒子,不可再分B.温度越高,分子运动速率越快C. 离子不能直接构成物质D. 固体难压缩,说明固体分子间无间隔3.下图中是钠原子结构示意图.下列说法错误的是( D )习A.钠的原子序数为11 B.钠原子核外有3个电子层C.钠原子最外层电子数为1 D.化学反应中,钠原子易得电子4.某粒子最外电子层为M层(即第三层),该电子层上有8个电子,则它一定不属于下列粒子中的(B )A.稀有气体原子 B.非金属原子C.阴离子 D.阳离子5.下列微粒中,最外电子层不是稳定结构的是( B )A.氖原子 B.氯原子C.钠离子 D.硫离子6.下列结构示意图表示的粒子中,属于离子的是( C )A B C D7.钠原子与钠离子的符号分别为 Na 和 Na+;它们的化学性质不相似 (填“相似”或“不相似”)。
8.科学家在宇宙深处发现了H3+离子和H3分子。
请回答:(1)1个H3+ 离子含有 3 个质子 2 个电子;(2)构成了H3分子的原子的结构示意图是;。

课题2 原子的结构一、教学背景和地位:第三单元教材是"双基"的重要组成部分,本单元教材对于学生十分重要,它既是今后学习的理论基础,又是必不可少的化学学习工具,是初中能否学好化学的第一道"分水岭"。
通过本节课的学习,可为学生从微观的角度探究宏观物质变化的奥秘打开一扇窗口;使学生对物质的微观构成有一个大体轮廓。
二、教学课题物质构成的奥秘是初中化学的重要内容之一,原子的构成又是学生对微观世界的第二次接触。
本课题主要是在学生学习分子、原子的概念的基础上深入探究离子的形成及介绍相对原子质量。
为了对学生进行爱国主义教育,介绍为相对原子质量的测定做出卓越贡献的我国科学院院士X青莲教授。
三、教学设计思路原子核外电子的排布,特别是离子的知识,是为了进一步学习化合价和化学式打基础,特别是构成物质的粒子在前面我们学习的有分子、原子,在此基础上我通过原子结构的稳定性引出离子,从而引出构成物质的粒子还有离子。
我在教学中根据新课程标准,采取多种教学手段,课件、白板、视频动画等。
教学程序上采取老师提问--小组讨论--表达交流--老师和学生共同总结,最后通过测试反馈来完成教学。
处在网络时代的学生大多数很喜欢上网,于是我就投其所好,利用多媒体课件演示动画,模拟微观变化,帮助学生认识离子的形成过程和学会离子的符号表示。
这样不但能顺利突破本节课的难点,也促进了学生微观思维能力的发展。
四、教学目标【知识与技能】1、知道原子核外电子的分层排布规律,能画出1-18号元素的原子结构示意图。
2、以氯化钠为例,了解离子的形成的过程。
知道里是构成物质的一种粒子。
3、知道相对原子质量的含义,并学会查相对原子质量表。
【过程与方法】1、了解化学在宏观物质与微观粒子之间建立联系的途径和特点。
2、体验“发现问题(矛盾)——实验现象分析——建立模型——解释现象”过程,初步应用有现象到本质、宏观与微观相结合的思维方法。
【情感态度与价值观】1、逐渐树立世界是物质的、物质是可分的这一辩证唯物主义观点。
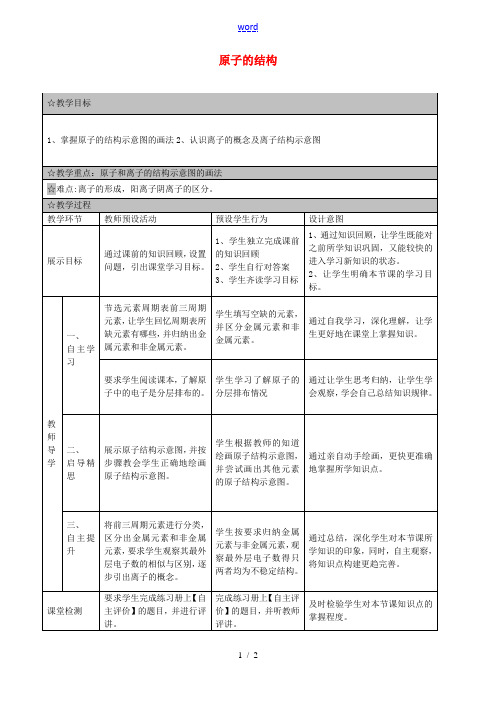
第三单元物质的微观构成课题2原子的结构(课时2)课型:授课时间:【教学目标】1.知识与技能:以氯化钠为例,了解离子形成的过程;认识离子结构示意图;会写离子结构示意图和离子符号;2.过程与方法:通过播放氯化钠的形成过程的动画,培养学生观察和分析问题的能力。
3.情感、态度与价值观:培养的抽象思维的能力、想象力和分析、推理能力。
【教学重难点】离子的形成和表示方法。
【教学过程】一、知识回顾1.原子是由居于原子中心的原子核和核外电子构成的。
原子核是由质子和中子构成的。
每个质子带1个单位正电荷,每个电子带1个单位负电荷,中子不带电。
2.原子中:核电荷数 = 质子数 = 核外电子数 = 原子序数3.画出钠原子的原子结构示意图,并说明各部分表示的含义:①圆圈表示原子核;②圆圈内+表示原子核带正电荷;③圆圈内的数字表示质子数;④弧线表示电子层数;⑤弧线上的数字表示该层上的电子数。
二、自主预习(阅读课本55页)1.原子的相对稳定结构是指:最外层有8个电子的结构为相对稳定结构(氦为2个电子)。
2.原子的定义:带电的原子或原子团叫做离子。
带正电的离子叫做阳离子,带负电的离子叫做阴离子。
3.离子的形成:原子得电子或失电子形成离子。
原子失电子形成阳离子,带正电;原子得电子形成阴离子,带负电。
三、探究一钠在氯气燃烧,钠原子和氯原子是如何达到稳定结构的?请画出钠原子和氯原子得失电子后形成的新的粒子的结构示意图:个性化设计为了让学生更好地理解离子的形成过程,播放氯化钠形成的动画,然后让学生讨论:要趋于稳定结构,钠原子和氯原子该如何变化来达到稳定呢?学生可能设计出很多种方案,师生一起分析可能性。
也可由几位学生来表演,扮演不同的原子。
然后让学生去寻找自己的朋友,交友的目的是能让自己变成稳定结构。
例如让钠原子在一群原子中寻找朋友,找到氯原子,然后双方交换电子,变成好朋友。
这样的活动能大大激发学生的学习探究二离子的形成(思考并回答)1.金属元素、非金属元素的原子结构是否为稳定结构?最外层电子数有何特点?3.金属元素和非金属元素的原子怎样才能达到稳定结构?(举例说明钠、铝、氧、氯原子怎么达到稳定结构)结论:离子的形成是原子得失电子的结果。
九年级化学教学设计域,也就是说核外电子是分层运动的。
在化学上,各电子层的层序数n 依次为1、2、3、4、5、6、7,分别称为K 、L 、M 、N 、O 、P 、Q 电子层。
[板书] 核外电子分层排布:按照电子能量的高低,由里向外排列。
(空间层次由里向外,电子能量由低到高)[提问]既然核外电子是分层排布的,那么核外电子排布先排能量低的电子层,还是先排能量高的电子层?科学家通过研究发现,核外电子排布先排能量低的电子层,这样电子的能量较低。
[板书讲解]:核外电子排布的一般规律。
(1)电子在原子核外排布时,总是尽量先排在离核最近(能量最低)的电子层里,然后由里向外,依次排布在能量较高的电子层里。
即最先排布K 层,当K 层排满后,再排L 层……[提问]写出1—18号元素的原子结构示意图,并带着问题仔细观察:这18种元素,它们的原子核外的每一个电子层中,所容纳的电子数有什么规律?(ppt 展示)(2)每一电子层,最多填充的电子数为2n 2个(n 为电子层序数)。
[投影]表格:稀有气体元素原子核外电子排布元素 各电子层容纳的K L 氦 2 氖 2 8 氩 2 8 氪 2 8 氙 2 8 氡 2 8学生思考、讨论学生仔细找规律,而后回答学生思考、讨论(3)最外层电子数都不超过8个(K层不超过2个)。
[讲解]:像稀有气体元素原子(除氦以外,最外层电子达到8个电子的这种结构,我们称为稳定结构。
那也就是说没达到8个电子的就属于不稳定结构,不稳定结构又包括那些情况呢?[引导]观察1—18号元素的原子的汉字名称在造字结构上的规律,我们可以看到有金属原子,非金属原子,大家仔细看一下它们最外层电子数有什么规律?[总结]金属元素的原子最外层电子数一般小于4;非金属元素的原子最外层电子数一般大于4。
【小知识】物质都有趋向于稳定状态的特点(如:水往低处流;树上的苹果往下掉)。
原子也不例外,也有趋向于稳定结构的特点。
我们来看看怎么趋向于稳定。
第2课时原子核外电子的排布离子【基础主干落实】一、原子核外电子的排布1.原子核外电子的排布规律2.原子结构示意图:各部分的含义(以钠原子为例)3.原子的性质与最外层电子数的关系原子种类最外层电子数得失电子趋势化学性质稀有气体的原子8个(氦为2个) 难得失电子稳定金属的原子一般少于4个易失去电子不稳定非金属的原子一般多于4个易得到电子不稳定特别提醒元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关。
二、离子1.概念:是带电的原子(或原子团)。
2.离子的分类(1)阳离子:带正电的原子(或原子团)。
(2)阴离子:带负电的原子(或原子团)。
3.离子符号的意义(以镁离子为例)特别提醒由离子构成的物质中,物质本身不显电性。
【交流讨论】最外层电子数相等的原子,化学性质一定相似吗?提示:不一定。
如镁原子与氦原子的最外层电子数都是2,镁原子在化学反应中易失去2个电子,而氦原子化学性质稳定,不易得失电子。
【漫画助学】根据质子数与核外电子数的关系可确定微粒的种类。
【重点案例探析】考点粒子结构示意图的识别及应用【典题】(2023·呼伦贝尔二模)如图是几种粒子的结构示意图。
下列说法不正确的是(D)A.④在化学反应中易失去电子B.①与③的化学性质相似C.①在反应中形成的离子符号是O2-D.②和⑤是有相对稳定结构的原子【易错提醒】(1)具有稳定结构的粒子,核外只有一个电子层时,最外层电子数为2。
(2)具有稳定结构的粒子不一定都是稀有气体原子,也可能是原子得失电子后形成的离子。
(3)原子得失电子形成离子后,由于电子数及最外层电子数不同,化学性质也就不同。
【举一反三】1.(结构模型)(2023·菏泽中考改编)模型建构是化学科学研究的基本方法。
如图是某同学绘制的原子结构模型和原子结构示意图,有关说法正确的是 (A)A.③形成的阳离子符号是H+B.①②属于同类原子C.①对应的原子结构示意图是④D.②在化学反应中易失去电子2.(结构变化)(2023秋·河池凤山期中)如图所示,用粒子结构示意图表示粒子,按要求填空:(1)当粒子表示原子时,x=10(填“>”“<”或“=”);(2)当x>10时,粒子表示阳离子(填“原子”“阳离子”或“阴离子”);(3)当粒子带2个单位正电荷时,x=12,离子符号为Mg2+。
离子
一、教学目标:
1、知识与技能:
(1)初步了解原子核外的电子是分层排布的;
(2)了解原子结构的表示方法;
(3)了解原子结构与元素化学性质的关系;
(4)了解离子的形成过程,认识离子是构成物质的一种粒子。
2、过程与方法:
(1)通过学生间相互讨论、交流,增强学生归纳知识、获取知识的技能;
(2)运用多媒体动画片、课文插图等辅助手段,演示离子的形成过程,化抽象为直观,增强学习效果。
3、情感、态度与价值观:
(1)初步体会物质构成的奥秘,培养学生抽象思维能力、想象力和分析推理能力;
(2)树立“结构决定性质”、“物质的微粒性”等辩证唯物主义观点。
二、教学重难点:
重点:离子的形成。
难点:核外电子排布的概念。
三、教学过程:
创设问题情境,从巩固已
培养学生的阅读、总结
自然
究竟是怎样
号元素中哪些是金属元素、
由于金属元素、非金
板书设计
课题2 原子的结构
一、核外电子的排布
1、排布规律:分层
2、原子结构示意图:
3、决定元素的化学性质:最外层电子数
4、离子的形成
离子的表示。
课题2 离子
教学目标
1.知识与技能
(1)初步了解原子核外的电子是分层排布的;
(2)了解原子结构的表示方法;
(3)了解原子结构与元素化学性质的关系;
(4)了解离子的形成过程 ,认识离子是构成物质的一种粒子。
2.过程与方法
(1)通过学生间相互讨论、交流 ,增强学生归纳知识、获取知识的能力;
(2)运用多媒体动画片、课文插图等辅助手段 ,演示离子的形成过程 ,化抽象为直观 ,增强学习的效果。
3.情感、态度与付值观
(1)初步体会物质构成的奥秘 ,培养学生的抽象思维能力、想像力和分析推理能力;
(2)树立“结构决定性质〞、“物质的粒子性〞等辩证唯物主义观点。
教学重点难点
重点:离子的形成。
难点:核外电子排布的规律。
课时安排
1课时
教与学互动设计
(一)创设情境 ,导入新课
[谈谈]原子的结构
[体验]画出原子结构草图
(二)复习回忆 ,课前热身
1.构成原子的粒子有质子、中子、电子三种。
2.质子和中子构成原子核 ,居于原子的中央 ,带正电 ,电子带负电 ,绕原子核作高速运动。
3.指出以下原子核外电子数:
H 1 ,O 8 ,Na 11 ,S 16 ,Mg 12 ,He 2 ,Ar 18 。
(三)合作交流 ,解读探究
二、核外电子的排布
活动1:
[讨论]核外电子的运动是否如同学们所画的?
[归纳]核外电子运动是否像行星绕太阳旋转有固定的轨道 ,但却有经常出现的区域。
[提示]核外电子运动经常出现的区域叫电子层。
[设问]核外所有电子是杏都经常出现在同一区域?
[点拨]核外电子就像人一样 ,小时候完全靠父母 ,随着年龄 ,对父母的依赖程度小。
那么电子由于能量各不同 ,所以其运动的区域离核有远有近。
[提示]能量低 ,离核近 ,能量高 ,离核远。
活动2:
[体验]核外电子在不同电子层内运动的现象说明什么问题?
[归纳]核外电子是在不同的电子层内运动的 ,这种现象叫做核外电子的分层排布。
[提示]1.元素的原子核外电子最少的有1层 ,最多的有7层。
2.离核最远 ,能量最高的电子层叫最外层。
[明确]各原子的最外层可能不相同。
[小结]电子层:一二三四五六七
能量:低……→高
离核:近……→远
活动3:
[提问]稀有气体化学性质表现如何?
[归纳]稀有气体化学性质稳定 ,难与其他物质反响。
[设问]稀有气体元素的原子最外层电子数有何特点?
[投影]1-20号元素的原子最外层电子数。
[交流]稀有气体元素的原子最外层电子数一般为8个。
[提示]假设第一层为最外层 ,那么为2个。
[点拨]原子最外层电子数最多不超过8个。
[归纳]稳定结构:原子最外层电子数到达8个(假设第一层为最外层 ,到达2个)的结构。
活动4:
[操作]请同学们根据上述知识画出氢、氧原子的结构草图。
[讨论]该图是否表示出原子核及其带的电荷数、核外电子的运动。
[归纳]化学上把表示原子结构的图形叫原子结构示意图。
活动5:
[讨论]以氧原子为例 ,答复图中各局部的意义。
[归纳]原子结构示意图的意义:
二、离子的形成
活动6:
[投影]1~20号元素原子结构示意图
[讨论]哪些属于金属元素、非金属元素、稀有气体元素?
三类元素的原子的最外层电子数特点及其结构是否稳定?
三类元素的原子在反响中怎样使其结构稳定?
[归纳]
[小结]元素的性质特别是化学性质 ,与原子的最外层电子数关系最密切。
活动7:
[设问]原子得失电子的结果是怎样的?
[课件演示]动画:氯化钠的形成
[归纳]1.带电荷的原子或原子团叫做离子 ,分为阳离子和阴离子两种。
2.阴、阳离子由于静电作用而形成不带电性的化合物。
离子也可构成物质。
活动8:
[讨论]如何表示离子?
[归纳]离子符号的书写:
先写元素或原子团符号 ,然后在符号右上方先标电荷数值(数值为“1〞时省略) ,后标“+〞“-〞号。
[提问]2Mg2+中数字“2〞表示何意义?
[归纳]元素符号右上方的数字:一个离子带的电荷数。
离子符号前面的数字:离子的个数。
活动9:
[议一议]原子和离子的比拟
[小结]1.不同点:
①原子结构一般不稳定(稀有气体除外);而离子结构稳定。
②原子不显电性 ,离子带电。
[拓展]假设单核粒子中质子数等于核外电子数 ,那么该粒子为原子;
假设单核粒子中质子数大于核外电子数 ,那么该粒子为阳离子;
假设单核粒子中质子数小于核外电子数 ,那么该粒子为阴离子。
③原子在化学反响中不变 ,离子可能变。
[点拨]带电的原子团这类离子在化学反响前后可能变。
④原子用元素符号表示 ,离子用离子符号表示。
2.相同点(联系):
①都能构成物质 ,保持物质化学性质。
活动10:
[想一想]元素、分子、原子、离子、物质间的关系。
[归纳]
[明确]构成物质的粒子有分子、原子、离子三种。
(三)应用迁移 ,稳固提高
[投影]
1.以下粒子结构示意图中 ,表示具有稳定结构的原子的是 ( C )
2.下面是几种粒子的结构示意图:
①A~E共表示四种元素;②表示原子的粒子是 B、C (填序号 ,下同);③表示阴离子的粒于是 A、D ;
④表示阳离子的粒子是 E ;⑤表示相对稳定结构的粒子是 A、D、E ;⑥在化学反响中易失去电子的粒子是
B 。
3.钠原子和钠离子的结构示意图如下:请答复:
(1)由于它们的原子核内质子数相同;所以它们都属于钠元素。
(2)钠原子和钠离子的化学性质不相同(填“相同〞或“不相同〞)。
(四)总结反思 ,拓展珏伸
[总结反思]本课学习核外电子的分层排布和离子的形成。
启示:.比拟、归纳是学习化学根本概念的较好方法。
[拓展延伸]
1.M元素原子的核电荷数为A ,它的阳离子M n+与N元素的阴离子N m-核外电子排
布相同 ,那么N元素原子核内质子数为 ( C )
A.m+n+a B.m+n-a
C.a-n-m D.a+m-n
[解析]原子失电子变为阳离子 ,得电子变为阴离子 ,且原子中质子数=核外电子数。
2.对于“具有相同质子数的粒子〞 ,以下表达正确的选项是 ( C )
A.一定具有相同的电子数 B.不一定是由同种元素组成的粒子
C.可能是原子和分子 D.一定是同种元素的粒子
[解析]具有相同质子数的粒子可能是同种元素的粒子如:S、S2- ,也可能是原子和分子如:Ne、H2O等。
(五)课堂跟踪反响
夯实根底
1.以下变化中 ,最小粒子是原子的是 ( D )
A.水受热后汽化 B.贮氮气的钢瓶受热爆炸
C.氧气溶解于水 D.水电解生成氢气和氧气
2.三种元素的粒子X m-、Y n+、Z p+都有相同的电子层结构 ,n>p ,那么它们的核内质子数(依次用X、Y、Z 表示)关系为 ( B )
A.X=Y=Z B.Y>Z>X
C.X>Z>Y D.Z=Y>X
3.以下粒子示意图中 ,表示+2价阳离子的是 ( C )
4.以下粒子中 ,属于同种元素的是 ( C )
A.①② B.①④
C.②③ D.③④
5.以下粒子结构示意图中 ,表示原子的是 ( B )
6.以下粒子的结构示意图中 ,表示阳离子的是 ( C )
7.某元素负2价阴离子的结构示意图如下图 ,那么该元素原子所含的质子数为 ( B )
A.6 B.8
C.10 D.12
8.(2019长沙市)以下粒子在化学反响中容易失去电子的是 ( A )
9.(2019山西省)以下粒子结构示意图 ,表示具有稳定结构的原子的是 ( C )
提升能力
10.(2019吉林省)以下关于分子、原子、离子的说法 ,正确的选项是 ( C )
A.原子是微小的实心球体 ,可以再分
B.单个SO2分子有刺激性气味
C.纯洁的氢气在氧气中完全燃烧后 ,生成的物质是由同一种粒子构成
D.离子是原子失去电子后生成的粒子
11.某元素的原子结构示意图为有关该元素的说法错误的选项是 ( D )
A.原子的核内质子数为16 B.原子的核外有3个电子层
C.原子的最外层电子数为6 D.属于金属元素
12.对Fe3+、Fe2+、Fe三种粒子的判断 ,正确的选项是 ( C )
①核电荷数相同②核外电子数相等③电子层结构完全相同④质量几乎相等⑤等质量的三种粒子所有的质子数相等
A.①②③④⑤ B.①③⑤
C.①④⑤ D.②③④
13.某元素的一种粒子结构示意图如下图 ,那么该元素的原子最外层电子数为 ( A )
A.1 B.2
C.8 D.10
开放探究
14.表示M2+粒子结构示意图的是 ( B )
15.2019年科学家在宇宙深处发现了H3+离子和H3分子。
请答复:
(1)1个H3+离子中含有 3 个质子 , 2 个电子。
(2)构成H3分子的原子的结构示意图是 C (填序号)。
(3)H3属于单质 (填“混合物〞、“单质〞或“化合物〞)。