碱金属腐蚀分析
- 格式:docx
- 大小:63.42 KB
- 文档页数:16

生物质锅炉高温过热器腐蚀原因分析及对策一、腐蚀原因分析1. 燃料成分生物质燃料中含有的灰分、硫分、氯分、碱金属等成分是高温过热器腐蚀的主要原因之一。
灰分中的硅酸盐、氧化铁等物质对过热器材料具有一定的腐蚀作用,而硫分则容易形成腐蚀性气体,如硫化氢、二氧化硫等。
氯分和碱金属也会对材料表面产生腐蚀破坏。
2. 燃烧温度生物质锅炉燃烧温度过高或不稳定会导致过热器的温度过高,使得材料受热和冷却的变化频繁,容易导致高温过热器材料的腐蚀破坏。
渣沉积、灰尘和燃料燃烧不完全等问题也会导致燃烧温度不稳定,从而加剧高温过热器的腐蚀程度。
3. 氧化腐蚀在生物质锅炉的高温过热器中,空气中的氧与金属表面的水蒸气和氧化物反应,会产生氧化腐蚀。
当燃料中含有硫分时,还容易形成硫酸腐蚀现象。
4. 结构设计生物质锅炉高温过热器的结构设计也会影响其腐蚀情况。
如过热器管道的焊缝处和弯头处易发生应力集中,容易导致腐蚀的加剧。
5. 操作维护生物质锅炉的操作维护情况也直接影响高温过热器的腐蚀程度。
如果操作不当或维护不到位,会导致锅炉燃烧不良,渣沉积过多,烟气中含有酸性物质,进而引发高温过热器的腐蚀问题。
二、对策措施1. 选择适合的材料在设计生物质锅炉高温过热器时,应选择耐高温、抗腐蚀的优质材料。
一般情况下,高温过热器管道材料常采用优质碳素钢、合金钢等材料,并在需要时进行防腐处理,以增加其抗腐蚀能力。
对于生物质燃料的选择和处理要求,尽量降低灰分、硫分、氯分和碱金属的含量。
通过科学的燃料混合、燃烧调节等方式,减少燃料中有害成分对高温过热器的腐蚀影响。
合理控制生物质锅炉的燃烧温度,保持其在安全范围内稳定燃烧,避免燃烧温度过高或波动过大,减少高温过热器受热和冷却的变化频率,降低腐蚀程度。
通过在燃烧室设置适当的氧化物吸附剂、喷洒保护层、控制氧量等方式,防止氧化腐蚀的发生,增加高温过热器的使用寿命。
及时清理渣沉积、灰尘和污垢,定期对生物质锅炉进行检测监控,确保燃烧处于最佳状态,防止燃烧温度不稳定等问题,减少高温过热器的腐蚀风险。

碱金属对原燃料的影响1恶化焦炭冶金性能。
碱金属首先吸附在焦炭的气孔,而后逐渐向焦炭内部的基质扩散,随着焦炭在碱蒸汽内暴露时间的延长,碱金属的吸附量逐渐增多。
向焦炭基质部分扩散的碱金属会侵蚀到石墨晶体内部,破坏了原有的层状结构,产生层间化合物。
当生成层间化合物时,会产生比较大的体积膨胀,导致焦炭强度下降,块度减小,产生较多碎焦和粉末。
不同碱量条件下测定的焦炭反应性及反应后强度结果表明,加入钾、钠浓度增加后,焦炭的反应性增加,而且钾、钠浓度越高,反应性越大。
这说明钾、钠对焦炭的碳溶反应起正催化作用,而且钾的催化作用高于钠。
有关资料测定表明焦炭含K2O量每增加1%,反应性增加8%,焦炭反应后强度降低9.2%。
同时,高炉冶炼统计表明,碱负荷每增加1kg/t,焦比平均上升18.75kg/t。
2碱金属对烧结矿的影响2.1碱金属对还原性的影响烧结矿的还原度均随烧结矿含碱量(K2O)的增高而提高,但随着含碱量的进一步增加,烧结矿的还原度提高幅度较小。
碱金属能促进烧结矿还原的原因:一是碱金属对还原反应的催化作用,二是碱金属能增加烧结矿的气孔率。
.2.2碱金属对还原粉化率的影响碱金属使烧结矿中温还原粉化率倍增的原因是:一是在还原过程中,碱金属会进入氧化铁的晶格。
当还原到FeO时,碱金属大量进入FeO晶格,由于碱金属对还原反应的催化作用,使该区域的金属铁晶体生长较快,在相界面上产生应力,当应力积累到一定程度,便产生大量的裂纹,导致粉化率升高;二是在还原过程中会发生含钾矿物中钾元素的迁出与再集中,迁出的钾(或游离的钾)与硅铝等元素结合,生成钾铝硅酸盐,由于析晶困难,往往形成一些超显微的结晶,晶化愈强,结构也会更加疏松。
2.3碱金属对烧结矿软熔性能的影响烧结矿少量碱金属可以提高烧结矿的软熔温度,使软熔带下移,但是碱金属含量过多时,会使软熔带温度区间变宽而不利于高炉冶炼。
3碱金属对球团矿的影响碱金属是球团矿产生异常膨胀的重要原因。

生物质锅炉高温过热器腐蚀原因分析及对策生物质锅炉高温过热器是一种用于提高锅炉燃烧效率和节约能源的重要设备。
由于生物质燃烧产生的高含硫、高氯等特点,高温过热器容易出现腐蚀问题。
本文将对生物质锅炉高温过热器的腐蚀原因进行分析,并提出相应的对策。
一、腐蚀原因分析1.1 氯化物侵蚀:生物质燃烧中含有较高的氯元素,氯化物在高温条件下会生成氯化氢和氯化物,这些物质会对过热器材料产生腐蚀作用。
氯化物腐蚀主要发生在过热器的管壁和烟道灰积处。
1.2 硫酸侵蚀:生物质中的硫元素主要以硫酸盐的形式存在,当硫酸盐在高温环境下吸附在过热器材料表面时,会形成硫酸膜,并与空气中的水蒸气反应生成硫酸,导致高温过热器腐蚀。
1.3 碱金属侵蚀:生物质中的钾、钠、钙等碱金属元素在高温环境下易产生熔融、挥发和形成高温腐蚀物质,对高温过热器材料的腐蚀作用是较为严重的。
二、对策及措施2.2 设计合理的结构:合理设计过热器结构,采取防止腐蚀的措施,如增加防腐涂层、增加材料的厚度等。
应确保过热器的设计和制造符合相关规范和标准,提高过热器的稳定性和可靠性。
2.3 控制燃料的硫含量:选择低硫含量的生物质燃料,如秸秆、麦秸等,减少生物质燃烧产生的硫酸盐,从源头上减少硫酸侵蚀。
2.4 净化燃烧气体:在锅炉设计中加入净化系统,如干式除尘器、湿式除尘器、脱硫装置等,减少氯化物、硫酸盐等有害物质对过热器的侵蚀。
2.5 增加氯的吸附:可在过热器中增加氯的吸附剂,如活性炭等,吸附和还原氯化物,减少对过热器的侵蚀。
2.6 加强监测与维护:加强对生物质锅炉高温过热器的监测与维护工作,定期进行巡检、清洗和维护,发现腐蚀问题及时处理,确保过热器的正常运行。
三、总结生物质锅炉高温过热器腐蚀问题是生物质锅炉运行过程中需要重视的一个问题,通过分析腐蚀原因并采取相应的对策和措施,可以有效地减少过热器的腐蚀问题,提高生物质锅炉的运行效率和寿命。
在实际操作中,还需要结合具体锅炉运行情况和生物质燃烧特点,制定适合的腐蚀防治方案,不断优化和改进生物质锅炉的设计和运行管理。

金相腐蚀原理
金相腐蚀是一种将金属试样浸泡在腐蚀试剂中,通过化学反应使金属表面发生变化的方法。
金相腐蚀试验常用于金属材料的质量控制和性能评估。
金相腐蚀的原理主要涉及金属试样与腐蚀试剂之间的化学反应。
金属试样表面的金属离子会与腐蚀试剂中的化学物质发生反应,形成各种化合物或溶解。
这些反应可以根据试剂的成分和试验条件的不同而产生不同的腐蚀效果。
金相腐蚀试验常用的试剂有酸性溶液、碱性溶液和盐酸等。
例如,盐酸可以与金属试样表面的氧化层发生反应,生成金属盐和水。
酸性溶液中的氧化剂可以直接与金属表面发生反应,形成氧化物。
而碱性溶液则可以溶解金属表面的氧化物,将金属试样表面还原为金属。
金相腐蚀试验时,常使用显微镜观察金属试样表面的形貌变化、孔洞、裂纹等微观结构的变化。
通过观察这些微观结构的变化,可以评估金属材料的耐腐蚀性能和结构特征。
金相腐蚀试验可以帮助人们了解金属材料的腐蚀行为,评估其在特定环境下的抗腐蚀能力,为金属材料的选用和使用提供科学依据。
此外,金相腐蚀还可以用于金属材料的缺陷检测和损伤分析,有助于改善金属制品的品质和性能。
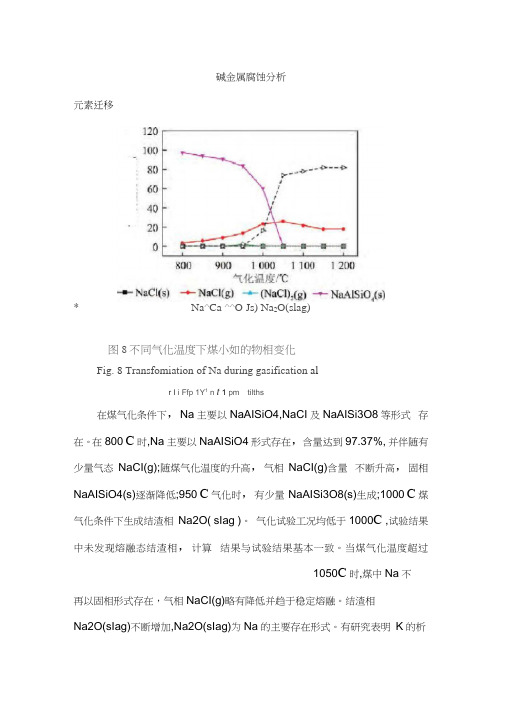
碱金属腐蚀分析元素迁移* Na^Ca ^^O Js) Na2O(slag)图8不同气化温度下煤小如的物相变化Fig. 8 Transfomiation of Na during gasification alr I i Ffp 1Y1 n t1 pm tilths在煤气化条件下,Na主要以NaAISiO4,NaCI及NaAISi3O8等形式存在。
在800 C时,Na主要以NaAISiO4形式存在,含量达到97.37%, 并伴随有少量气态NaCI(g);随煤气化温度的升高,气相NaCI(g)含量不断升高,固相NaAISiO4(s)逐渐降低;950 C气化时,有少量NaAISi3O8(s)生成;1000 C煤气化条件下生成结渣相Na2O( sIag )。
气化试验工况均低于1000C ,试验结果中未发现熔融态结渣相,计算结果与试验结果基本一致。
当煤气化温度超过1050C时,煤中Na不再以固相形式存在,气相NaCI(g)略有降低并趋于稳定熔融。
结渣相Na2O(sIag)不断增加,Na2O(sIag)为Na的主要存在形式。
有研究表明K的析出特性与Na相似,只是K的析出强度比Na大一个数量级。
氯化钠是煤中钠的主要形式,在燃烧与气化过程中会挥发出来,而钾与钠不同,主要存在于不挥发的铝硅酸盐中,然而钾也能从铝硅酸盐中释放出来,并通过和氯化钠蒸汽发生交换反应后以氯化钾的形式出现。
有研究表明,随煤种氯含量增加,钾释放量增加。
在煤中,碱金属钾钠两种存在状态都有,有机物是以阳离子形式与羟基结合形态存在;无机物或以水溶性盐的形式存在,或可能与硅酸盐结合在一起存在。
低阶煤中,钠主要以有机化合物形式存在,高阶煤中,钠则以水溶性的有机化合物形式存在。
此外它还可能以与硅铝酸盐结合形成如Na2 • AI2O3 • (SiO2)6的形式存在。
而钾主要是以K2O- (AI2O3)3 • (SiO2)6 • H2O 和K2O- AI2O3 - (SiO2)6 的硅铝酸盐形式存在。

碱金属的反应性碱金属是指周期表第一族元素中的锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和銣(Fr)。
这些金属具有共同的特点,即在标准条件下,它们均为银白色固体,具有低密度、低熔点和极强的反应性。
本文将深入探讨碱金属的反应性,包括与水、氧气和其他非金属元素的反应。
一、碱金属与水的反应碱金属与水的反应是碱金属反应性最为明显的一个方面。
当碱金属与水接触时,会出现剧烈的反应,产生氢气和碱性溶液。
以钠与水的反应为例,反应方程式如下:2Na + 2H2O → 2NaOH + H2在反应过程中,钠的表面会迅速氧化生成氢氧化钠(NaOH),同时释放出大量的氢气。
这种反应是放热反应,产生的氢气会燃烧产生明亮的火焰。
对于其他碱金属,其与水的反应也遵循类似的机理。
二、碱金属与氧气的反应碱金属与氧气的反应也是其反应性的重要表现之一。
碱金属与氧气反应会生成相应的金属氧化物。
以钠与氧气的反应为例,反应方程式如下:4Na + O2 → 2Na2O在反应中,钠会与氧气结合形成氧化钠(Na2O)。
此反应是放热反应,同时也是一种氧化反应。
其他碱金属与氧气的反应也遵循类似的反应机理。
三、碱金属与其他非金属元素的反应除了与水和氧气的反应外,碱金属还具有与其他非金属元素反应的能力。
以钠与氯气的反应为例,反应方程式如下:2Na + Cl2 → 2NaCl在该反应中,钠与氯气结合形成氯化钠(NaCl),这是一种典型的化合反应,也是常见的离子晶体的生成机制。
此外,碱金属还可以与许多其他非金属元素如硫、氟等进行反应,形成相应的化合物。
总结:碱金属具有极强的反应性,在与水、氧气和其他非金属元素接触时会发生剧烈的反应。
碱金属与水反应会生成氢气和碱性溶液,与氧气反应会生成相应的金属氧化物,与其他非金属元素反应会形成化合物。
这些反应不仅具有重要的化学意义,还在日常生活和工业生产中有广泛的应用。
通过深入研究碱金属的反应性,可以加深对这些元素特性的理解,为进一步应用和开发提供指导。
为什么溶液的酸碱性会影响金属的腐蚀溶液的酸碱性是指溶液中酸性物质和碱性物质的含量及其相对浓度的度量。
溶液的酸碱性对金属的腐蚀有着重要的影响。
本文将探讨为什么溶液的酸碱性会影响金属的腐蚀,并进一步说明酸碱性对金属腐蚀速度和形式的影响。
首先,酸性溶液对金属的腐蚀具有较大的影响。
酸性溶液中存在丰富的氢离子,这些氢离子能够与金属表面的金属离子发生还原反应。
具体而言,氢离子能够将金属离子还原成金属原子,同时自身被还原为氢气。
这个过程被称为金属的电极反应。
在这个过程中,金属原子形成腐蚀产物,而同时产生的氢气则会逃逸到溶液中。
然而,对于碱性溶液而言,其对某些金属的腐蚀性较小。
碱性溶液中含有较少的氢离子,缺乏足够的还原剂与金属表面的金属离子反应。
因此,碱性溶液中金属的腐蚀速度相对较慢。
此外,碱性溶液中的氢氧根离子还会与金属离子进行复合反应,使得金属形成稳定的氢氧化物或碱金属盐类。
这些腐蚀产物通常具有一层致密的保护膜,能够减慢金属的腐蚀速率。
除了对腐蚀速度的影响外,溶液的酸碱性还会对金属的腐蚀方式产生影响。
酸性溶液中金属的腐蚀往往呈现出局部腐蚀的特点,即表面的某些部位比其他部位更易受到腐蚀。
这是因为在酸性溶液中,金属表面可能存在着微小的破损或缺陷,这些破损会成为局部腐蚀的起始点。
与之相反,在碱性溶液中,金属的腐蚀往往更加均匀。
这是因为碱性溶液中金属表面的氧气浓度较高,能够使金属更容易被氧化。
总结起来,溶液的酸碱性对金属的腐蚀有重要影响。
酸性溶液中丰富的氢离子会加速金属的腐蚀,并导致局部腐蚀的发生。
而碱性溶液中相对较少的氢离子和较高的氧气浓度会减慢金属的腐蚀速度,并使其更趋于均匀。
因此,了解溶液的酸碱性及其对金属腐蚀的影响,对于正确选择材料和合理设计使用环境至关重要。
碱金属熔点的高低次序
碱金属是一类化学元素,它们具有高熔点、较大原子半径、较强的氧化性和较大的电负性等特点。
碱金属的熔点是指其在加热过程中能够熔化的温度。
下面是碱金属熔点的高低次序:
1.钠
钠的熔点为371℃,是所有碱金属中熔点最低的。
钠是一种轻质的金属,具有高蓬松度和较低的熔点。
它常用于制造硬脂酸钠和肥皂等化工产品。
2.钾
钾的熔点为336℃,是所有碱金属中熔点第二低的。
钾是一种常用的肥料元素,它能够促进植物的生长和发育。
钾还可以用于制造无机盐、肥皂和玻璃等物品。
3.钙
钙的熔点为842℃,是所有碱金属中熔点第三低的。
钙是一种重要的建筑材料,常用于制造水泥、石膏和玻璃等物品。
钙还可以用于制造钙质饮料、药物和食品添加剂等。
4.镁
镁的熔点为650℃,是所有碱金属中熔点第四低的。
镁是一种轻质的金属,具有较高的电负性和较强的腐蚀性。
它常用于制造镁合金、磷酸镁和镁碳酸镁等物品。
镁还可以用于制造药物、食品添加剂和化妆品等。
5.铝
铝的熔点为660℃,是所有碱金属中熔点第五低的。
铝是一种轻质的金属,具有较高的电负性和较强的腐蚀性。
它常用于制造铝合金、铝箔和铝型材等物品。
铝还可以用于制造药物、食品添加剂和化妆品等。
总结
碱金属熔点的高低次序是钠、钾、钙、镁、铝。
碱金属熔点的高低受到原子半径和电负性等因素的影响。
碱金属具有高熔点、较大原子半径、较强的氧化性和较大的电负性等特点,它们常用于制造化工产品、建筑材料、肥料和合金等物品。
【金属单质】Li Na K Rb CsBe Mg Ca Sr Ba1、物理性质①、共性:碱金属与碱土金属的单质都具有银白色的金属光泽,具有良好的导电性和延展性。
②、特性:碱金属a、熔点较低除Li外都在100℃以下(Cs熔点最低放手上就融化)b、沸点熔点的温度间距较大,沸点一般比熔点高700℃以上1c、较软莫氏硬度都小于1,可以用刀子切割d、.密度都娇小属于轻金属碱土金属有2个电子可以参与成键,因而金属键比碱金属的强,碱土金属的熔沸点、硬度、密度都比碱金属高得多。
2、化学性质①、共性:a、碱金属和碱土金属都是非常活泼的金属元素,同族从Li到Cs和从Be到Ba活泼性依次增强。
b、.都有很强的还原性,与许多非金属单质直接反应生成离子型化合物。
在绝大多数化合物中,它们以正离子形式存在。
②、与H2O反应碱金属及Ca Sr Ba同水反应生产氢氧化物和氢气如:2Na+2H2O=2NaOH+H22Ca+2H2O=Ca(OH)2+H2(注:a、Li Ca Sr Ba与水反应较平稳,因为它们的熔点较高,不易融化,与水反应不激烈;另一方面,由于它们的氢氧化物溶解度小,生成的氢氧化物覆盖在金属表面阻碍金属与水接触,从而减缓反应。
b、Be Mg的金属表面可以形成致密的氧化物保护膜,常温下它们对水是稳定的。
c、.其他碱金属与水反应非常剧烈,量大时会发生爆炸。
这些碱金属的熔点很低,与水反应放出的热恋是金属熔化为液态,跟有利于反应的进行;同时它们的氢氧化物溶解度很大,不会对反应起阻碍作用。
)③、与H2反应碱金属及Ca Sr Ba均可直接与H2作用,生成金属氢化物如:H2+Ca=CaH2(423-573K条件下)产物氢化钙是很强的还原剂用途:氢气发生剂、还原剂、干燥剂及还原氧化物金属④、与液氨碱金属及Ca Sr Ba均可溶于液氨中生成蓝色的导电溶液,高溶液中含有金属离子和溶剂化的只有电子,具有极强的还原能力。
3Na+2NH3(l)=Na+(NH3)+e-(NH3)⑤、制备稀有金属或贵金属由于碱金属和一些碱土金属单质都与水激烈反应,所以它们不能在水溶液中做还原剂使用。
120碱金属腐蚀分析元素迁移图8不同气化温度下煤中Na 的物相变化Fig. 8 Transformation of Na during gafiiHcation atilifG-orl 1rntr>rMhi在煤气化条件下,Na 主要以NaAISiO4,NaCI 及NaAISi3O8等形式 存UKIS0 60 40 20 0KM90() 1 ()(K) 1 100【2CM)气化盅度比 * NaCl(s) * NaCl(g) * (NaCl):(g) -^NuAlSiO^s) *NaAIS^Ojis} —— Na ,Ca .Si n O Js) ■” Na ;O(shg)在。
在800 C时,Na主要以NaAISiO4形式存在,含量达到%并伴随有少量气态NaCI(g);随煤气化温度的升高,气相NaCI(g)含量不断升高,固相NaAISiO4(s)逐渐降低;950 C气化时,有少量NaAISi3O8(s) 生成;1000 C 120煤气化条件下生成结渣相Na2O ( sIag )。
气化试验工况均低于1000C ,试验结果中未发现熔融态结渣相,计算结果与试验结果基本一致。
当煤气化温度超过1050C时,煤中Na不再以固相形式存在,气相NaCI(g)略有降低并趋于稳定熔融。
结渣相Na2O(sIag) 不断增加,Na2O(sIag)为Na的主要存在形式。
有研究表明K的析出特性与Na相似,只是K的析出强度比Na大一个数量级氯化钠是煤中钠的主要形式,在燃烧与气化过程中会挥发出来,而钾与钠不同,主要存在于不挥发的铝硅酸盐中,然而钾也能从铝硅酸盐中释放出来,并通过和氯化钠蒸汽发生交换反应后以氯化钾的形式出现。
有研究表明,随煤种氯含量增加,钾释放量增加。
在煤中,碱金属钾钠两种存在状态都有,有机物是以阳离子形式与羟基结合形态存在;无机物或以水溶性盐的形式存在,或可能与硅酸盐结合在一起存在。
低阶煤中,钠主要以有机化合物形式存在,高阶煤中,钠则以水溶性的有机化合物形式存在。
此外它还可能以与硅铝酸盐结合形成如Na2 •AI2O3 • (SiO2)6的形式存在。
而钾主要是以K2O- (AI2O3)3 - (SiO2)6 • H2O和K2O- AI2O3 - (SiO2)6 的硅铝酸盐形式存在。
因此在热转化过程中,煤中的钾很难释放到气相中。
原煤中钠的含量要高于钾,并且原煤中钠的存在形态的反应性高于钾存在形态的反应性。
挥发性K是不断迁移的,部分K以气态形式释放,如KCI(g)、K2S04(g)、KOH(g)、K(g);其他以硅酸钾、硅铝酸钾和硫酸钾的形式存在于灰分中。
冷凝过程中,气态钾冷凝在飞灰颗粒上或者经过硫酸化、炭化形成气溶胶或小的飞灰颗粒,最终造成颗粒聚团、结渣。
温度高于500c时,无机钾因蒸汽压升高而挥发出来。
Na的析出特性与K 相似,只是Na的析出强度比K小一个数量级C1主要以离子的形式存在 。
在600° C 以上,C1以碱金属氯化物 形式挥发进入气相,这是C1进入气相的主要形式。
它可促进碱金属的 气化,形成的气态碱金属氯化物是稳定的挥发物 ,从而对碱金属起到 运输的作用,对积灰结澄的作用相当重要。
腐蚀类型及反应机理(1)碱金属氯化物腐烛完全燃烧过程中,由于炉内的高温以及K 、Na 等碱金属的高挥发性,碱 金属氯化物会以气相形态进入烟气中,当烟气遇到低温管壁时会凝结 下来形成积灰。
I 烟气翻的$0农)Rt 遍厂C^(gXH ?O=HC>{g): ............2NaC\F SO 2 +O 2=N^,SO 4+CL 2KCH — -f3FeC]2+2O 2=Fe.(^+3CL 2lcCI ; + L5O 2-Fe 20,+2Cl FtCbPj +F 勺 Q=2F 句 Og+Cl 』/ 腐蚀反应层亍緘金厲氯化物腐蚀过柑叮;意閤气化过程中的氯化物腐蚀F 勺()]+Fed, + 3N 逝()^=K ?SOjCh5而气化条件下含有大量H2和CO生成的FeO氧化膜多孔、松脆且极易脱落,对受热面的腐蚀严重。
⑵HCI和CI2腐蚀混燃烧吋氯腭迩丄j毓腐镰是同时證生的.反廉初期贫煤中的黄铁F <FeS z)高谧灼烧丄况卜料敷書原几一方血会打金属无素化合脸&F⑸破坍曽斥结掏*另一方面会快玉来IT沉积妖申的KCl^酸化,生就K臣Ch・释战口片6与烟气气瓠中的代体对金尿握体形成活性掘化倉蚀.与纯玉米杆尿柜比,甸%配比下的混熾加揺戊牧低.熔锻盐他成削电解岖落液・捕連f咆化学將世作用・便品手金属晶界析出的樂厲碳化物更斡易讲和丘应「为祜晶腐蚀提供杀件・在金尿表向形成点蚀战.HCI的来源(准东)2Na(:l + A1J). - 2HJ) 4 芳i(L^=2NaAlSi()4 * 2IICIFe+2HCl^FeCl2+H2FeO+2HCl ->FeCl2+l!2OFe2O^2HCl+CO t FeO+FcCl.+H.O+CO.FejO4+2Ha+CO T 2F C O+F C C1 JH2O+CO2CrO3+4HCI+lI3 -^2CfCh,+2H:OHCI随温度变化对金属管壁的腐蚀强度是呈波浪状的。
露点以下腐烛严重;露点以上260c以下,腐烛强度减弱;260以上,因高温剧烈反应而腐烛加剧。
2Fe^3Cl2^2F C C132Cr2O,+4CL+O?->4CrO£l刘纪福[39]等研究了CI2干、湿两种状态下金属的年腐烛量的情况实验结果表明壁温相同状态下,水分的存在,促进了cl腐烛。
(3)硫及其化合物腐烛1. 还原气氛下,烟气中容易形成H2S而非S02,H2S在C、CO存在的条件下易与金属氧化层和金属基体反应,生成FeS,破坏致密氧化层的保护作用,使腐蚀性气体自由出入,加速腐烛。
FtiS:-> Fc'S 4 S 2H5+SO -+lt;0+3S F'tOill.s-tRs-hllp Fe-H 点F冨+HrO*2. 硫元素还会以硫化钠、硫化钾、硫化亚铁的形式存在于积灰中,对氧化层造成腐烛。
Na.S+FcO->FeS+Na2O3. 硫酸盐的腐蚀鲁奇炉认为硫酸盐可能是导致夹套内壁腐蚀减薄的主要原因之一曇2 煤典化孚能甘(质居牙散)|^}在还原性气氛下,并同时存在C02时,会使碱金属硫酸盐分解生成含硫化合物,这些含硫化合物在碱金属硫酸盐、铁和铁的化合物共同作用下会生成复杂的低熔点化合物,如可能生成复杂的复合式硫酸盐和焦硫酸盐。
富含碱金属硫酸盐且在S03分压相对较高的情况下,在金属表面易形成熔盐层,使正常的保护性氧化物发生酸助熔。
提岀的反应机理如下:3N出SO计Fe;0^3S0—F E(SOJ*3K;O3+3S(>—2k;F P⑴①)加也有学者提出先是通过反应生成焦硫酸钠和焦硫酸钾,而焦硫酸钠和焦硫酸钾非常容易侵蚀金属表面的氧化物保护膜,具体见反应:Na. SO-.+SO,N呛S20T1K2 S04+S0?—' K; S207Q(2)3X5S:6+F比0,― 2忌F R (S04)3 +3X. S?0汁F© O I—3X2 S04险(SO4)3f4X2 S2 |j+F切0』―4X2 SO4+FeSOd-F^(SO4)31上述反应发生的温度在399~482 C之间,SO3的来源主要两个:一是硫铁矿硫被氧化生成S02 S02被灰中的一些成分催化氧化成SO3 另一个来源是灰成分中硫酸钙,硫酸镁等受热易分解产生SO3。
四、煤质比较五、材料分析秸秆燃料锅炉受热面工作温度低于500 C时,选用价格最低的20G 管材;锅炉受热面工作温度低于550 C,选用价格稍高一点的12Cr1MoVG管材;工作温度低于600 C时,选用价格更高的10Cr9Mo1VNb管材;当锅炉受热面工作温度高于600 C时,只能选用价格更高的1Cr19Ni11Nb 管材。
五、结论分析K\NA的不同K 对积灰结渣的作用主要表现在两个方面: 一是它的化合物的高挥发性, 使其更容易进入气相, 增大其化合物的蒸汽压,从而更容易的参加反应; 二是它的化合物普遍具有低灰溶点的特性。
任何形态的碱金属化合物都与Si02 反应生成低熔点化合物。
、煤质分析报告:准东煤3-2准东煤元素分析、发热呈(ad- 鬣热虽仃他星准东煤bl .4 4.4] I7.6K5 O.S9 0.4K5 L6J L9准东沙尔湖煤沙尔湖煤属于高钠高氯煤,煤灰中含有较高的Na20煤中Na主要以水溶性Na 存在,达到%,其次为醋酸铵溶态Na,占%,其余为盐酸溶态Na及不溶态Na,分别唏口%。
煤中氯含量高达1. 132%。
灰分比较(本案取各煤种最高值)天业准东Na20:K20:CL: (ad) (ar)燃煤装置中的沉积物巫苴熔点沉积物烙点代沉积物熔点/无A】M 2 050SiO3 1 710 AMSOJ.770(分解)K2SO4 1 069 CaO 2 572呼a884C^5O4 1 450血0呼》分解)Fg 1 565K禺a300(分解)t-escr41 538624足(SO几430(分解〉K¥(SO 丄618Mg 2 500N码Al (SO丄646MgSO, 1 124Mi(so4)3655Ni0 2 090NaFr(SOJ2690關0(分銅)KFHSO)694的工作温度更高,最表面局部温度可达650 r0 :践证明勒在300〜500七的范甫内尖管壁外表面温度每升高50 将使受热面的腐蚀速度增加1倍[以KCI-ZnCI2混合盐是一种强腐蚀介质,混合后共晶点约为250C,在650 C反应温度下已呈熔融态,因此材料的腐蚀主要在熔融的氯化物中进行,与相同材料的高温氧化相比,腐蚀速度加快,能形成非常厚的腐蚀产物。
在650 C条件下,KCI-ZnCI2混合盐已呈熔融状态,涂层表面完全置于熔盐内,由于氧在熔盐中的溶解度和扩散系数都很有限,熔盐内实际上是一个低氧势环境,氧的供应极不充分,结果增加了Cr2O3保护性氧化膜的稳定性,使材料的腐蚀速率能够随Cr含量增加而得以显著降低。
事实上,在垃圾焚烧工艺流程中如果添加适当的添加剂,由于其与氧发生反应而造成低氧势环境,往往可以据此大大减低材料的腐蚀程度,尤其是那些形成Cr2O3型保护膜的合金的耐蚀性得以显著提高。
与Fe、Cr的氧化物相比,Ni在氯化物熔盐中表现得最稳定。
由于NiCI2具有很高的熔点(约为1030 °C),并且NiO极易在氯化盐熔融盐中达到饱和状态,因此NiO在氯化环境中比Fe、Cr等具有更好的耐蚀性。
由于钛与氢原子容易生成氢化物使材料韧性降低,故不选用含钦合金做为覆盖层。
53 M日Cl腐蚀行为机理及行为NaClifefl有根鞭的吧湿怦* fl盐%笛内,NaCI盐濟版落證金属表面上.« 大了表H]水层液的导电性.能溶于金属盘面的SMK形成臨恤性卉质,导颈涂层叢■%生电化学JB协L在农■解成无離①熾烛锻电池・RMt反应的进存.Nl\ F护何團様I理域桶胡.OH\CI 解区域怪动’仕活性聊倾[用阳匹“ T.F^Off)!,但岡OH)曲诫产物并不穂定.它会逐渐涪解于薄膜液中的OiMfclSFcOOH.(见育程式5 5-2 >:Fe(OHh^F^H.O t 5-1 >2Fe(OHh + l/ 20-^2FcOOH+ H.O ( 5-2i 庄适陀反晦发牛的同时.由于€i■具有很强的侵蚀性,它不仅起到尋电介JSt 的作用,而且会餓坏金JB表阳的保护膜・这个过程可以方程式5叨来描述:Fe{OHh+Cl —F^O H +€1+011( 5山)<匕述化学!<应方S式(X河以看出■在儒烛过程中・G会ifijicFtWHb的局榕溶解.这导毀了在栽密的辙化醴上出现细槪的裂忍觸谊介歲会通过«9tt 渇入创庭他J' I -'- < ':旳i:: !-1!. 1-0 . I .:()., 1 c(K>]l';1 N 増麥对滋蚀起到J -定的抑制柞用.I .在高沮WOT)下,NaCl只有比W七30*更为谢烈前鷹蚀作用,它加遠氣化皮破製和脫着,増逼-时间曲线上不在在羽显的热腐烛孕育期。