重要有机物之间的转化关系
- 格式:docx
- 大小:468.61 KB
- 文档页数:5

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
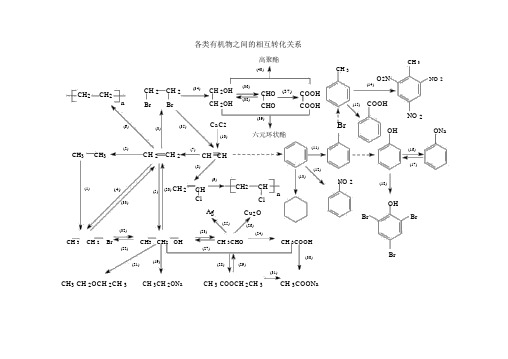
各类有机物之间的相互转化关系高聚酯CH3CH2CH2n(6)(2) CH3CH3(1)(4)(33)(32)CH 2CH 2(34)CH 2OHBr Br CH 2OH(3)(35)CaC2(10)CH 2CH 2(7)CH CH(8)(9)(5)(20)CH2CHClAg(25)(23)(40)(36)CHO(37)COOH(38)CHO COOH(39)六元环状酯(11)(12)(13)CH2CHnClCu2O(26)(24)CH 3O2N NO 2(14)(15)COOHNO 2BrOH ONa(16)(17)NO 2(18)OHBr BrCH 3 CH 2 Br CH3 CH2 OH CH 3CHO CH 3COOH(22)(27)(19)(30)(21)(28)(29)(31)CH3 CH 2OCH 2CH 3CH 3CH 2ONa CH 3 COOCH 2CH 3CH 3COONaBr光照( 1)CH3 CH3+Br2CH3CH2 Br+HBr催化剂(2)CH2=CH2+H2△CH3CH3CH 3( 14)+ 3HO -NO 2浓 H 2SO4△CH 3O2N NO 2+3H2ONO 2( 3)CH2=CH2+Br2CH2BrCH 2Br(4)CH2=CH2+HBr32BrCH CH(5)CH2=CH2+H2O浓H2SO4CH3CH2OH催化剂( 6)n CH2= CH2CH2 CH2n催化剂(7)CH≡ CH+H 2△CH2=CH2( 8)CH≡ CH+HCl催化剂CH2=CHCl△(9)n CH 2 CH 催化剂CH2 CH nCl Cl( 10) CaC2+2H2O CH≡CH↑ +Ca(OH) 2CH 3(15)(16) 2(17)OHCOOH酸性 KMnO 4或酸性K2Cr2O7OH +2Na2OH +NaOHOH +Na2CO3ONa +HClONa +CO2 +H2OOHBr BrONa +H 2↑ONa +H 2OONa +NaHCO 3OH +NaClOH +NaHCO3( 11)催化剂Br +HBr + Br 2(12)+ HO -NO2浓H2SO42△NO 2+ H O( 13)+3H2催化剂△( 18)+3Br 2↓ +3HBrBr(19)2CH 322CH32ONa+H2↑CH OH+2Na CH浓H 2 SO4CH2=CH2↑+H2O(20)CH3CH2 OH1700C浓 H 2SO4C2H5-O-C2H5+H2O(21)C2H5-OH+HO - C2H51400C(22) CH 3CH2 OH+HBr △CH3CH2Br+H 2O催化剂 CH 2 Br水 CH 2OH( 23) 2CH 3CH 2 OH+O 2△2CH 3 CHO+2H 2O ( 34) CH 2 Br + 2NaOH △ CH 2 OH +2NaBrCH 3CH 2 OH+CuO△CH 3 CHO+Cu+H 2O( 35) CH 2BrCH 2Br+2NaOH乙醇△CH ≡ CH ↑ +2NaBr+2H 2O( 催化剂2CH 3COOHCH 2OHCHO24) 2CH 3CHO+O 2△催化剂(36) CH 2OH +O 2△CHO +2H 2O(△CH 3COONH 4+2Ag ↓25 ) CH 3CHO+2Ag(NH 3)2OHCHO催化剂COOH CHO催化剂CH 2OH +3NH 3 +H 2O( 37) CHO +O 2△COOH( 38) CHO +2H 2△CH 2OH( 26) CH 3CHO+2Cu(OH) 2 △CH 3COOH+Cu 2 O ↓+2H 2O( 27) CH 3CHO+H 2催化剂 CH 3CH 2OH△(28) CH 3 2 5 浓 H SO 4 3 2 5 2H 2COOH+HOC △ CH COOC H +H O ( 29) CH 3COOC 2 H 5+H 2 O稀H2SO 4CH 3 COOH+C 2H 5 OH△( 30) 2CH 332↑COOH+2Na2CH COONa+H2CH 3COOH+Na 2O2CH 3COONa+H 2O CH 3COOH+NaOHCH 3COONa+H 2O2CH 3COOH+Na 2CO 32CH 3 COONa+H 2 O+CO 2 ↑CH 3COOH+NaHCO 3CH 3 COONa+H 2O+CO 2↑△( 31) CH 3COOC 2 H 5+NaOHCH 3COONa+C 2H 5OHCOOHCH 2OHOO浓 H 24 CCH 2(39)COOH +CH 2OHSO+2H 2O△CCH 2OOCOOHCH 2OH 浓 H2SO 4(40) nCOOH+nCH 2 OH△O OHO C C O CH 2 CH 2O H +(2n -1)H 2On水( 32) CH 3CH 2 Br+NaOH△ CH 3CH 2OH+NaBr乙醇( 33) CH 3CH 2 Br+NaOH△CH 2= CH 2↑ +NaBr+H 2O。



重要有机物之间的转化关系一、重要有机物之间的转化关系二、重要反应必背(1)CH 3CH 2Cl ―→CH 2==CH 2答案 CH 3CH 2Cl +NaOH ――→乙醇△CH 2==CH 2↑+NaCl +H 2O (2)CH 3CH 2OH ―→CH 2==CH 2答案 CH 3CH 2OH ―――→浓H 2SO 4170 ℃CH 2==CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO答案 2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O (4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案 CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC —CHO ―→HOOC —COOH答案 OHC —CHO +O 2――→催化剂△HOOC —COOH (6)乙二醇和乙二酸生成聚酯答案 n HOCH 2—CH 2OH +n HOOC —COOH 一定条件+2n H 2O(7)乙醛和银氨溶液的反应答案 CH 3CHO +2Ag(NH 3)2OH ―→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案 CH 3CHO +2Cu(OH)2―→△CH 3COOH +Cu 2O ↓+2H 2O (9)答案 +2NaOH ――→醇△+2NaCl +2H 2O (10)答案 +Br 2――→FeBr 3+HBr (11)和饱和溴水的反应答案 +3Br 2―→↓+3HBr(12)和溴蒸气(光照)的反应答案 +Br 2―→光+HBr(13) 和HCHO 的反应答案 n +n HCHO ―→H ++n H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案 CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应答案 +2NaOH ――→△CH 3COONa ++H 2O三、有机物的检验辨析1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
第3课时 重要有机物之间的相互转化重要有机物之间的转化有机化合物的性质主要取决于它所具有的官能团,有机化合物的反应往往围绕官能团展开,了解官能团之间的相互转化,能帮助我们进一步掌握有机化合物的内在联系:各有机物之间转化的化学方程式: ①CH 3CH 3+Br 2――→光照CH 3CH 2Br +HBr ②CH 2===CH 2+HBr ――→催化剂△CH 3CH 2Br③CH 3CH 2Br +KOH ――→醇△CH 2===CH 2↑+KBr +H 2O④CH 2===CH 2+H 2――→Ni△CH 3CH 3⑤CH 2===CH 2+H 2O ――→催化剂△CH 3CH 2OH⑥CH 3CH 2OH ――→浓硫酸170 ℃CH 2===CH 2↑+H 2O⑦2CH 3CH 2OH +O 2――→Cu 或Ag△2CH 3CHO +2H 2O⑧CH 3CHO +H 2――→Ni加热、加压CH 3CH 2OH⑨2CH 3CHO +O 2――→催化剂2CH 3COOH ⑩CH ≡CH +H 2――→催化剂CH 2===CH 2 ⑪CH 3COOC 2H 5+H 2OH +△CH 3COOH +C 2H 5OH⑫CH 3CH 2OH +CH 3COOH浓硫酸△CH 3COOC 2H 5+H 2O⑬CH 3CH 2Br +H 2O ――→NaOH△CH 3CH 2OH +HBr⑭CH 3CH 2OH +HBr ――→△CH 3CH 2Br +H 2O探究点一 有机合成过程中官能团的引入、消除与转化(2)不饱和烃与卤素单质、卤化氢的加成反应。
例如:CH 2===CHCH 3+Br 2―→CH 2Br —CHBrCH 3 CH 2===CHCH 3+HBr ―→CH 3—CHBrCH 3 CH ≡CH +HCl ――→催化剂CH 2===CHCl (3)醇与氢卤酸的取代反应。
例如: R —OH +HX ――→△R —X +H 2O2.羟基的引入方法 (1)醇羟基的引入方法 ①烯烃水化生成醇。
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
第3课时 重要有机物之间的相互转化智能定位1.掌握有机化学反应的主要类型的原理及应用,初步学习引入各官能团的方法。
2.了解烃、卤代烃、醇、醛、羧酸、酯之间的相互转化。
3.在掌握各类有机物的性质、反应类型、相互转化的基础上,初步学习设计合理的有机合成路线。
情景切入人类运用有机化学手段合成出许许多多的物质,合成有机化合物需要考虑哪些问题呢?自主研习重要有机物之间的相互转化上述转化的化学方程式分别为①CH 3CH 3+Br 2−→−光CH 3CH 2Br+HBr ②CH 2==CH 2+H 2−−→−催化剂CH 3CH 3 ① CH ≡CH+2H 2−−→−催化剂CH 3CH 3 ④CH ≡CH+H 2−−→−催化剂CH 2==CH 2 ⑤CH 3CH 2Br+NaOH CH 2===CH 2↑+NaBr+H 2O⑥CH 3CH 2Br+NaOH CH 3CH 2OH+NaBr⑦CH 3CH 2OH+HBr CH 3CH 2Br+H 2O⑧CH 3CH 2OH CH 2==CH 2↑+H 2O⑨2CH 3CH 2OH+O 22CH 3CHO+2H 2O⑩CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O ○11 CH 3CHO+2Cu (OH )2Cu 2O ↓+CH 3COOH+2H 2O思考讨论若由乙醇制备乙二酸乙二酯(),如何设计合成路线?提示:乙醇−−→−消去乙烯−−→−加成1,2-二溴乙烷−−→−水解乙二醇−−→−氧化乙二醛−−→−氧化乙二酸乙二酸乙二酯。
课堂师生互动知识点1 有机合成过程中常见官能团的引入 1.卤原子的引入方法(1)烃与卤素单质的取代反应。
例如:CH 3CH 3+Cl 2−−→−光照HCl+CH 3CH 2Cl(还有其他的卤代烃)(还有其他的氯代苯甲烷)CH 2==CH —CH 3+Cl 2−−−−→−600℃~500℃CH 2==CH —CH 2Cl+HCl (2)不饱和烃与卤素单质、卤化氢的加成反应。
重要有机物之间的转化关系
一、重要有机物之间的转化关系
二、重要反应必背
(1)CH 3CH 2Cl ―→CH 2==CH 2
答案 CH 3CH 2Cl +NaOH ――→乙醇△
CH 2==CH 2↑+NaCl +H 2O (2)CH 3CH 2OH ―→CH 2==CH 2
答案 CH 3CH 2OH ――→浓H 2SO 4170 ℃
CH 2==CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO
答案 2CH 3CH 2OH +O 2――→Cu △
2CH 3CHO +2H 2O (4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯
答案 CH 3COOH +CH 3CH 2OH 浓H 2SO 4
△CH 3COOC 2H 5+H 2O
(5)OHC—CHO ―→HOOC—COOH
答案 OHC—CHO +O 2――→催化剂
△
HOOC—COOH (6)乙二醇和乙二酸生成聚酯
答案 n HOCH 2—CH 2OH +n HOOC—COOH
(7)乙醛和银氨溶液的反应
答案 CH 3CHO +2Ag(NH 3)2OH ――→△
CH 3COONH 4+2Ag ↓+3NH 3+H 2O
(8)乙醛和新制Cu(OH)2悬浊液的反应
答案 CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O (9)
答案 ――→醇
△+2NaCl +2H 2O (10)
答案
(11) 和饱和溴水的反应
答案
(12) 和溴蒸气(光照)的反应
答案
(13) 和HCHO 的反应
答案 +(n -1)H 2O
(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)
答案 CH 3COOC 2H 5+NaOH ――→△
CH 3COONa +C 2H 5OH (15)
答案
三、有机物的检验辨析
1.卤代烃中卤素的检验
取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
2.烯醛中碳碳双键的检验
(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2)若样品为水溶液,则先向样品中加入足量的新制Cu(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若褪色,则证明含有碳碳双键。
提醒:若直接向样品水溶液中滴加溴水,则会有反应:—CHO +Br 2+H 2O ―→ —COOH +2HBr 而使溴水褪色。
3.二糖或多糖水解产物的检验
若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH溶液,中和稀硫酸,然后再加入银氨溶液或新制的氢氧化铜悬浊液,(水浴)加热,观察现象,作出判断。
4.如何检验溶解在苯中的苯酚?
取样,向试样中加入NaOH溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCl3溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
提醒:(1)若向样品中直接滴入FeCl3溶液,则由于苯酚仍溶解在苯中,不能进入水溶液中与Fe3+进行离子反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
(2)若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面可能生成的三溴苯酚溶解在过量的苯酚之中而看不到沉淀。
5.检验实验室制得的乙烯气体中含有CH2==CH2、SO2、CO2、H2O,可将气体依次通过无水硫酸铜→品红溶液→饱和Fe2(SO4)3溶液→品红溶液
(检验水)(检验SO2)(除去SO2)确认SO2已除尽
→澄清石灰水→溴水或溴的四氯化碳溶液或酸性高锰酸
钾溶液
(检验CO2)(检验CH2==CH2)
四、有机反应条件的重要性
1.有机化学反应一般需要在适当的条件下才能发生,且常伴有副反应,通常只写出主反应的化学方程式。
在书写化学方程式时,应注意标明正确的反应条件。
2.反应条件不同,反应类型和反应产物可能不同。
(1)温度不同,反应产物不同。
例如:
(2)溶剂不同,反应产物不同。
例如:
(3)催化剂不同,反应产物不同。
例如:。