重要有机物之间的相互转化
- 格式:ppt
- 大小:212.50 KB
- 文档页数:48


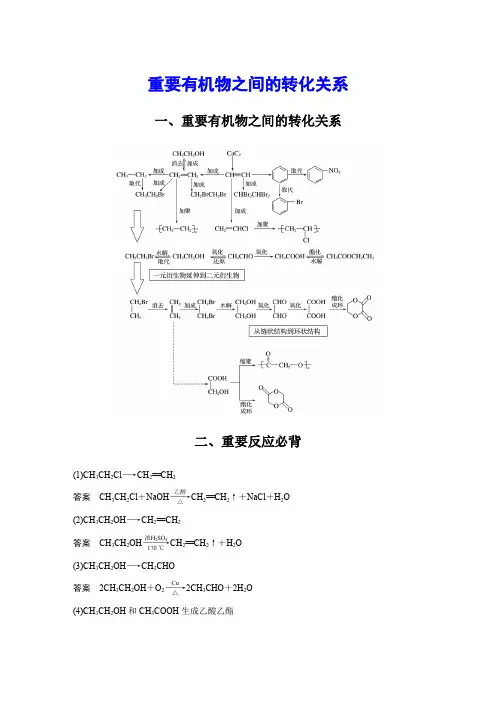
重要有机物之间的转化关系一、重要有机物之间的转化关系二、重要反应必背(1)CH 3CH 2Cl ―→CH 2==CH 2答案 CH 3CH 2Cl +NaOH ――→乙醇△CH 2==CH 2↑+NaCl +H 2O (2)CH 3CH 2OH ―→CH 2==CH 2答案 CH 3CH 2OH ―――→浓H 2SO 4170 ℃CH 2==CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO答案 2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O (4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案 CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC —CHO ―→HOOC —COOH答案 OHC —CHO +O 2――→催化剂△HOOC —COOH (6)乙二醇和乙二酸生成聚酯答案 n HOCH 2—CH 2OH +n HOOC —COOH 一定条件+2n H 2O(7)乙醛和银氨溶液的反应答案 CH 3CHO +2Ag(NH 3)2OH ―→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案 CH 3CHO +2Cu(OH)2―→△CH 3COOH +Cu 2O ↓+2H 2O (9)答案 +2NaOH ――→醇△+2NaCl +2H 2O (10)答案 +Br 2――→FeBr 3+HBr (11)和饱和溴水的反应答案 +3Br 2―→↓+3HBr(12)和溴蒸气(光照)的反应答案 +Br 2―→光+HBr(13) 和HCHO 的反应答案 n +n HCHO ―→H ++n H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案 CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应答案 +2NaOH ――→△CH 3COONa ++H 2O三、有机物的检验辨析1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。

有机碳微生物相互作用
有机碳是地球上存在的一种重要化学物质,而微生物则是地球上最小的生命体。
这两者之间的相互作用是一个复杂而又精彩的过程。
有机碳是由有机物质分解而来的,包括植物残骸、动物尸体等。
微生物通过分解这些有机碳源来获取能量和营养物质。
这种分解过程被称为有机质分解。
在有机质分解的过程中,微生物扮演着重要的角色。
它们分解有机碳,释放出二氧化碳和水,以及其他一些有机化合物。
这些分解产物进一步参与到生物循环中,维持着地球上各种生命的存在。
微生物的作用不仅仅局限于分解有机碳。
它们还能够转化一些有机碳为有机酸,形成有机酸盐。
这些有机酸盐对土壤的肥力起到了积极的作用,促进了植物的生长。
此外,微生物还能够合成一些有机物质,如植物生长因子和抗生素等,对生态系统的平衡和生物多样性的维持起到了重要的作用。
微生物和有机碳之间的相互作用是一个复杂而又微妙的过程。
微生物通过分解有机碳来获取能量和营养物质,同时也对有机碳的循环和分布起到了调节作用。
有机碳的分解和微生物的活动也会受到环境因素的影响,如温度、湿度、氧气浓度等。
因此,了解微生物和有机碳的相互作用对于我们更好地保护环境和利用资源具有重要意义。
有机碳和微生物之间的相互作用是一个充满活力和奇妙的过程。
微生物通过分解有机碳来获取能量和营养物质,同时也参与到生态系统的平衡和生物多样性的维持中。
了解这种相互作用对于我们更好地保护环境和利用资源具有重要意义。
让我们共同努力,保护我们的地球,让这个美丽而又神奇的生命之舞继续下去。

重要有机物之间的相互转化汇报人:日期:contents •脂肪烃的转化•脂环烃的转化•芳香烃的转化•卤代烃的转化•有机化合物的氧化还原反应•有机化合物的官能团转换目录脂肪烃的转化03烷基化反应01裂解反应02脱氢反应氧化反应聚合反应氧化反应聚合反应加氢反应脂环烃的转化环扩大环缩小环烷烃的加成030201环氧化环烯烃可以通过催化氧化或化学氧化反应,转化为环氧化物。
环加成环烯烃可以与炔烃、烯烃等发生Diels-Alder反应或 ene 反应,生成新的环状化合物。
开环反应在酸或碱催化下,环烯烃可以开环转化为链状烃。
1 2 3环加成末端加成开环反应芳香烃的转化氧化反应磺化反应硝化反应苯的转化磺化反应烷基化反应氧化反应氧化反应磺化反应烷基化反应卤代烃的转化氧化反应还原反应水解反应消去反应01加成反应02氧化反应03多卤代烃的转化裂解反应多卤代烃在无氧或缺氧的条件下,可发生裂解反应,生成多个小分子卤代烃或烯烃。
聚合反应多卤代烃可在催化剂的作用下,发生聚合反应,生成高分子化合物。
有机化合物的氧化还原反应氧化反应醇的氧化酮的氧化01羧酸的还原02醛的还原03酮的还原还原反应既有氧化又有还原的反应烯烃的环氧化烯烃的氢化有机化合物的官能团转换醇到醚通过醇和卤代烃发生取代反应得到醚。
醇到醛通过醇和醛发生氧化反应得到醛。
醇到羧酸通过醇和羧酸发生酯化反应得到羧酸。
030201醛到醇醛到酮酮到羧酸羧酸到酯羧酸到酰胺羧酸到酮感谢观看。

羧酸酯【学习目标】1、掌握乙酸的组成、结构、性质和用途;2、掌握羧酸的组成、结构、性质及其应用;3、了解酯的结构及主要性质;4、掌握重要的有机物之间的相互转化,学会在有机合成与推断中应用。
【要点梳理】要点一、羧酸的结构、通式和性质1.羧酸的组成和结构。
(1)羧酸是由烃基(或H)与羧基相连组成的有机化合物。
羧基()是羧酸的官能团。
(2)羧酸有不同的分类方法:2.羧酸的分子通式。
一元羧酸的分子通式为R—COOH,饱和一元脂肪羧酸的分子通式为C n H2n O2或C n H2n+1—COOH。
分子式相同的羧酸、羧酸酯、羟基醛、羟基酮等互为同分异构体。
3.羧酸的主要性质。
(1)羧酸的沸点比相应的醇的沸点高;碳原子数在4以下的羧酸能与水互溶,随着分子中碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
(2)羧酸的化学性质。
①弱酸性。
由于—COOH能电离出H+,使羧酸具有弱酸性。
而羧酸具有酸类物质的通性。
如:2RCOOH+Na2CO3—→2RCOONa+CO2↑+H2ORCOOH+NH3—→RCOONH4常见的一元羧酸的酸性强弱顺序为:②酯化反应。
注意:可以用同位素示踪法证实酯化反应过程是羧酸分子中羧基中的羟基与醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。
无机含氧酸与醇作用也能生成酯,如:C2H5OH+HONO2—→C2H5—O—NO2+H2O(硝酸乙酯)③ -H被取代的反应。
通过羧酸α-H 的取代反应,可以合成卤代羧酸,进而制得氨基酸、羟基酸等。
④还原反应。
由于羟基的影响,羧基中的羰基比醛、酮分子中的羰基较难发生加成反应,但在特殊试剂(如LiAlH 4)的作用下,可将羧基还原为醇羟基。
RCOOH 4LiAlH−−−−→RCH 2OH 有机化学上可用此反应实现羧酸向醇的转化。
4.羧酸的命名。
(1)选含羧基的最长的碳链作为主链,按主链碳原子数称某酸;(2)从羧基开始给主链碳原子编号;(3)在“某酸”名称之前加入取代基的位次号和名称。

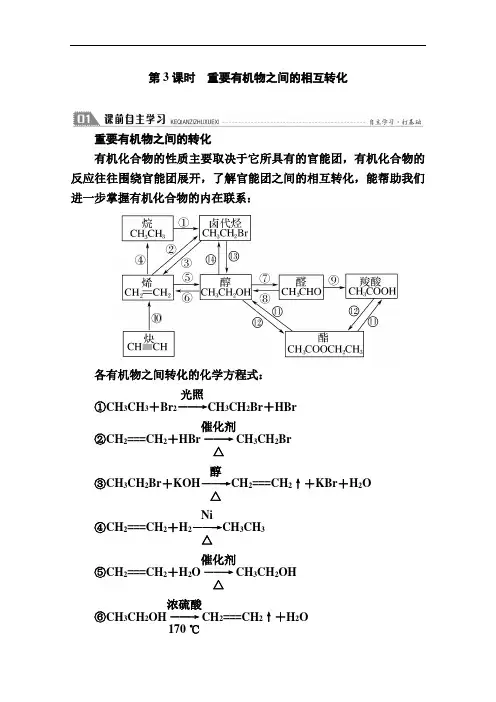
第3课时 重要有机物之间的相互转化重要有机物之间的转化有机化合物的性质主要取决于它所具有的官能团,有机化合物的反应往往围绕官能团展开,了解官能团之间的相互转化,能帮助我们进一步掌握有机化合物的内在联系:各有机物之间转化的化学方程式: ①CH 3CH 3+Br 2――→光照CH 3CH 2Br +HBr ②CH 2===CH 2+HBr ――→催化剂△CH 3CH 2Br③CH 3CH 2Br +KOH ――→醇△CH 2===CH 2↑+KBr +H 2O④CH 2===CH 2+H 2――→Ni△CH 3CH 3⑤CH 2===CH 2+H 2O ――→催化剂△CH 3CH 2OH⑥CH 3CH 2OH ――→浓硫酸170 ℃CH 2===CH 2↑+H 2O⑦2CH 3CH 2OH +O 2――→Cu 或Ag△2CH 3CHO +2H 2O⑧CH 3CHO +H 2――→Ni加热、加压CH 3CH 2OH⑨2CH 3CHO +O 2――→催化剂2CH 3COOH ⑩CH ≡CH +H 2――→催化剂CH 2===CH 2 ⑪CH 3COOC 2H 5+H 2OH +△CH 3COOH +C 2H 5OH⑫CH 3CH 2OH +CH 3COOH浓硫酸△CH 3COOC 2H 5+H 2O⑬CH 3CH 2Br +H 2O ――→NaOH△CH 3CH 2OH +HBr⑭CH 3CH 2OH +HBr ――→△CH 3CH 2Br +H 2O探究点一 有机合成过程中官能团的引入、消除与转化(2)不饱和烃与卤素单质、卤化氢的加成反应。
例如:CH 2===CHCH 3+Br 2―→CH 2Br —CHBrCH 3 CH 2===CHCH 3+HBr ―→CH 3—CHBrCH 3 CH ≡CH +HCl ――→催化剂CH 2===CHCl (3)醇与氢卤酸的取代反应。
例如: R —OH +HX ――→△R —X +H 2O2.羟基的引入方法 (1)醇羟基的引入方法 ①烯烃水化生成醇。

高中化学必修课----羧酸酯知识讲解及巩固练习题(含答案解析)【学习目标】1、掌握乙酸的组成、结构、性质和用途;2、掌握羧酸的组成、结构、性质及其应用;3、了解酯的结构及主要性质;4、掌握重要的有机物之间的相互转化,学会在有机合成与推断中应用。
【要点梳理】要点一、羧酸的结构、通式和性质【高清课堂:羧酸和酯#羧酸的结构特征、分类及饱和一元酸的通式】1.羧酸的组成和结构。
(1)羧酸是由烃基(或H)与羧基相连组成的有机化合物。
羧基()是羧酸的官能团。
(2)羧酸有不同的分类方法:2.羧酸的分子通式。
一元羧酸的分子通式为R—COOH,饱和一元脂肪羧酸的分子通式为C n H2n O2或C n H2n+1—COOH。
分子式相同的羧酸、羧酸酯、羟基醛、羟基酮等互为同分异构体。
3.羧酸的主要性质。
(1)羧酸的沸点比相应的醇的沸点高;碳原子数在4以下的羧酸能与水互溶,随着分子中碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
【高清课堂:羧酸和酯#羧酸的化学性质】(2)羧酸的化学性质。
①弱酸性。
由于—COOH能电离出H+,使羧酸具有弱酸性。
而羧酸具有酸类物质的通性。
如:2RCOOH+Na2CO3—→2RCOONa+CO2↑+H2ORCOOH+NH3—→RCOONH4常见的一元羧酸的酸性强弱顺序为:②酯化反应。
注意:可以用同位素示踪法证实酯化反应过程是羧酸分子中羧基中的羟基与醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。
无机含氧酸与醇作用也能生成酯,如:C2H5OH+HONO2—→C2H5—O—NO2+H2O(硝酸乙酯)③-H被取代的反应。
通过羧酸-H的取代反应,可以合成卤代羧酸,进而制得氨基酸、羟基酸等。
④还原反应。
由于羟基的影响,羧基中的羰基比醛、酮分子中的羰基较难发生加成反应,但在特殊试剂(如LiAlH4)的作用下,可将羧基还原为醇羟基。
RCOOH RCH2OH有机化学上可用此反应实现羧酸向醇的转化。
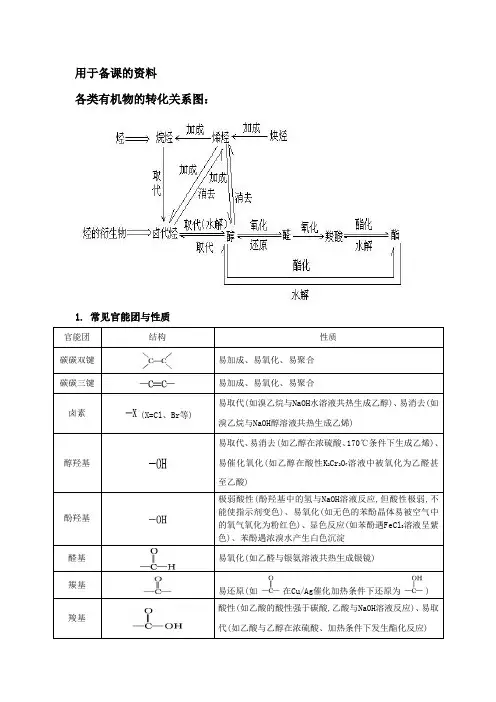
用于备课的资料各类有机物的转化关系图:1. 常见官能团与性质官能团结构性质碳碳双键易加成、易氧化、易聚合碳碳三键易加成、易氧化、易聚合卤素(X=Cl、Br等)易取代(如溴乙烷与NaOH水溶液共热生成乙醇)、易消去(如溴乙烷与NaOH醇溶液共热生成乙烯)醇羟基易取代、易消去(如乙醇在浓硫酸、170℃条件下生成乙烯)、易催化氧化(如乙醇在酸性K2Cr2O7溶液中被氧化为乙醛甚至乙酸)酚羟基极弱酸性(酚羟基中的氢与NaOH溶液反应,但酸性极弱,不能使指示剂变色)、易氧化(如无色的苯酚晶体易被空气中的氧气氧化为粉红色)、显色反应(如苯酚遇FeCl3溶液呈紫色)、苯酚遇浓溴水产生白色沉淀醛基易氧化(如乙醛与银氨溶液共热生成银镜)羰基易还原(如在Cu/Ag催化加热条件下还原为) 羧基酸性(如乙酸的酸性强于碳酸,乙酸与NaOH溶液反应)、易取代(如乙酸与乙醇在浓硫酸、加热条件下发生酯化反应)酯基易水解(如乙酸乙酯在稀硫酸、加热条件下发生酸性水解,乙酸乙酯在NaOH溶液、加热条件下发生碱性水解)烷氧基如环氧乙烷在酸催化下与水一起加热生成乙二醇硝基还原(如酸性条件下,硝基苯在铁粉催化下还原为苯胺)2. 有机反应类型与重要的有机反应反应类型重要的有机反应取代反应烷烃的卤代:CH4+Cl2CH3Cl+HCl烯烃的卤代:卤代烃的水解:CH3CH2Br+NaOH CH3CH2OH+NaBr皂化反应:+3NaOH3C17H35COONa+酯化反应:+C2H5OH+H2O 糖类的水解:122211C H O蔗糖+H2O6126C H O果糖+6126C H O葡萄糖二肽的水解:+H2O取代反应苯环上的卤代:+Cl2+HCl苯环上的硝化:++H2O苯环上的磺化:++H2O(续表) 反应类型重要的有机反应加成反应烯烃的加成:+HCl炔烃的加成:+H2O苯环的加氢:+3H2消去反应醇分子内脱水生成烯烃:C2H5OH+H2O卤代烃脱HX生成烯烃:CH3CH2Br+NaOH+NaBr+H2O加聚反应单烯烃的加聚:n共轭二烯烃的加聚:(此外,需要记住丁苯橡胶、氯丁橡胶的单体)缩聚反应二元醇与二元酸之间的缩聚:n+nHOCH2CH2OH+2nH2O 羟基酸之间的缩聚:+nH2O缩聚反应氨基酸之间的缩聚:苯酚与HCHO的缩聚:n+nHCHO+nH2O氧化催化氧化:2CH3CH2OH+O22CH3CHO+2H2O反应醛基与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O(注意配平)醛基与新制氢氧化铜的反应:CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O醛基加氢:CH3CHO+H2CH3CH2OH还原反应硝基还原为氨基:。

一、有机物间相互转化关系二、能与溴水发生化学反响而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃〔烯烃、炔烃、二烯烃等〕⑵ 不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕 ⑶ 石油产品〔裂化气、裂解气、裂化汽油等〕⑷ 含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕 ⑸ 天然橡胶〔聚异戊二烯〕 2、无机物:⑴ -2价的S 〔硫化氢及硫化物〕⑵ + 4价的S 〔二氧化硫、亚硫酸及亚硫酸盐〕 ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3+ 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 3 2FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2 ⑷ Zn 、Mg 等单质 如⑸ -1价的I 〔氢碘酸及碘化物〕变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O变色Mg + Br 2 === MgBr 2 〔其中亦有Mg 与H +、Mg 与HBrO 的反响〕△HBrO + Na2CO3 = NaBrO + NaHCO3三、能萃取溴而使溴水褪色的物质上层变无色的〔ρ>1〕:卤代烃〔CCl4、氯仿、溴苯等〕、CS2等;下层变无色的〔ρ<1〕:直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃〔如己烷等〕等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃〔烯烃、炔烃、二烯烃等〕⑵不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕⑶石油产品〔裂化气、裂解气、裂化汽油等〕⑷醇类物质〔乙醇等〕⑸含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕⑹天然橡胶〔聚异戊二烯〕⑺苯的同系物2、无机物:⑴氢卤酸及卤化物〔氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物〕⑵ + 2价的Fe〔亚铁盐及氢氧化亚铁〕⑶-2价的S〔硫化氢及硫化物〕⑷ + 4价的S〔二氧化硫、亚硫酸及亚硫酸盐〕⑸ 双氧水〔H 2O 2〕五、常见的各类有机物的官能团,构造特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 构造特点:键角为109°28′,空间正四面体分子。
第3讲有机反应及有机物之间的相互转化[考点点拨]有机物的性质是由它所具有的官能团的结构所决定的,考试说明中明确指出:以一些典型的烃类化合物和烃类衍生物为例,了解官能团在化合物中的作用。
掌握各主要官能团的性质和主要化学反应,并能结合同系列原理加以应用。
能通过各化合物的化学反应,掌握有机反应的主要类型。
这部分知识是高考有机化学知识中的重要部分,大致可分为两大类,一是根据烃的衍生物的性质设题,二是根据有机物的衍变关系设题。
本讲主要分析第一点,它的高考命题方向是结合生活生产中常见的物质如Ve、Va、牛油、阿司匹林等设计成选择题,填空题,推断题,考查学生认识、理解运用烃的衍生物的主要官能团的性质,从而考查学生的思维能力。
[智能整合]1、有机反应类型及相应有机物归类(1)取代反应:烷烃(卤代),苯及其同系物(卤代、硝化),醇(卤代),苯酚(溴代),酯化,水解。
(2)加成反应:烯烃(加X2、H2、HX、H2O),炔烃(加X2、H2、HX),苯(加H2),(加H2),油酯(氢化)(3)消去反应:卤代烃脱卤化氢,醇分子内脱水(4)氧化反应:烯、炔、醇、醛、烷基苯等(5)还原反应:醇、葡萄糖、与氢气有关加成(6)加聚反应:乙烯、异戊二烯、氯乙烯等(7)缩聚反应:苯酚和甲醛等2、近年对官能团性质的考查已发展到给信息再进行官能团的性质考查,本讲内容要求考生在掌握烃的衍生物的代表物性质的基础上进一步理解官能团的定义,掌握官能团之间相互转化的规律及有机物的反应类型,,具体来说包括:(1)一元衍生关系重组为二元乃至多元衍生关系;(2)链状衍生关系迁移为环状衍生关系;(3)小分子衍生关系转化为高分子化合物衍生关系;[典例解析][典型例题1](06年上海高考—29).已知(注:R,R’为烃基)A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。
A能发生如下图所示的变化。
有机化学反应的官能团转化有机化学反应是研究碳元素和其它元素之间的相互作用和官能团转化的重要分支。
在有机合成中,官能团转化是一种关键的方法,通过改变官能团的性质和结构,可以合成各种有机化合物。
本文将讨论几种常见的有机化学反应及其官能团转化。
一、醇的官能团转化醇是一类官能团丰富的有机化合物,可以通过不同的反应转化成其他有机化合物。
其中,醇的氧化反应是一种常见的官能团转化方法。
例如,一级醇可以通过氧化反应转化为相应的醛,而二级醇则可以转化为酮。
氧化反应可以使用氧化剂如酸性高锰酸钾或碳酸氢钠等实现。
此外,醇还可以通过酸催化的消除反应转化为烯烃。
当醇与酸催化剂反应时,醇分子中的羟基可以被去质子化,形成烯醇中间体,随后通过E1或E2机制发生消除反应形成烯烃。
这种官能团转化方法在有机合成中得到广泛应用。
二、酮和醛的官能团转化酮和醛也是常见的有机官能团,可以通过多种反应进行官能团转化。
其中,氧化还原反应是一种重要的官能团转化方法。
通过还原反应,酮可以转化为相应的醇,而醛可以转化为一级醇。
还原反应可以使用氢气和催化剂如铂或铑等实现。
此外,酮和醛还可以通过亲核试剂的加成反应进行转化。
例如,酮和醛可以与胺或醇进行加成反应,形成相应的亚胺或醚。
这种官能团转化方法在合成药物和天然产物中得到广泛应用。
三、酸和酯的官能团转化酸和酯是有机化合物中常见的官能团,它们可以通过多种反应进行官能团转化。
酸的还原反应是一种常见的官能团转化方法,通过还原反应,酸可以转化为相应的醇。
另外,酸可以通过酰氯化反应转化为酸氯,而酸氯则可以与胺或醇进行取代反应,形成酰胺和酯。
这种官能团转化方法在有机合成中得到广泛应用。
四、酯和酰胺的官能团转化酯和酰胺是有机化合物中常见的官能团,它们可以通过多种反应进行官能团转化。
其中,水解反应是一种重要的官能团转化方法。
酯和酰胺可以与水反应形成相应的醇和酸或胺。
水解反应可以通过酸催化或碱催化等实现。
此外,酯和酰胺还可以通过胺或醇的加成反应进行官能团转化。
自然界中的事物是多样且复杂的,它们之间存在着相互联系、相互作用和相互转化的关系,这种关系贯穿于自然界的各个角落,无处不在。
以下将从不同的角度探讨自然界中事物的相互关系,以此展示自然界的美妙之处。
一、生态系统中的相互关系生态系统是由生物群落和非生物物种相互作用所形成的动态系统。
在生态系统中,各种生物之间相互依存、相互制约,形成了复杂的食物链和食物网。
植物通过光合作用将太阳能转化为化学能,并供给其他生物的生存所需要的有机物质,如鸟类和昆虫。
而一些动物则以其他动物为食,形成食物链的层次结构。
微生物在土壤中分解有机物质,为植物的生长提供养分。
这种相互依存、相互制约的关系构成了生态系统稳定运行的基础。
二、水循环和能量转化的相互关系水是地球上最重要的资源之一,而水循环则是自然界中的重要循环过程之一。
水循环包括蒸发、凝结、降水和地表径流等过程,这些过程之间形成了紧密的相互联系。
太阳能的照射使得水体蒸发成为水蒸气,形成了云层;而云层在特定条件下会发生凝结并降水,将水分输入到地表水体中。
与此水也是传导热量的媒介,能够调节地球温度,这体现了水和能量之间的相互转化关系。
三、硅循环和生物地球化学循环的相互关系硅是地球上丰富的元素之一,其循环与生物地球化学循环密切相关。
硅循环包括岩石的风化过程、河流输运和海洋沉积等过程,而生物地球化学循环则包括生物体的生长、新陈代谢和逝去等过程。
这两者之间存在着紧密的相互作用。
硅元素通过生物的摄取和释放,在海洋中形成了硅酸盐的循环;而硅的沉积也影响着海洋生态系统的结构和功能。
这种硅循环和生物地球化学循环的相互关系体现了地球上物质的循环利用和再生利用的原则。
四、气候变化和生态系统的相互关系随着全球气候变暖,气候变化对生态系统的影响日益凸显。
生态系统作为自然界中的一个重要组成部分,受气候变化的影响而发生改变。
气候变暖导致了特殊天气事件的频繁发生,对植被、动物和微生物的生存和生长产生了影响;生态系统的变化也反过来影响气候,例如植被的变化会对地表温度和降水量产生影响。