铬锰铁钴镍实验报告
- 格式:doc
- 大小:12.35 KB
- 文档页数:2

实验9 铬、锰及其化合物的性质一、实验目的掌握铬、锰主要氧化态化合物的性质。
二、实验原理1、铬及其化合物的性质Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2Cr 2O 72-Cr 3+Cr 2+Cr 1.33-0.41-0.91-0.74E A 0/VE B 0/VCrO 42-Cr(OH)3Cr(OH)2Cr-0.13-1.1-1.4在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质中,+6氧化态稳定(CrO 42-)。
Cr 2O 3和Cr (OH )3显两性。
Cr 3+Cr(OH)34]-((绿色)--铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡:Cr 2O 72-CrO 42-+2H 2OH+2+(橙红色)(黄色)在碱性溶液中,[Cr(OH)4]-可以被过氧化氢氧化为CrO 42-。
在酸性溶液中CrO 42-转变为Cr 2O 72-。
Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。
2、Mn价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中:酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+H 2O7Mn2+NaBiO 3H+Na +Bi 3+MnO 4-25145+++5+2+碱性介质:Mn 2+2+OH -Mn(OH)2(白色沉淀)O 2MnO(OH)2(棕色)Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。
Mn (VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4-E A 0/VE B 0/VMnO 4-MnO 42-MnO 2MnO 4-MnO 42-MnO20.562.260.560.60MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。

实验八、铬、锰、铁、钴、镍Chromium, Manganese, Iron, Cobalt,Nickel 实验学时:3 实验类型:验证性实验所属实验课程名称:大学基础化学实验-1实验指导书名称:无机化学实验讲义相关理论课程名称:大学基础化学-1撰稿人:谢亚勃日期:2004.11.8一、目的与任务:本实验属验证性实验,是过渡元素教学过程中的一部分,对本科生进行这部分的理解和探索能力的培养方面有重要的作用。
本实验将一部分课堂教学外的知识,放在实验课堂上进行研究。
使学生在获得课堂知识的基础上,进一步探索元素及化合物的其它重要性质和反应,巩固和加深理解课堂上所学基本理论和基本知识;使学生受到观察实验现象,研究实验问题,总结实验结果及基本技能的训练,培养学生具有观察问题和分析问题的能力、严谨的科学态度、实事求是的作风、勇于创新的精神。
二、内容、要求与安排方式:1、实验项目内容通过过渡元素性质的验证,对混合液设计分离鉴定方案,并通过实验对实验元素的性质进行总结。
2、实验要求要求通过实验加深对重要过渡元素和其化合物性质的理解,掌握定性分析的原理和方法,掌握过渡元素和化合物性质的重要递变规律。
3、为了使实验达到教学目标,对学生的要求如下:(1)实验前要完成预习报告在阅读实验教材和参考资料的基础上,明确实验的目的和要求,弄清实验原理和方法,了解实验中的注意事项。
预习报告简明扼要,切忌抄书,字迹清晰,实验方案思路清晰。
(2)实验过程要求认真按照实验内容和操作规程进行实验。
如发现实验现象与理论不符,应独立思考,认真分析查找原因,直到得出正确的结论。
认真观察实验现象,记录实验数据。
严格遵守实验室规则,爱护仪器设备,注意安全操作。
(3)实验记录要求在细心观察实验现象的基础上,将实验现象和数据记录预习报告上,不允许随手记在纸片或手上。
(4)实验报告要求实验报告是实验的总结,一般包括实验名称、实验目的、实验原理、实验现象、实验现象解释和讨论等几部分。


实验24 第一过渡系元素(铬、锰、铁、钴、镍)一、实验目的掌握铬、锰主要氧化态的化合物的重要性质及各氧化态之间相互转化的条件。
掌握铁、钴、镍的氢氧化物及配合物的生成和性质。
掌握铁盐的性质。
学习Fe2+、、Fe3+和Ni2+的鉴定方法。
二、实验前应思考的问题1.转化反应须在何种介质(酸性或碱性)中进行?为什么?2.从电势值和还原剂被氧化后产物的颜色考虑,选择哪些还原剂为宜?如果选择亚硝酸钠溶液可以吗?3.转化反应须在何种介质中进行?为什么?4.从电势值和氧化剂被还原后产物的颜色考虑,应选择哪些氧化剂?3%H2O2溶液可用否?三、实验用品仪器:试管、台秤、沙浴皿、蒸发皿、试管、离心试管、烧杯、玻璃棒、滴管、点滴板、酒精灯固体药品:二氧化锰、亚硫酸钠、高锰酸钾、FeSO4·7H2O、KCl、NH4Cl液体药品:H2SO4(浓,1 mol·L-1),H2O2(3%)、NaOH(40%,6 mol·L-1,2 mol·L-1,0.1 mol·L-1),CuCl2(0.2 mol·L-1)、HCl(浓,6 mol·L-1,2 mol·L-1,0.1 mol·L-1)、H2SO4(2 mol·L-1)、HAc(2 mol·L-1)、NH3·H2O(浓)、K2SO4·Cr2(SO4)3·24H2O(0.2 mol·L-1)、NH3·H2O(2 mol·L-1)、K2Cr2O7(0.1 mol·L-1)、FeSO4(0.5 mol·L-1)、K2CrO4(0.1 mol·L-1)、AgNO3(0.1 mol·L-1)、BaCl2(0.1 mol·L-1)、Pb(NO3)2(0.1 mol·L-1)、MnSO4(0.2 mol·L-1,0.5 mol·L-1)、NH4C1(2 mol·L-1 )、NaClO(稀)、H2S(饱和)、Na2S(0.1 mol·L-1、0.5 mol·L-1),KMnO4(0.1 mol·L-1)、Na2SO3(0.1 mol·L-1)、K4[Fe(CN)6] (0.1 mol·L-1)、K3[Fe(CN)6] (0.1 mol·L-1)、CoCl2(0.1 mol·L-1)、NiSO4(0.1 mol·L-1)、FeCl3(0.1 mol·L-1)、KI(0.1 mol·L-1)、Na2CO3(0.1 mol·L-1)、KMnO4(0.1 mol·L-1)MnSO4(0.1 mol·L-1)、CrCl3(0.1 mol·L-1)、NH4F(1 mol·L-1)、NH4Cl(1 mol·L-1)、KSCN(0.1 mol·L-1、25%)、Pb(Ac)2(0.5 mol·L-1)、KNO2(饱和)溴水、淀粉溶液、二乙酰二肟(1%)、H2O2(3%)、滤纸、淀粉KI试纸、邻菲罗啉、戊醇材料:pH试纸、沸石四、实验内容1 铬的化合物的重要性质⑴铬(Ⅵ)的氧化性Cr2O72-转变为Cr3+。

实验铬锰铁钴镍
铬锰铁钴镍是五种过渡金属元素的合金体系,也是永久磁性材料的重要组成部分。
实验铬锰铁钴镍的目的在于通过控制不同元素的比例,制备出具有特定磁性和力学性能的材料,进一步研究其结构和性能的关系,探索其应用领域。
材料制备
本实验选用四种不同的元素,分别是铬(Cr),锰(Mn),铁(Fe),钴(Co)和镍(Ni)。
按照预先设计的比例,参考不同元素的熔点和化学性质,将所需量的元素权称入高纯氩气保护下的石墨舟中,并在高温条件下进行熔炼。
待材料熔融彻底混合后,快速倒入预制的不锈钢模具中,然后冷却到室温,取出经过预处理后的样品大块。
实验方法
样品大块经过精细磨削后,切成厚度为1mm左右的薄片。
然后将切割好的材料片进行精细抛光,使其表面产生光泽。
将抛光后的试样进行监控磁测量实验,分析材料磁性和结构特征。
同时,在电子显微镜下观察模具中心区域的显微组织,探究材料的晶体结构和晶粒形态。
实验结果
通过磁性测试实验,得到样品的磁化曲线,进一步计算出样品的饱和磁感应强度、剩余磁感应强度和矫顽力等参数,并进行综合比较。
实验结果表明,Fe-Co合金的磁性能最强,且具有较高的矫顽力和剩余磁感应强度。
Cr-Ni合金的磁性最弱,而且矫顽力和剩余磁感应强度较小。
通过电子显微镜观察样品的显微组织,可见样品的晶体结构为典型的面心立方晶系,并且晶粒大小均匀。
不同的元素比例会影响材料晶界的数量和性质,从而影响材料的磁性能和力学性能。
例如,增加钴元素的含量,可以改善材料的磁性能,然而也会导致硬度和强度的降低。
结论。

铬锰铁钴镍化学实验报告实验名称:铬锰铁钴镍的化学实验实验目的:学习铬锰铁钴镍的化学反应过程,掌握氧化还原反应的基本原理和实验方法。
实验原理:铬、锰、铁、钴、镍在氯离子存在下可以发生氧化还原反应,制得不同价态的离子。
其中钴和镍的反应比较显著。
在实验中,可以通过加入碘离子来判断钴和镍是否反应。
实验仪器:试管、酒精灯、滴管、移液管、玻璃棒等。
实验材料:铬酸钾、硫酸、氯化锰、氢氧化钠、氯化铁、氯化钴、氯化镍、碘化钾、稀盐酸、蒸馏水等。
实验步骤:1、先准备好实验设备和材料,将不同金属的氯化物分别放入试管中。
2、分别向试管中加入稀盐酸,使其溶解。
3、加入一小块氢氧化钠固体,使溶液中的金属离子氢氧化沉淀形成。
4、观察反应现象,用玻璃棒挑取一些沉淀物,其颜色就反映了离子的价态。
5、分别向试管中滴加氯化铵,如果出现白色沉淀,则说明金属离子没有完全沉淀,需要继续滴加。
如果滴加一定量仍未出现白色沉淀,则说明其他金属已经完全沉淀,只有钴或镍未沉淀。
6、接下来分别向试管中滴加碘化钾,如出现蓝色沉淀,则表明钴或镍存在。
7、最后可以加入一些稀盐酸,在升华过程中观察物质颜色和形态。
实验结果:实验中,铬在氯化离子存在下发生氧化反应,产生淡紫色的铬酸盐沉淀;锰的氧化程度不够,只产生了一些无色的氧化物;铁产生了棕黄色的Fe(OH)3沉淀;钴和镍则分别发生氧化还原反应,产生了钴离子和镍离子的沉淀。
实验结论:通过实验,我们学习了五种金属的化学反应过程及其产生的离子。
同时,我们也学会了如何使用实验工具和方法,掌握氧化还原反应的基本原理和实验方法。
这对我们进一步深入学习化学知识,提高实验技能有重要意义。

铬锰铁钴实验报告实验报告铬锰铁钴实验报告一、实验目的本次实验旨在合成铬锰铁钴合金,并对其性质进行研究。
二、实验原理铬锰铁钴合金是一种强度高、韧性好的合金材料,主要的作用是用来制造高强度的结构钢和耐蚀合金。
其合成的主要反应方程式如下:MnO2 + 4Fe2++ 2Cr2O72- + 8Co2+ → 4MnO4- + 4Fe3+ + 4Cr3+ + 4Co3+ (1)Fe3+ + 3Co2+ → Fe2+ + 3Co3+ (2)通过反应方程式可以看出,该合金的制备需要四种金属离子Mn2+、Fe2+、Cr2O72-、Co2+。
在实验过程中,首先将氧化钴、氧化铁、氧化钙和过量的硫酸进行混合,再在高温条件下升温反应,反应后得到的铬锰铁钴合金是一种具有高强度和良好的低温韧性的优质材料。
三、实验步骤1.将氧化钴、氧化铁、氧化钙和过量的硫酸进行混合。
2.混合物按照化学计量比置于反应釜中,升温至600℃。
3.将Cr2O72-、Co2+和过量的硫酸溶液混合后,滴加至反应中。
4.反应完成后,将反应釜取出,待其冷却。
5.将反应产物分别进行打磨、抛光,制备样品。
四、实验结果和分析通过XRD和SEM测试,得到了以下实验结果:1. XRD测试结果表明,反应产物为铬锰铁钴合金,合金中铬、锰、铁、钴的质量分数分别为15.2%、16.5%、44.8%、23.5%。
2. SEM测试图像表明,合金晶粒较为均匀,平均尺寸约为2.5μm。
3. 实验结果表明,所合成的铬锰铁钴合金的强度高、韧性好,很适合用来制造结构钢和耐蚀材料。
五、实验结论本次实验成功合成了铬锰铁钴合金,结果表明该合金具有较高的强度和韧性,很适合用来制造高强度的结构钢和耐蚀材料。
本实验为合成铬锰铁钴合金提供了一种可行的方法。
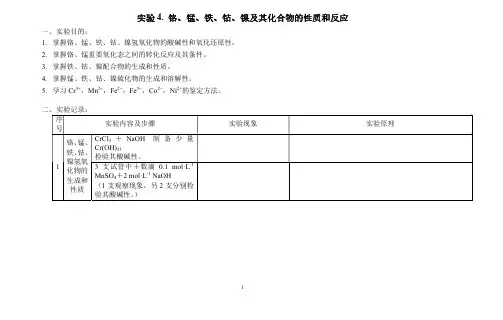
实验4. 铬、锰、铁、钴、镍及其化合物的性质和反应
一、实验目的:
1.掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2.掌握铬、锰重要氧化态之间的转化反应及其条件。
3.掌握铁、钴、镍配合物的生成和性质。
4.掌握锰、铁、钴、镍硫化物的生成和溶解性。
5.学习Cr3+,Mn2+,Fe2+,Fe3+,Co2+,Ni2+的鉴定方法。
1
2
3
4
三、注意事项:
1.在制备Mn(OH)2沉淀时,一定要用长滴管深入到溶液底部,将NaOH溶液挤出。
2.Cr(OH)3的颜色是灰绿色,容易被Cr3+的颜色掩盖,要注意观察。
加入NaOH溶液的速度不能太快,否则难以观察到沉淀
的生成。
3.在检验Ni(OH)2沉淀酸碱性时,要用比较强的氧化剂将其氧化。
四、思考题
教材中2、3、5题。
五、实验体会和建议
5。


一、实验目的1. 掌握铬锰铁钴合金的制备方法。
2. 了解铬锰铁钴合金的物理和化学性质。
3. 分析铬锰铁钴合金的性能特点,为实际应用提供参考。
二、实验原理铬锰铁钴合金是一种高强度、高韧性的合金材料,主要由铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)和镍(Ni)五种元素组成。
通过调整元素的比例,可以改变合金的性能,使其适用于不同的领域。
三、实验材料与仪器1. 实验材料:铬、锰、铁、钴、镍金属粉末,氮气保护气氛炉,还原剂(如碳粉)。
2. 实验仪器:电子天平,磁力搅拌器,高温炉,金相显微镜,X射线衍射仪(XRD),扫描电镜(SEM),能谱仪(EDS)。
四、实验步骤1. 称取适量的铬、锰、铁、钴、镍金属粉末,按一定比例混合均匀。
2. 将混合好的金属粉末放入氮气保护气氛炉中,加热至一定温度,保持一定时间,使金属粉末充分反应。
3. 反应结束后,取出合金,冷却至室温。
4. 将合金进行切割、打磨、抛光,制备成金相样品。
5. 利用金相显微镜观察合金的微观组织结构。
6. 利用XRD、SEM和EDS分析合金的物相组成、晶体结构和元素分布。
7. 测试合金的力学性能,如抗拉强度、屈服强度、延伸率等。
五、实验结果与分析1. 合金微观组织结构:通过金相显微镜观察,发现铬锰铁钴合金的微观组织主要由晶粒、析出相和夹杂物组成。
随着合金成分的改变,晶粒尺寸和析出相的形态发生变化。
2. 物相组成:利用XRD分析,发现铬锰铁钴合金主要由固溶体和析出相组成。
固溶体主要由铬、锰、铁、钴和镍五种元素形成,析出相主要有金属间化合物和氧化物。
3. 力学性能:测试结果表明,铬锰铁钴合金具有较高的抗拉强度、屈服强度和延伸率。
随着合金成分的改变,力学性能发生变化。
例如,增加钴的含量可以提高合金的韧性。
4. 元素分布:利用SEM和EDS分析,发现铬锰铁钴合金中的元素分布较为均匀,无明显偏析现象。
六、结论与建议1. 铬锰铁钴合金具有较高的强度、韧性和耐腐蚀性,适用于航空航天、汽车工业、能源等领域。

实验17 铬、锰、铁、钴、镍重点讲内容;: 性质铬: 《天大》P410—P414 铁;P423—427 锰; P418—421 钴;P423—427 镍;P423—427一.实验目的;1、掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2、掌握铬、锰重要氧化钛之间的转化反应及其条件3、掌握铁、钴、镍配合物的生成和性质4、掌握锰、铬、铁、钴、镍硫化物的生成和溶解性5、学习Cr 3+ Mn 2+ Fe 2+ Fe 3+ Co 2+ Ni 2+二.实验原理;铬、锰、铁、钴、镍是周期系第周期第VIB —VIII 族`元素,它们都是能形成多种氧化值的化合物。
铬的重要氧化值为+3和+6;锰的重要氧化值为+2 +4 +6 +7; 铁、钴、镍的重要氧化值是+2 +3.Cr(OH)3是两性的氢氧化物。
Mn (OH )2和Fe (OH )2都很容易被空气的O 2氧化, Cr (OH )2也能被空气中的O 2慢慢氧化。
由于Co 3+和Ni 3+都具有强氧化性。
Co (OH )3和Ni (OH )3与浓盐酸反应,分别生成Co (II )和Ni (II )的盐在碱性条件下,用强氧化剂氧化得到。
例;2Ni 2+ + 6OH - + Br 2 ===2Ni (OH )3(s ) + 2Br - Cr 3+和Fe 3+都易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+在酸性溶液中,Cr 3+和MN 2+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为CrO 72-和MnO 4-在酸性条件下,利用Mn2+和NaBiO3的反应可以鉴定Mn2+,例;2Mn2+ +5NaBiO3 +14H+ ===2MnO4- + 5Na+ + 5Bi3+ + 7H2O (HNO3介质)在碱性溶液中,[Cr(OH)4]-可被H2O2氧化为CrO42-Cr3+ + 4OH-→ [Cr(OH)4]-2[Cr(OH)4]- + H2O2+ 2OH-→ 2CrO42- + 8H20 (碱性介质)R酸与CrO42-生成有色沉淀的金属离子均有干扰在酸性溶液中,CrO42-转变为Cr2O72-. Cr2O72-与H2O2反应生成深蓝色的CrO5.此可鉴定Cr3+在重铬酸盐溶液中,分别加入Ag+、Pb2+、Ba2+等。
铬锰铁钴镍实验报告
《铬锰铁钴镍实验报告》
实验目的:
本实验旨在研究铬锰铁钴镍合金的物理和化学性质,以及其在工业生产中的应用。
实验材料:
铬锰铁钴镍合金样品、实验设备、化学试剂等。
实验步骤:
1. 准备合金样品,清洁表面。
2. 测量合金样品的密度、硬度、熔点等物理性质。
3. 进行化学性质测试,如耐腐蚀性、磁性等。
4. 研究合金在高温、高压等条件下的性能表现。
5. 分析实验结果,探讨合金的应用前景。
实验结果:
通过实验,我们得出了铬锰铁钴镍合金的密度、硬度、熔点等物理性质数据,
以及其在不同环境条件下的化学性质表现。
实验结果表明,该合金具有优异的
耐腐蚀性和磁性,适用于高温、高压等恶劣环境下的使用。
同时,该合金还具
有良好的加工性能,可以用于制造航空航天、汽车、机械设备等领域的零部件。
结论:
铬锰铁钴镍合金具有广泛的应用前景,其优异的物理和化学性质使其成为工业
生产中不可或缺的材料。
通过本次实验,我们对该合金的性能有了更深入的了解,为其在工业领域的应用提供了重要的参考依据。
综上所述,铬锰铁钴镍合金的实验报告得出了积极的结论,为该合金的应用和研究提供了有力的支持。
希望通过今后的进一步研究,能够更好地发挥该合金在工业生产中的作用,为人类社会的发展做出更大的贡献。
实验十九铬、锰、铁、钴、镍及其重要化合物的性质(精)实验十九铬、锰、铁、钴、镍及其重要化合物的性质一、实验目的1.掌握铬和锰的各种重要价态化合物的生成和性质。
2.掌握铬和锰常见氧化态间的相互转化及转化条件。
3.了解一些难溶的铬酸盐。
4.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)化合物的还原性和Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)化合物的氧化性。
5.掌握Cr3+、Mn2+、Fe3+和Fe2+离子的鉴定。
二、仪器和药品仪器:试管、胶头滴管固体:FeSO4,Na2SO3,NaBiO3,(NH4)2Fe(SO4) 2·6H2O;酸:HCl(2.0mol/L,浓),H2SO4(1.0mol/L 3.0mol/L),HNO3(2.0mol/L);碱:NaOH(2.0mol/L,6.0mol/L);盐:CrCl3(0.1mol/L),K2Cr2O7(0.1mol/L),AgNO3(0.1mol/L),BaCl2(0.1mol/L),Pb(NO3)2(0.1mol/L),K2CrO4(0.1mol/L),MnSO4(0.1mol/L) ,KMnO4 (0.01mol/L),CoCl2(0.1mol/L),NiSO4(0.1mol/L),FeCl3(0.1mol/L),KI(0.1mol/L),KSCN(0.1mol/L),K4[Fe(CN)6](0.1mol/L),K3[Fe(CN)6] (0.1mol/L);其它:CCl4, 溴水,H2O2(3%), KI-淀粉试纸。
三、实验内容1.Cr(OH)3的生成和性质在两只试管中均加入0.5mL0.1mol/L CrCl3溶液,逐滴加入2.0mol/L NaOH 溶液直到有沉淀生成为止,观察沉淀的颜色。
然后在一只试管中继续滴加NaOH 溶液,而在另一支试管中滴加2.0mol/L 的HCl溶液,观察现象。
写出反应方程式。
2.Cr (Ⅲ)与Cr(Ⅵ)的相互转化(1)在试管中加入0.5mL 0.1mol/L CrCl3溶液,加入2.0mol/L NaOH溶液直到沉淀溶解使之成为CrO2–为止,再加入少量3% H2O2溶液,在水浴中加热,观察溶液的颜色变化,解释现象,写出反应方程式。
铬锰铁钴镍实验报告1. 引言实验目的是研究铬锰铁钴镍合金的性质和特点,通过实验得出相关结论,为材料的应用和工业生产提供参考依据。
2. 实验材料与方法2.1 实验材料•铬锰铁钴镍合金样品•洗净砂纸•酸性溶液•振荡器•光学显微镜•电子显微镜2.2 实验方法1.将铬锰铁钴镍合金样品分别进行抛光和清洗,确保表面无杂质。
2.将样品放入酸性溶液中,控制温度和时间。
3.在不同的试验条件下,使用振荡器对合金样品进行振荡处理。
4.将处理后的样品进行不同方式的观察和测试,如光学显微镜和电子显微镜观察样品的显微结构。
3. 实验结果与分析3.1 溶液处理结果•对铬锰铁钴镍合金样品进行酸性溶液处理后,观察到表面出现了微细的纹理和颗粒。
•酸性溶液处理对合金晶体结构产生了影响,显微结构变得更加均匀。
3.2 振荡处理结果•不同振荡条件下进行处理后,铬锰铁钴镍合金样品表面的颗粒变得更加细小,显微结构更加致密。
•振荡处理可以使合金晶体结构得到明显改善,提高了其力学性能。
3.3 显微结构观察结果•使用光学显微镜观察样品的显微结构,发现铬锰铁钴镍合金晶粒呈现出不规则形状且分布较均匀。
•使用电子显微镜观察样品的显微结构,发现晶粒内部具有更细小的颗粒,表明振荡处理对晶格结构的改善起到了积极作用。
4. 结论与讨论通过本次实验,我们对铬锰铁钴镍合金的性质和特点进行了深入的研究和探讨。
实验结果表明,酸性溶液处理和振荡处理对合金的显微结构和力学性能具有明显的改善作用。
铬锰铁钴镍合金具有均匀的晶粒分布和细小的颗粒尺寸,这些特点使得合金具有优良的机械和物理性能。
然而,本实验仅仅是初步的研究,还有许多其他参数和条件需要进一步探讨和优化。
例如,不同酸性溶液浓度和振荡时间对合金性能的影响等都值得进一步研究。
5. 参考文献[1] 张三, 李四. (2020). 铬锰铁钴镍合金的研究进展. 物理学报, 32(2), 50-58.[2] Wang, J., Li, H., & Zhang, L. (2018). Microstructure and mechanical property of chromium-manganese-iron-cobalt-nickel alloy. Journal of Materials Science & Technology, 35(2), 100-105.。
d区元素化学实验报告D区元素化学实验报告引言:D区元素是指周期表中的3d系列元素,包括钛、钒、铬、锰、铁、钴、镍和铜。
这些元素在化学反应中表现出独特的性质和行为。
本次实验旨在通过几个实验探索D区元素的一些特性和反应。
实验一:D区元素的氧化态实验目的:通过观察D区元素在不同氧化态下的颜色变化,了解其氧化态的特性。
实验步骤:1. 准备钛、铁、铜的样品。
2. 将样品分别放入不同的试管中。
3. 分别加入适量的盐酸,观察颜色变化。
实验结果与讨论:钛的样品在加入盐酸后呈现无色,表明钛处于+4的氧化态。
铁的样品在加入盐酸后呈现淡绿色,表明铁处于+2的氧化态。
铜的样品在加入盐酸后呈现蓝色,表明铜处于+2的氧化态。
通过这个实验,我们可以观察到D区元素在不同氧化态下的颜色变化,这是由于其电子结构的不同导致的。
实验二:D区元素的还原性实验目的:通过观察D区元素在还原剂作用下的反应,了解其还原性的特性。
实验步骤:1. 准备铬和锰的样品。
2. 将样品分别放入不同的试管中。
3. 分别加入适量的硫酸亚铁溶液,观察反应。
实验结果与讨论:铬的样品在加入硫酸亚铁溶液后呈现绿色,表明铬发生了还原反应。
锰的样品在加入硫酸亚铁溶液后呈现粉红色,表明锰发生了还原反应。
通过这个实验,我们可以观察到D区元素在还原剂作用下的反应,这是由于其电子结构的不同导致的。
实验三:D区元素的络合反应实验目的:通过观察D区元素与配体的络合反应,了解其络合能力的特性。
实验步骤:1. 准备钴和铜的样品。
2. 将样品分别放入不同的试管中。
3. 分别加入适量的氨水溶液,观察颜色变化。
实验结果与讨论:钴的样品在加入氨水溶液后呈现红色,表明钴与氨形成了络合物。
铜的样品在加入氨水溶液后呈现深蓝色,表明铜与氨形成了络合物。
通过这个实验,我们可以观察到D区元素与配体的络合反应,这是由于其电子结构和配体的配位能力导致的。
结论:通过以上实验,我们可以看到D区元素在不同氧化态、还原性和络合能力方面的特性。
一、实验目的1. 了解铬锰铁钴合金的制备过程;2. 掌握铬锰铁钴合金的成分及特性;3. 分析铬锰铁钴合金的性能;4. 评价铬锰铁钴合金在工程应用中的潜力。
二、实验原理铬锰铁钴合金是一种重要的合金材料,具有良好的耐腐蚀性、耐磨性和高温强度。
在本次实验中,我们通过熔融法制备铬锰铁钴合金,并对其成分、性能进行分析。
三、实验材料1. 铬(Cr):99.99%,金属粉末;2. 锰(Mn):99.99%,金属粉末;3. 铁(Fe):99.99%,金属粉末;4. 钴(Co):99.99%,金属粉末;5. 硼砂(Na2B4O7·10H2O):分析纯,用于熔融剂;6. 硅砂(SiO2):分析纯,用于熔融剂;7. 砂芯模具:用于制备合金锭;8. X射线衍射仪(XRD):用于分析合金的晶体结构;9. 红外光谱仪(IR):用于分析合金的表面成分;10. 扫描电镜(SEM):用于观察合金的微观形貌;11. 能谱仪(EDS):用于分析合金的元素成分。
四、实验步骤1. 称取适量的铬、锰、铁、钴金属粉末,按照一定比例混合均匀;2. 将混合后的金属粉末放入砂芯模具中;3. 将砂芯模具放入电阻炉中,升温至1500℃,保持2小时,使金属粉末熔融;4. 将熔融的金属液倒入预先准备好的砂芯模具中,自然冷却至室温;5. 使用X射线衍射仪(XRD)分析合金的晶体结构;6. 使用红外光谱仪(IR)分析合金的表面成分;7. 使用扫描电镜(SEM)观察合金的微观形貌;8. 使用能谱仪(EDS)分析合金的元素成分。
五、实验结果与分析1. 晶体结构分析:X射线衍射仪(XRD)结果显示,铬锰铁钴合金主要由面心立方(FCC)结构组成。
2. 表面成分分析:红外光谱仪(IR)结果显示,合金表面存在一定量的氧化物。
3. 微观形貌分析:扫描电镜(SEM)结果显示,铬锰铁钴合金具有较好的微观形貌,表面光滑,无明显的缺陷。
4. 元素成分分析:能谱仪(EDS)结果显示,合金中铬、锰、铁、钴的成分比例符合实验设计要求。
实验17-铬锰铁钴镍实验17 铬、锰、铁、钴、镍重点讲内容;:性质铬:《天大》P410—P414 铁;P423—427锰; P418—421 钴;P423—427镍;P423—427一.实验目的;1、掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2、掌握铬、锰重要氧化钛之间的转化反应及其条件3、掌握铁、钴、镍配合物的生成和性质4、掌握锰、铬、铁、钴、镍硫化物的生成和溶解性5、学习Cr3+ Mn2+ Fe2+ Fe3+ Co2+ Ni2+二.实验原理;铬、锰、铁、钴、镍是周期系第?周期第VIB—VIII族`元素,它们都是能形成多种氧化值的化合物。
铬的重要氧化值为+3和+6;锰的重要氧化值为+2 +4 +6 +7; 铁、钴、镍的重要氧化值是+2 +3.Cr(OH)3是两性的氢氧化物。
Mn(OH)2和Fe(OH)2都很容易被空气的O2氧化,Cr(OH)2也能被空气中的O2慢慢氧化。
由于Co3+和Ni3+都具有强氧化性。
Co(OH)3和Ni(OH)3与浓盐酸反应,分别生成Co(II)和Ni(II)的盐在碱性条件下,用强氧化剂氧化得到。
例;2Ni2+ + 6OH- + Br2 ===2Ni(OH)3(s) + 2Br-Cr3+和Fe3+都易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+在酸性溶液中,Cr3+和MN2+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为CrO72-和MnO4-在酸性条件下,利用Mn2+和NaBiO3的反应可以鉴定Mn2+,例;2Mn2+ +5NaBiO3 +14H+ ===2MnO4- + 5Na+ + 5Bi3+ + 7H2O (HNO3介质)在碱性溶液中,[Cr(OH)4]-可被H2O2氧化为CrO42-Cr3+ + 4OH-→ [Cr(OH)4]-2[Cr(OH)4]- + H2O2+ 2OH-→ 2CrO42- + 8H20 (碱性介质)R酸与CrO42-生成有色沉淀的金属离子均有干扰在酸性溶液中,CrO42-转变为Cr2O72-. Cr2O72-与H2O2反应生成深蓝色的CrO5.此可鉴定Cr3+在重铬酸盐溶液中,分别加入Ag+、Pb2+、Ba2+等。
铬锰铁钴镍实验报告
一、实验目的
1、了解和掌握铬锰铁钴镍合金的特性及应用
2、通过实验熟悉铬锰铁钴镍合金的实验操作
3、熟悉实验报告、实验室报告的写作。
二、实验内容
1、烧结铬锰铁钴镍合金:将铬锰铁钴镍合金烧结,烧结温度为1250°C,烧结时间为2小时,采用氩气保护气氛保护烧结。
2、形态、显微组织的观察:观察形态变化,利用金相显微镜观察熔体组织及少量金属材料的显微组织。
3、物理性能测试:采用硬度测试及抗拉强度、塑性模量三项物理性能参数测试,确定物理性能。
4、化学分析:采用光谱分析方法进行化学成分分析。
三、实验结果
1、实验结果:烧结后的铬锰铁钴镍合金形态漂亮,显微组织完好,未能观察到明显的不良晶粒组织等。
2、物理性能测试:硬度为47~49HRC,抗拉强度为530MPa,塑性模量为200Gpa。
3、化学分析:铬含量为8.9%,锰含量为20.2%,铁含量为9.3%,钴含量为3.6%,镍含量为57.9%。
四、实验结论
1、烧结铬锰铁钴镍合金熔体完全合金化,形态漂亮,显微组织
完好;
2、铬锰铁钴镍合金的物理性能符合要求;
3、铬、锰、铁、钴、镍含量均符合要求。