不同温度下常见化合物溶解度
- 格式:xls
- 大小:53.00 KB
- 文档页数:10

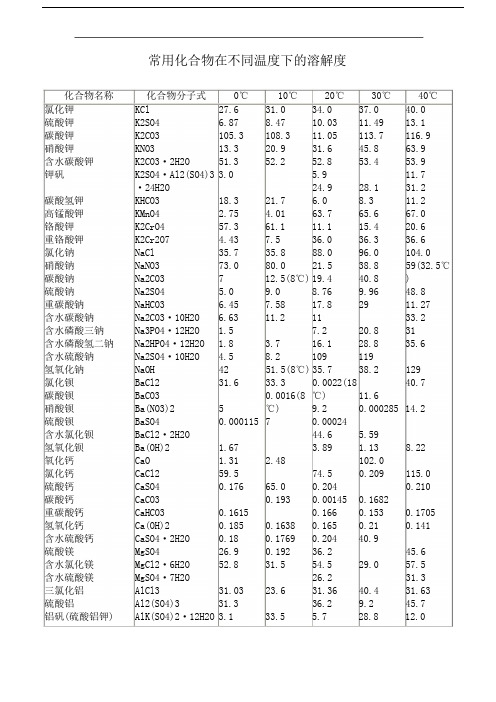
化合物名称氯化钾硫酸钾碳酸钾硝酸钾含水碳酸钾钾矾碳酸氢钾高锰酸钾铬酸钾重铬酸钾氯化钠硝酸钠碳酸钠硫酸钠重碳酸钠含水碳酸钠含水磷酸三钠含水磷酸氢二钠含水硫酸钠氢氧化钠氯化钡碳酸钡硝酸钡硫酸钡含水氯化钡氢氧化钡氧化钙氯化钙硫酸钙碳酸钙重碳酸钙氢氧化钙含水硫酸钙硫酸镁含水氯化镁含水硫酸镁三氯化铝硫酸铝铝矾(硫酸铝钾)常用化合物在不同温度下的溶解度化合物分子式0℃10℃20℃30℃40℃KCl27.631.034.037.040.0K2SO4 6.878.4710.0311.4913.1K2CO3105.3108.311.05113.7116.9 KNO313.320.931.645.863.9K2CO3·2H2O51.352.252.853.453.9K2SO4·Al2(SO4)33.0 5.911.7·24H2O24.928.131.2 KHCO318.321.7 6.08.311.2 KMnO4 2.75 4.0163.765.667.0K2CrO457.361.111.115.420.6K2Cr2O7 4.437.536.036.336.6 NaCl35.735.888.096.0104.0 NaNO373.080.021.538.859(32.5℃Na2CO3712.5(8℃)19.440.8)Na2SO4 5.09.08.769.9648.8 NaHCO3 6.457.5817.82911.27Na2CO3·10H2O 6.6311.21133.2Na3PO4·12H2O 1.57.220.831Na2HPO4·12H2O 1.8 3.716.128.835.6Na2SO4·10H2O 4.58.2109119NaOH4251.5(8℃)35.738.2129BaCl231.633.30.0022(1840.7 BaCO30.0016(8℃)11.6Ba(NO3)25℃)9.20.00028514.2 BaSO40.00011570.00024BaCl2·2H2O44.6 5.59Ba(OH)2 1.67 3.89 1.138.22CaO 1.31 2.48102.0CaCl259.574.50.209115.0 CaSO40.17665.00.2040.210 CaCO30.1930.001450.1682CaHCO30.16150.1660.1530.1705 Ca(OH)20.1850.16380.1650.210.141 CaSO4·2H2O0.180.17690.20440.9MgSO426.90.19236.245.6 MgCl2·6H2O52.831.554.529.057.5 MgSO4·7H2O26.231.3AlCl331.0323.631.3640.431.63Al2(SO4)331.336.29.245.7AlK(SO4)2·12H2O3.133.5 5.728.812.0含水硫酸铝氯化亚铁三氯化铁硫酸亚铁含水氯化亚铁含水三氯化铁含水硫酸亚铁硫酸铜含水硫酸铜氯化铵硝酸铵硫酸铵碳酸氢铵磷酸氢二铵硫酸铝铵(铝铵矾)化合物名称氯化钾硫酸钾碳酸钾硝酸钾含水碳酸钾钾矾碳酸氢钾高锰酸钾铬酸钾重铬酸钾氯化钠硝酸钠碳酸钠硫酸钠重碳酸钠含水碳酸钠Al2(SO4)3·18H2O23.8FeCl2FeCl374.4FeSO415.65FeCl2·4H2OFeCl3·6H2O42.7FeSO4·7H2O15.5CuSO414.3CuSO4·5H2O12.9NH4Cl29.4NH4NO3118.3(NH4)2SO410.6NH4HCO311.9(NH4)2HPO4171(NH3)2SO4·Al2 3.9(SO4)3·24H2O化合物分子式50℃KCl42.6K2SO414.2K2CO3121.3KNO385.5K2CO3·2H2O54.8K2SO4·Al2(SO4)3·24H2O34.2KHCO314.4KMnO469.0K2CrO425.9K2Cr2O737.0NaCl114.0NaNO3Na2CO346.7Na2SO412.67NaHCO332.2Na2CO3·10H2O4.426.665.631.425.162.46991.832.926.539.640.220.538.451.640.847.924.845.021.025.028.717.020.720.328.517.441.422.837.245.833.3192.0297.075.427.081.021.0260(31℃)20.015.19.5(8℃)60℃70℃80℃90℃100℃45.548.151.154.056.715.416.617.618.619.4126.8133.5139.8147.5155.7110.0138.0169.0202.0246.055.957.158.359.660.924.7571.0109.037.518.072.831.236.241.145.250.537.337.838.439.039.8124.0135.0148.0162.0180.045.445.344.143.742.942.514.0931.731.45581108含水磷酸三钠Na3PO4·12H2O44.1(4847.6(5951.0(95含水磷酸氢二钠含水硫酸钠氢氧化钠氯化钡碳酸钡硝酸钡硫酸钡含水氯化钡氢氧化钡Na2HPO4·12H2O.4℃)Na2SO4·10H2ONaOHBaCl243.6BaCO3Ba(NO3)217.1BaSO40.00033BaCl2·2H2O6Ba(OH)2℃)℃)313.017449.452.455.6347.046.458.82720.334.20.0004159.135.60320.940.750.6776.9氧化钙氯化钙CaO13.12CaCl20.960.86136.8141.70.197147.0152.7硫酸钙碳酸钙CaSO4127.0CaCO30.205159.00.17730.17950.18170.162重碳酸钙CaHCO30.17500.1060.0940.08580.0014氢氧化钙Ca(OH)20.17270.1160.1840含水硫酸钙硫酸镁含水氯化镁含水硫酸镁三氯化铝硫酸铝铝矾(硫酸铝钾)CaSO4·2H2O0.128MgSO4MgCl2·6H2O50.4MgSO4·7H2OAlCl333.5Al2(SO4)3AlK(SO4)2·12H2O52.255.061.035.531.7359.226.159.566.264.266.038.632.3273.151.542.268.986.80.07773.973.040.689.0含水硫酸铝Al2(SO4)3·18H2O氯化亚铁三氯化铁硫酸亚铁含水氯化亚铁含水三氯化铁含水硫酸亚铁硫酸铜含水硫酸铜氯化铵硝酸铵FeCl234.4FeCl373.1FeSO4315.1FeCl2·4H2O48.6FeCl3·6H2O42.2FeSO4·7H2O75.9CuSO432.3CuSO4·5H2O33.3NH4Cl25.1NH4NO350.437.178.357.043.935.540.028.155.250.945.835.947.131.460.2525.843.680.030.355.034.965.6580.095.337.347.927.164.238.571.347.1535.784.375.442.477.3硫酸铵碳酸氢铵磷酸氢二铵硫酸铝铵(铝铵矾)(NH4)2SO4NH4HCO3(NH4)2HPO4(NH3)2SO4·Al2(SO4)3·24H2O421.088.0871.0103.3注:1.Mg(OH)2在18℃时溶解度为9×10^-4。


氯化钠溶解度表1. 引言氯化钠(NaCl)是一种常见的无机化合物,广泛应用于食品加工、药品制造、化学实验等领域。
其溶解度是指在特定温度下,单位体积溶剂中能溶解的最大量氯化钠。
本文将就氯化钠在不同温度下的溶解度进行详细介绍。
2. 实验方法为了确定氯化钠在不同温度下的溶解度,我们采用了以下实验方法:1.准备一定质量的氯化钠固体样品。
2.在不同温度下准备一系列试管,并标明相应的温度。
3.将试管中加入一定量的水,并将其置于恒温槽中。
4.将氯化钠固体样品逐渐加入试管中,并轻轻搅拌,直到无法再溶解为止。
5.记录每个试管中的氯化钠质量和水的体积。
6.根据记录数据计算出每个温度下氯化钠的溶解度。
3. 实验结果根据实验方法所得到的数据,我们可以绘制出如下表格和图表:温度(℃)溶解度(g/100 mL水)0 35.710 38.620 39.230 40.140 42.050 43.9从上表和图中可以看出,随着温度的升高,氯化钠的溶解度也随之增加。
这是因为在较低温度下,水分子的运动速度较慢,不能有效地与氯化钠分子相互作用,导致溶解度较低。
而随着温度升高,水分子的运动速度增快,能够更好地与氯化钠分子相互作用,从而使溶解度增加。
4. 结论根据实验结果可以得出以下结论:1.氯化钠在水中的溶解度随着温度的升高而增加。
2.在常温下(约20℃),氯化钠在100 mL水中能够溶解约39.2 g。
3.溶解度曲线呈现正向斜率,即随着温度的升高溶解度增加的趋势。
5. 应用氯化钠溶解度的研究对于以下领域具有重要的应用价值:1.食品加工:在食品加工中,氯化钠常用于调味和防腐。
了解其溶解度可以指导食品制造商选择合适的温度和浓度来达到理想的口感和保质期。
2.药品制造:在药物配方中,氯化钠也是一种常用成分。
了解其溶解度可以帮助药物制造商优化药物配方,提高药物的效果和稳定性。
3.化学实验:氯化钠是许多化学实验中常用的试剂。
知道其溶解度可以帮助实验人员准确计量和配制所需溶液。

硅酸钠溶解度
硅酸钠是一种无机化合物,其化学式为Na2SiO3。
硅酸钠的溶解度是指在一定温度下,溶液中最多可以溶解多少硅酸钠。
硅酸钠的溶解度受到多个因素的影响,其中包括温度、pH值、离子强度等。
一般来说,温度越高,溶解度越大;pH值越高,溶解度也越大;离子强度越大,则对硅酸钠的溶解度有负面影响。
在常温下(25℃),硅酸钠的溶解度为约100g/L。
但随着温度升高,其溶解度也会增加。
例如,在50℃下,硅酸钠的溶解度可达到约
220g/L。
此外,在不同pH值的条件下,硅酸钠的溶解度也会有所不同。
当pH 值为8时,其最大可达到的溶解度为150g/L;而当pH值为10时,
则可达到200g/L左右。
总体来说,在常规实验条件下(25℃、中性pH值),硅酸钠的溶解
度约为100g/L左右。
但在实际应用中,需根据具体情况进行调整,以达到最佳效果。

碳酸钠随温度变化的溶解度碳酸钠是一种常见的无机化合物,其溶解度随温度的变化而发生变化。
溶解度是指单位质量溶剂在一定温度下能溶解的物质的质量,通常以克/升(g/L)为单位。
在研究碳酸钠的溶解性时,我们可以观察到它在不同温度下的溶解度的变化规律。
随着温度的升高,碳酸钠的溶解度通常会增加。
这是因为温度升高会增加溶剂分子的热运动能力,使其与溶质分子碰撞的概率增加,从而促进溶质分子从固体晶格中脱离并进入溶液中。
换句话说,温度的升高会增加溶质分子在溶剂中的扩散速率,从而提高溶解度。
然而,碳酸钠的溶解度与温度的关系并不是线性的。
在较低的温度下,随着温度的升高,溶解度的增加速率会加快。
但是一旦达到饱和溶解度,随着温度的进一步升高,溶解度的增加速率将逐渐减缓。
这是因为在饱和溶液中,溶质分子与溶剂分子之间的相互作用已经达到一种平衡状态,难以进一步增加溶解度。
碳酸钠的溶解度还受到其他因素的影响,例如溶剂的性质和溶液的浓度。
不同的溶剂对碳酸钠的溶解度有一定的影响,其中水是最常用的溶剂。
此外,溶液中碳酸钠的浓度也会影响其溶解度,通常来说,溶液中溶质浓度越高,溶解度也会相应增加。
在实际应用中,了解碳酸钠随温度变化的溶解度是非常重要的。
例如,在制备溶液时,需要控制溶剂的温度以达到所需的浓度。
此外,在一些工业生产过程中,也需要根据不同的温度条件来调整溶剂中碳酸钠的浓度。
碳酸钠的溶解度随温度的变化而发生变化。
在一定范围内,随着温度的升高,溶解度会增加,并受到溶剂性质和溶液浓度的影响。
了解碳酸钠的溶解度随温度变化的规律对于实际应用具有重要意义。
通过控制温度和其他条件,可以实现对碳酸钠溶解度的调控,满足不同需求。
六偏磷酸钠溶解度表一、六偏磷酸钠的溶解度特性六偏磷酸钠(化学式:Na4P6O18)是一种无色结晶体,常见的形态为无定形粉末或颗粒状。
其溶解度随温度的变化而变化,一般情况下随温度升高而增加。
以下为六偏磷酸钠在不同温度下的溶解度表:温度(摄氏度)溶解度(克/100克水)20 14.730 17.340 20.150 23.260 26.570 30.1从溶解度表中可以看出,在常温下,六偏磷酸钠的溶解度约为14.7克/100克水。
随着温度的升高,其溶解度逐渐增加,达到30.1克/100克水的最大溶解度。
二、六偏磷酸钠的实际应用1. 食品工业中的应用六偏磷酸钠作为食品添加剂,在食品工业中具有广泛的应用。
它可以作为增稠剂、螯合剂和乳化剂等,用于调理食品的质地、口感和稳定性,增加食品的保质期。
六偏磷酸钠在乳制品、肉制品、面包等食品中的应用得到了广泛认可。
2. 清洁剂和洗涤剂中的应用六偏磷酸钠也被广泛用于清洁剂和洗涤剂的制造过程中。
它可以作为螯合剂,与水中的金属离子结合,防止硬水对洗涤效果的影响,提高洗涤剂的清洁力和稳定性。
3. 水处理中的应用由于六偏磷酸钠对钙、镁等金属离子具有螯合作用,可以防止水垢的生成,因此在水处理领域也得到了广泛应用。
将六偏磷酸钠加入水中,可以降低水的硬度,减少管道和设备的结垢,延长使用寿命。
4. 金属防锈剂中的应用六偏磷酸钠还可以作为金属防锈剂的成分之一。
其螯合作用可以与金属表面的氧化物结合,形成保护膜,防止金属的进一步氧化和腐蚀。
5. 其他应用领域除了上述应用外,六偏磷酸钠还被用于制备陶瓷材料、磷酸盐肥料等。
其在化工、医药、冶金等领域也有一定的应用价值。
总结:六偏磷酸钠是一种重要的无机化合物,其溶解度特性对于许多领域的研究和应用具有重要意义。
通过溶解度表可以了解其在不同温度下的溶解度变化规律。
六偏磷酸钠在食品工业、清洁剂和洗涤剂、水处理、防锈剂等领域都有广泛的应用。
充分了解六偏磷酸钠的溶解度特性及其应用价值,有助于更好地应用和开发这一化合物的潜力。
25摄氏度下五水硫酸铜的溶解度摄氏度是温度的度量单位之一,25摄氏度下五水硫酸铜的溶解度是指在温度为25摄氏度时,单位质量的溶剂(通常为水)中最大可以溶解的五水硫酸铜质量。
五水硫酸铜,化学式为CuSO4·5H2O,是一种常见的无机化合物,颜色为蓝色,可溶于水。
五水硫酸铜的溶解度受多种因素影响,主要包括温度、溶剂的性质和溶剂中的其他物质等。
在25摄氏度下,五水硫酸铜的溶解度为大约32.7克/100毫升。
这意味着在25摄氏度下,每100毫升水中最多可溶解32.7克五水硫酸铜。
溶解度与温度之间通常存在一定的关系,一般来说,随着温度的升高,溶解度也会增加。
这是因为温度的增加可以提供更多的能量,有助于克服溶质分子之间的相互吸引力,使之离开晶体结构进入溶液中。
而在25摄氏度下,五水硫酸铜的溶解度达到了相对稳定的状态。
五水硫酸铜在水中的溶解过程可以用如下方程式表示:CuSO4·5H2O(s) ↔ Cu2+(aq) + SO4^2-(aq) + 5H2O(l)根据该方程式,五水硫酸铜在水中解离为Cu2+离子、SO4^2-离子和水分子。
溶解度实际上是指在溶液中存在的Cu2+离子的浓度。
在水溶液中,Cu2+离子与SO4^2-离子形成了化学平衡,其平衡常数称为离解度积(Ksp)。
离解度积越高,表示溶解度越大。
根据热力学分析,五水硫酸铜的离解度积(Ksp)为约 1.2×10^-38。
该值说明在25摄氏度下,五水硫酸铜的溶解度相对较低。
这主要是由于五水硫酸铜的晶体结构稳定,离解过程的反应性较低所导致的。
需要注意的是,五水硫酸铜的溶解度除了受温度的影响外,还受到溶剂性质的影响。
水是一种极性溶剂,对于极性溶质(如五水硫酸铜)有良好的溶解力。
而对于非极性溶剂,如石油醚等,五水硫酸铜的溶解度会较低。
此外,溶剂中的其他物质也可以影响五水硫酸铜的溶解度。
例如,如果在水中加入氯化钾等可离解出Cl^-离子的物质,会使Cu2+离子与Cl^-离子形成CuCl2(s)沉淀,导致五水硫酸铜的溶解度降低。