生化实验 设计试验PAGE
- 格式:ppt
- 大小:29.13 MB
- 文档页数:22

一、实验目的1. 掌握血糖测定的原理和方法。
2. 熟悉血糖测定仪器的操作流程。
3. 了解血糖在人体代谢中的重要性。
二、实验原理血糖测定是通过检测血液中的葡萄糖浓度来评估血糖水平。
常用的血糖测定方法有葡萄糖氧化酶法、己糖激酶法和葡萄糖氧化酶-氧电极法等。
本实验采用葡萄糖氧化酶法进行血糖测定。
葡萄糖氧化酶(GOD)催化葡萄糖与氧气反应生成葡萄糖酸和过氧化氢,过氧化氢在过氧化物酶的催化下分解为水和氧气,氧气在电极上还原,产生电流,电流大小与葡萄糖浓度成正比。
三、实验设备与试剂1. 实验设备:血糖测定仪、微量移液器、移液管、一次性采血针、酒精棉球、消毒液等。
2. 实验试剂:葡萄糖氧化酶试剂盒、葡萄糖标准品、蒸馏水等。
四、实验步骤1. 标准曲线绘制(1)准备标准溶液:将葡萄糖标准品用蒸馏水稀释成不同浓度的标准溶液。
(2)按照试剂盒说明书设置血糖测定仪,将标准溶液分别加入测定管中。
(3)开启血糖测定仪,依次测定各标准溶液的血糖浓度,记录数据。
(4)以葡萄糖浓度为横坐标,测定值为纵坐标,绘制标准曲线。
2. 血糖测定(1)用酒精棉球消毒采血部位,用一次性采血针对准静脉,待血液流出后,用消毒液消毒采血针。
(2)用微量移液器吸取适量血液,加入测定管中。
(3)按照试剂盒说明书设置血糖测定仪,将测定管放入测定仪中。
(4)开启血糖测定仪,待测定仪显示血糖浓度后,记录数据。
五、实验结果与分析1. 标准曲线绘制绘制标准曲线,得到线性方程:y = 0.0037x + 0.0035,R² = 0.9987。
2. 血糖测定本次实验测得血糖浓度为4.5 mmol/L。
六、实验讨论1. 本实验采用葡萄糖氧化酶法进行血糖测定,操作简便、快速,准确性较高。
2. 在实验过程中,要注意控制操作误差,如准确配制标准溶液、正确设置测定仪等。
3. 血糖测定对于糖尿病等疾病的诊断和治疗具有重要意义,本实验有助于加深对血糖测定原理和方法的理解。
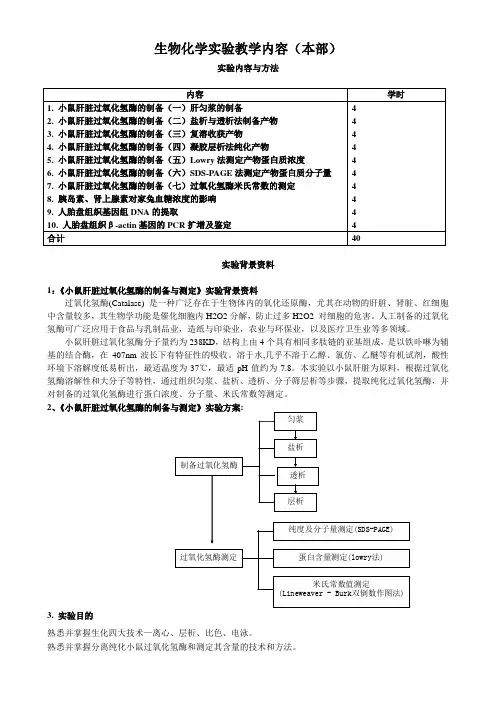
生物化学实验教学内容(本部)实验内容与方法实验背景资料1:《小鼠肝脏过氧化氢酶的制备与测定》实验背景资料过氧化氢酶(Catalase) 是一种广泛存在于生物体内的氧化还原酶,尤其在动物的肝脏、肾脏、红细胞中含量较多,其生物学功能是催化细胞内H2O2分解,防止过多H2O2 对细胞的危害。
人工制备的过氧化氢酶可广泛应用于食品与乳制品业,造纸与印染业,农业与环保业,以及医疗卫生业等多领域。
小鼠肝脏过氧化氢酶分子量约为238KD,结构上由4个具有相同多肽链的亚基组成,是以铁卟啉为辅基的结合酶,在407nm波长下有特征性的吸收。
溶于水,几乎不溶于乙醇、氯仿、乙醚等有机试剂,酸性环境下溶解度低易析出,最适温度为37℃,最适pH值约为7.8。
本实验以小鼠肝脏为原料,根据过氧化氢酶溶解性和大分子等特性,通过组织匀浆、盐析、透析、分子筛层析等步骤,提取纯化过氧化氢酶,并对制备的过氧化氢酶进行蛋白浓度、分子量、米氏常数等测定。
2、3. 实验目的熟悉并掌握生化四大技术—离心、层析、比色、电泳。
熟悉并掌握分离纯化小鼠过氧化氢酶和测定其含量的技术和方法。
4. 实验原理匀浆原理:分离纯化某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性,所以要根据所提取蛋白质的性质采用适当的方法将组织和细胞破碎。
过氧化氢酶在乙醇、氯仿等有机溶剂中溶解度很小,而脂质在有机溶剂中溶解度较大,通过加入有机溶剂可实现过氧化氢酶与脂质的分离。
过氧化氢酶在乙醇、氯仿等有机溶剂中稳定性好,不易变性,而某些杂蛋白在有机溶剂中稳定性差,容易变性。
根据上述原理选择0.05mol/L,pH4.0醋酸-乙醇缓冲液以及氯仿作为匀浆缓冲液,通过匀浆法破碎肝组织细胞,匀浆液离心后脂质分配到有机相中,部分杂蛋白则沉淀下来,而过氧化氢酶主要存在于上清液中,分离出上清液即获得过氧化氢酶的粗提液。
盐析原理:蛋白质在高浓度盐溶液中由于水化膜被破坏而溶解度降低。

《生化实验技术与应用》实验设计方案实验项目:水果基因组DNA 的提取与转基因成分分析 专业:生物技术 班级:101 日期:3月1日 一、实验目的:1、掌握提取植物组织基因组DNA 的基本方法。
2、掌握二苯胺法和紫外分光光度法测定DNA 含量的原理和方法。
3、学会转基因植物转基因成分的分析4、学习DNA 的水平式琼脂糖凝胶电泳并学会操作。
5、掌握高速冷冻离心机、微量移液枪、水平电泳仪等仪器设备的使用。
二、实验原理:核酸是生物有机物体重的重要组成成分,在生物体中核酸常与蛋白质结合在一起。
核酸分为DNA 和RNA 两大类,前者主要存在于细胞核内,后者主要存在于细胞质及核仁里。
在制备核酸时,通过研磨破坏细胞壁和细胞膜,使核蛋白被释放出来。
苯酚可使蛋白质变性,蛋白质溶于酚相,DNA 则溶于上层水相。
将氯仿与苯酚混合使用,可减少酚相中因水的存在而造成DNA 的少量溶解。
95%乙醇可使核酸从水相中沉淀出来,用70%的乙醇洗涤可以除一些盐分,经Rnase 降解RNA ,可得较纯的DNA 。
DNA 含量与纯度测定,目前常用紫外吸收法,利用核酸在260nm 有吸收峰,根据公式[DNA(μg /mL)=A260*50*稀释倍数]可计算出核酸DNA 的浓度。
由于蛋白质在280nm 有吸收峰,可根据比值判断DNA 纯度:A260/A280<1.8时,表明蛋白质含量偏高;1.8<A260/A280<1.9时,表明样品较纯;A260/A280>2.0时,表明RNA 或DNA 碎片较多。
二苯胺法定量测定DNA 的原理为:在强酸、加热条件下,可以使DNA 中的嘌呤碱基与脱氧核糖间的糖苷键断裂,产生嘌呤碱基、脱氧核糖与嘧啶核苷酸。
其中,2’-脱氧核糖在酸性环境中成为w-羟基-r-酮基戊醛,此物与二苯胺反应生成蓝色化合物,在595nm处有最大吸收。
DNA在40-400ug范围内光吸收值与DNA 含量成正比。
在转基因技术中,外源基因导入到植物体中时,通常使用花椰菜花叶病毒CaMV35S启动子启动下游编码基因的转录。

最新生物化学设计性实验报告实验目的:本实验旨在通过设计性实验,探究特定生物化学过程的机制和特点,验证理论假设,并培养学生的科研能力和实验技能。
实验背景:生物化学是研究生物体化学组成、化学变化及这些变化与生物体功能之间关系的科学。
设计性实验是生物化学教学和研究中的重要组成部分,它能够帮助学生更好地理解生物化学的基本概念,并通过实践活动加深对知识的掌握。
实验材料:1. 酶类样品2. 底物溶液3. 缓冲液4. 酶活性测定试剂盒5. 分光光度计6. 离心机7. 微量移液器8. 试管和比色皿9. 冰浴和恒温水浴实验方法:1. 预实验:首先对酶样品进行纯化,并通过酶活性测定初步了解其活性范围。
2. 实验设计:根据预实验结果,设计一系列实验,包括不同pH值、温度、底物浓度对酶活性的影响。
3. 实验操作:a. 准备一系列不同pH值的缓冲液,并调整酶样品和底物溶液至相应pH值。
b. 在不同温度下(如25℃、37℃、50℃)测定酶活性,记录数据。
c. 改变底物浓度,观察米氏常数(Km)和最大速率(Vmax)的变化。
4. 数据分析:利用图表和统计学方法分析实验数据,得出酶活性与实验条件之间的关系。
实验结果:1. pH值对酶活性的影响图显示,酶活性在特定pH值下达到最大,而在过高或过低的pH值下活性显著降低。
2. 温度对酶活性的影响图表明,酶活性随温度升高而增加,但在接近50℃时急剧下降,表明酶可能发生变性。
3. 底物浓度实验结果显示,当底物浓度增加到一定程度后,酶活性趋于平稳,计算得到的Km值与文献值相近。
讨论与结论:通过本实验,我们验证了酶活性受pH值、温度和底物浓度的影响。
实验结果与理论预期相符,表明设计性实验是理解和掌握生物化学原理的有效手段。
同时,实验过程中可能出现的误差和问题也为我们提供了宝贵的学习和改进机会。

一、实验目的1. 掌握从生物组织中提取DNA的基本原理和方法。
2. 学习使用酚-氯仿法进行DNA的粗提取和纯化。
3. 熟悉DNA的鉴定方法。
二、实验原理DNA是生物体内的重要遗传物质,具有独特的碱基序列。
在提取过程中,利用DNA与蛋白质、RNA等物质的溶解性差异,通过适当的化学试剂和操作步骤,将DNA从细胞中分离出来。
三、实验材料与仪器1. 材料:鸡血、无菌生理盐水、无水乙醇、氯化钠、酚-氯仿、NaCl溶液、DNA标准样品等。
2. 仪器:离心机、玻璃棒、量筒、烧杯、滴管、吸管、移液器、酒精灯、显微镜等。
四、实验步骤1. 鸡血采集:取鸡血2ml,加入10ml无菌生理盐水,充分混匀。
2. 细胞裂解:取2ml鸡血混合液,加入等体积的酚-氯仿,充分混匀后静置5分钟。
3. DNA沉淀:取上述混合液,加入2.5倍体积的无水乙醇,充分混匀后静置10分钟。
4. DNA纯化:将上述混合液转移到离心管中,离心5分钟(8000r/min),弃去上清液。
5. DNA溶解:将沉淀用50μl NaCl溶液溶解,混匀。
6. DNA鉴定:取少量溶解后的DNA溶液,加入2μl DNA标准样品,观察颜色变化。
五、实验结果1. 在实验过程中,观察到鸡血混合液与酚-氯仿混合后分层,上层为红色,下层为无色。
2. 在DNA沉淀过程中,观察到白色沉淀形成。
3. 在DNA溶解过程中,观察到溶液颜色由白色变为无色。
4. 在DNA鉴定过程中,观察到溶液颜色与DNA标准样品颜色相似。
六、实验结论1. 成功从鸡血中提取了DNA。
2. 酚-氯仿法是提取DNA的有效方法。
3. DNA在生物组织中的提取具有实际应用价值。
七、实验讨论1. 实验过程中,酚-氯仿的加入有助于细胞裂解和DNA的提取。
2. 无水乙醇的加入有助于DNA的沉淀。
3. NaCl溶液的加入有助于DNA的溶解。
4. 实验过程中,注意操作规范,避免污染。
5. DNA提取过程中,温度、pH值等条件对实验结果有影响。




生化实验技术实验设计实验设计题目:高效液相色谱-质谱联用技术测定大米中农药的残留课程:生物学实验技术概述专业:生物化学与分子生物学学号:2015116105姓名:杨洁舒高效液相色谱-质谱联用技术测定大米中农药的残留一、方案必要性与可行性分析我国是水稻种植大国,大米是我国人民的主食,占口粮消费的63%以上。
大米除被制成米饭直接食用外,还被加工成米粉、甜点及酒精饮料等。
我国大米人均年消费量在140kg以上。
水稻生产中为了保证水稻的高产,往往不可避免地需要使用各种农药。
据报道,在农药的使用过程中,真正起作用的仅占喷施量的0.1%,其余99.9%的农药都分散于环境中,中国每年受农药污染的农田面积达到6.67×106hm2。
因此,在大米的进出口中,世界各主要农业大国都对大米的农药残留制定了严格的限量标准。
研究大米中农药残留的检测方法,既是保障人类健康的需要,又是促进进出口贸易的需要。
为了保证水稻的产量,种植者施用大量的化学农药,不仅造成环境污染,而且直接影响大米的食用安全,威胁人们的健康。
鉴于上述原因,世界各国严格规定了包括大米在内的食品中农药最大残留限(MRLs)和每日最大摄入量。
目前大部分实验室监测食品中农药残留的方法是采用经典的气相色谱法,选择性检测器包括电子捕获检测器(ECD)、氮磷检测器(NPD)和火焰光度检测器(FPD),然而这些检测器限制了农药残留的检测范围。
其原因是萃取共存物的干扰存在假阳性和不准确性,用单一方法检测呈阳性后,还必须做确证试验。
此外,经典的预处理方法操作复杂,耗时且溶剂消耗量大,因此,有必要研究新的样品预处理及检测方法。
随着联用技术的日趋完善,高效液相色谱-质谱联用技术(HPLC-MS)逐渐成为最热门的分析手段之一。
特别是在分子水平上可以进行蛋白质、多肤、核酸的分子量确认,氨基酸和碱基对的序列测定及翻译后的修饰工作等,这在HPLC-MS联用之前都是难以实现的。
HPLC一MS 作为已经比较成熟的技术,目前国内外己在生化分析、天然产物分析、药物和保健食品分析以及环境污染物分析等许多领域得到了广泛的应用。

蛋白质与核酸的定性与定量一. 实验目的1. 学习和掌握纯化蛋白质的原理和方法、蛋白质等电点的测量原理和方法。
2. 掌握使用双缩脲法对蛋白质的定性测定。
3. 学会利用定糖法对核酸的定性与定量测定二. 实验原理1. 区分蛋白质和核酸:蛋白质在碱性溶液中可与Cu2+紫红色反应。
这是蛋白质分子中肽键的反应,肽键越多反应颜色越深。
核酸由单核苷酸所组成,无此反应。
另外,核酸组成成分嘌呤及嘧啶碱基具有强烈的紫外吸收,所以核酸也具有强烈的紫外吸收,最大吸收值在260mn ,利用这一性质亦可鉴别核酸样品和蛋白质样品。
2. 蛋白质的纯化方法:(1)粗分离:中性盐对蛋白质胶体的稳定性有显著的影响。
一定浓度的中性盐可破坏蛋白质胶体的稳定因素而使蛋白质盐析沉淀。
盐析沉淀的蛋白质一般保持着天然构象而不变性。
(2)蛋白质类别及分子量的确定:采用聚丙烯酰胺凝胶电泳技术测定样液中含有几种蛋白质,每种蛋白质的分子量大小。
由于SDS 是阴离子,使多肽表面覆盖的负电荷远远超过蛋白质分子原有的电荷量,消除了原来的电荷差异。
改变了蛋白质单体分子的构象,不同蛋白质的SDS 复合物的短轴长度都相同,长轴长度随其分子量的大小成正比变化(3)蛋白质的精制:根据上一步骤得到的蛋白质的分子量,采用葡聚糖凝胶层析的方法。
聚糖凝胶层析,是使待分离物质通过葡聚糖凝胶层析柱,各个组分由于分子量不相同,在凝胶柱上受到的阻滞作用不同,而在层析柱中以不同的速度移动。
分子量大于允许进入凝胶网孔范围的物质完全被凝胶排阻,不能进入凝胶颗粒内部,阻滞作用小,随着溶剂在凝胶颗粒之间流动,因此流程短,而先流出层析柱;分子量小的物质可完全进入凝胶颗粒的网孔内,阻滞作用大,流程延长,而最后从层析柱中流出。
若被分离物的分子量介于完全排阻和完全进入网孔物质的分子量之间,则在两者之间从柱中流出,由此就可以达到分离目的。
3. 蛋白质的含量测定以及等电点、比旋度等性质(1)蛋白质的含量测定:采用Folin- 酚试剂法。

紫外分光光度法测定花生奶蛋白质含量一、实验目的建立非蛋白质类含氮物质对测定结果无干扰的乳与乳制品中蛋白质的快速测定方法。
二、实验原理由于乳与乳制品的蛋白质中有游离的酪氨酸、色氨酸和苯丙氨酸存在的缘故,在280 nm 波长处有特征的最大吸收,其吸收强度与样中蛋白质含量呈正比。
利用这个特异性吸收,在280 nm 波长处,用1 cm比色杯测得吸光度值。
据此,计算出蛋白质的含量。
双缩脲是由两分子尿素缩合而成的化合物,在碱性溶液中与硫酸铜反应生成紫红色络合物,此反应即为双缩脲反应。
含有两个或两个以上肽键的化合物都具有双缩脲反应。
蛋白质含有多个肽键,在碱性溶液中能与Cu2+络合成紫红色化合物。
其颜色深浅与蛋白质的浓度成正比,可以用比色法进行测定。
双缩脲法最常用于需要快速但并不需要十分精确的测定。
三、仪器与试剂1、仪器①紫外分光光度计②石英比色皿③微波振荡器。
2、试剂①9 g/L 氯化钠溶液②蒸馏水③双缩脲试剂:溶解0.15g硫酸铜(CuSO4·5H2O)和0.6g酒石酸钾钠(NaKC4H4O6·4H2O)于50ml 蒸馏水中,在搅拌下加入30ml10%氢氧化钠溶液,用水稀释到100ml,贮存于内壁涂以石蜡的瓶内。
此试剂可长期保存。
④标准蛋白溶液(10μg/ml)准确称取牛血清蛋白用0.0001mol/L氢氧化钠溶液配制,冰相存放备用.四、操作步骤1、标准应用曲线的绘制:取6支干净的试管,按0→5编号,然后按下表依次加入试剂,充分混匀,在室温下放置半小时,以0管为空白,在280nm波长处测定消光值(OD),以各管蛋白质含量(毫克)横坐标,OD值为坐标,画出标线。
2、样品测定:吸取花生饮料1.00 ml 置于100 ml容量瓶中,加入9 g/L 氯化钠溶液至刻度,混匀。
再从中吸取10.00 ml样品溶液于100 ml容量瓶中,加入9 g/L 氯化钠溶液至刻度,微波振荡5 min,混匀。
用定性滤纸过滤,弃去初滤液30 ml,收集滤液备用。