除去粗盐中的可溶性杂质
- 格式:ppt
- 大小:97.00 KB
- 文档页数:7




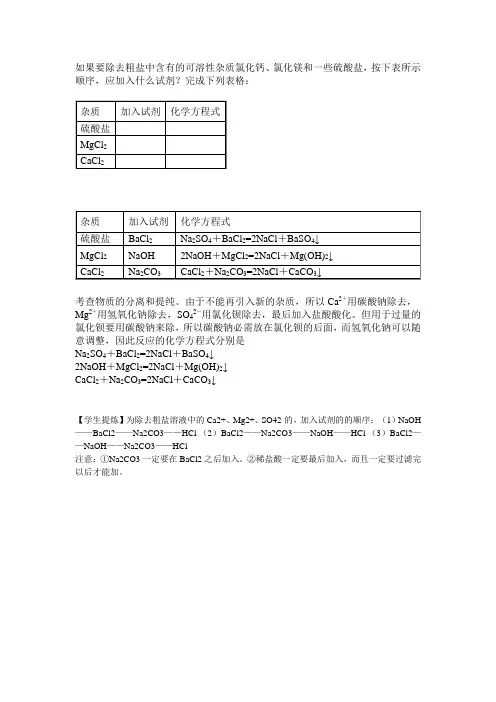
如果要除去粗盐中含有的可溶性杂质氯化钙、氯化镁和一些硫酸盐,按下表所示顺序,应加入什么试剂?完成下列表格:
考查物质的分离和提纯。
由于不能再引入新的杂质,所以Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。
但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此反应的化学方程式分别是
Na2SO4+BaCl2=2NaCl+BaSO4↓
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
CaCl2+Na2CO3=2NaCl+CaCO3↓
【学生提炼】为除去粗盐溶液中的Ca2+、Mg2+、SO42-的,加入试剂的的顺序:(1)NaOH ——BaCl2——Na2CO3——HCl (2)BaCl2——Na2CO3——NaOH——HCl (3)BaCl2——NaOH——Na2CO3——HCl
注意:①Na2CO3一定要在BaCl2之后加入。
②稀盐酸一定要最后加入,而且一定要过滤完以后才能加。

3、粗盐中CaCL 、MgC 2、N Q SO 杂质去除步骤1、 加入过量的NaOH 溶液。
【目的:除去 MgC 2。
】2、 加入过量的BaCl 2溶液。
【目的:除去NaSO 。
】3、 加入过量的NaCO 溶液。
【目的:除去 CaCb 与多余的 BaCb 。
】4、 过滤。
【目的:过滤出 Mg(OH 2、BaSOX CaCO BaCQ 】5、 加入过量稀盐酸。
【目的:除去多余的 NaOH 与多余的 NaCO 。
】6、蒸发结晶。
【要点】1、 加氢氧化钠与加氯化钡的顺序可以调换。
2、 加氯化钡与加碳酸钠的顺序不能颠倒。
3、 加盐酸前先过滤。
专项训练1、粗盐中含有MgCl2、CaCl 2等杂质,必须进行分离和提纯后才能用于工业生产和人们的 日常生活•粗盐提纯的部分流程如下图:请回答:(1) 步骤②加入过量的碳酸钠溶液的目的是反应的化学方程式为 _________________________________________ (2) 步骤④加入适量盐酸的目的是 __________________________ (3) 若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有2、通过海水提取的粗盐中含有 MgC 2、CaC b 、MgSO 以及泥沙等杂质。
以下是一种制备 精盐的实验方案(用于沉淀的试剂均过量)宦址 藩制T MG] 丫 屁OH,过谨4、请回答下列问题:加入违重 的盎顫________ 7(填化学式).下列说法不正确的是()A .氯化钠是由氯化钠分子构成的litSU样品 操作I过猱'5、 (1)步骤①中的BaCb 不能改成Ba(NO )2,其原因是什么(2) 进行步骤①后,如何判断 BaCl 2是否过量(3) 加入N Q CO 的目的是什么(4) 以上粗盐提纯的有关操作中需用到的主要仪器有哪些(5) 该实验方案还需完善,请写出具体的操作步骤。
_3、 粗盐中含有一定的杂质如 MgCl 2、CaCl 2和硫酸盐,现在想除掉这些杂质,请选择合适 的试剂除杂.(1) 除去Na 2SO 4,应加入 ,化学方程式(2) 除去MgCl 2,应加入 ,化学方程式(3)除去CaCl 2,应加入 ,化学方程式(4) 过滤,所得滤液中除了 NaCI 还含有 杂质,要除去这种杂质得到精致的NaCI 溶液应向滤液中加入至。

粗盐中可溶性杂质的去除专题练习1.下图是去除粗盐中难溶性杂质的实验操作,其中正确的是A.取粗盐B.溶解C.过滤D.蒸发【答案】B【解析】A、取用药品瓶塞倒放,以免沾染杂质污染试剂,故图示操作错误;B、溶解使用玻璃棒搅拌,故图示操作正确;C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故图示操作错误;D、正在加热的蒸发皿温度较高,为防止烫伤手,不能用手直接拿热的蒸发皿,应用坩埚钳夹取,故图示操作错误。
故选B。
2.为除去粗盐水中的MgCl2杂质,某同学设计的实验方案如下:在该粗盐水中加入过量的氢氧化钠溶液;充分反应后过滤,向滤液中加入适量盐酸。
(1)过滤操作中使用的玻璃仪器有烧杯、玻璃棒和______。
(2)写出加入NaOH溶液后所发生反应的化学方程式______。
(3)若将滤液在空气中敞口放置一段时间,则所得滤液中一定含有的溶质是______。
【答案】(1)漏斗(2)MgCl2+2NaOH=Mg(OH)2↓+2NaCl(3)NaCl、Na2CO3【解析】(1)过滤操作中使用的玻璃仪器有烧杯、玻璃棒和漏斗;(2)NaOH溶液与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入NaOH溶液后所发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;(3)因为在该粗盐水中加入过量的氢氧化钠溶液,所以滤液中含有NaOH,NaOH能与空气中的二氧化碳反应生成碳酸钠、水,故所得滤液中一定含有的溶质是Na2CO3及生成的NaCl。
3.除去NaCl溶液中CaCl2、MgSO4杂质,得到NaCl晶体的操作有①加过量Ba(OH)2溶液:②加过量Na2CO3溶液:③过滤:④加适量稀盐酸:⑤蒸发结晶。
(1)操作③中用到的玻璃仪器有烧杯、漏斗和_______。
(2)写出加入Na2CO3溶液发生反应的化学方程式________。
(写一个化学方程式即可)试卷第2页,共14页(3)加适量稀盐酸的目的是________。

粗盐提纯(除去粗盐中的可溶性杂质)一、教学目标2-,并进一步知道如何选择试剂。
1.知道用什么试剂可以分别除去溶液中的Ca2+、Mg2+、SO42.知道除去可溶性杂质时,所加试剂一般要过量,过量的试剂也要在后续实验中除去。
3.在加入两种或两种以上的试剂除杂时,知道如何考虑试剂加入的先后顺序。
4.通过“除去粗盐中可溶性杂质实验方案”的讨论,知道除去混合物中杂质的一般思路是:明确所要除去的物质—→确定反应原理—→分析干扰物质—→排除干扰物质—→加入除杂试剂。
当有多种杂质时,要综合分析确定杂质除去的顺序、试剂加入的顺序、试剂的用量、试剂过量后的处理等问题。
5. 体会自主学习、探究学习、合作学习的乐趣。
二、教学对象分析学生的能力分析通过之前化学的学习,大部分学生已经知道在物质的除杂过程中不能引入新的杂质。
2-的检验的学习,大部分学生已经基本学会了如何根据溶解性表选择试通过上一节课CO3剂检验离子。
学生的认知方式分析经过新课的学习,学生知道了一些自主学习、探究学习、合作学习的方法,但如何在学习过程中进行自主学习、探究学习、合作学习,仍是一个有待解决的问题。
三、教材分析1.教材内容的联系这部分知识,既涉及元素化合物知识,又涉及实验技能型知识,我认为主要还是元素化合物知识为主。
由于刚刚学习了粗盐中的难溶性杂质可以用过滤这种物理的方法除去,不过得到的盐还是不纯,还含有可溶性杂质,这些可溶性杂质又该如何除去呢?可以说,无论书上有没有这个问题,其实都是教师和学生此时不得不考虑和面对的问题。
而且它是在学生经过初中化学的学习,已经有了物质的检验和提纯的基础知识(尽管很少)和刚刚学习了CO32-的检验和除去粗盐中的泥沙这两个实验之后进行的学习,因此学生已经大致知道如何选择试剂来检验物质和除杂,也知道杂质转化为沉淀之后要过滤除去。
而通过对这个问题的讨论,为学生全面地考虑物质除杂时试剂的选择、试剂的加入顺序以及实验操作的选择都是一次很好的锻炼。


粗盐中可溶性杂质的去除
粗盐中不但有可溶性杂质,还有氯化镁、氯化钙、硫酸钠等可溶性杂质,在医疗上常要用到纯度较高的氯化钠,这需要除去粗盐中的可溶性杂质,需要加入相应的化学试剂,进行一系列实验操作。
根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、、。
(4)实验中加入“Na2CO3溶液”的目的是。
(5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):。
解析:(1)溶解过程中玻璃棒的作用是加速粗盐的溶解;过滤操作中玻璃棒的作用是引流。
(2)把沉淀和液体分离的方法是过滤。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯、蒸发皿。
(4)加入“Na2CO3溶液”的作用是沉淀出钡离子和钙离子。
(5)②③④三种试剂的加入可以除去相应的杂质离子,加过量氯化钡可除尽硫酸根离子,加过量氢氧化钠可除尽镁离子,加过量碳酸钠可除尽钙离子,过量的氢氧化钠与碳酸钠可加适量的盐酸除去,但过量的氯化钡无法用盐酸除去,可将碳酸钠的添加放在加氯化钡之后,这样既可除去钙离子,又能除去过量的氯化钡。
答案:(1)加速粗盐的溶解(2)过滤(3)酒精灯、蒸发皿(4)除去CaCl2和过量的BaCl2 (5)③②④或②④③
【方法提炼】
温馨提示:
①操作中加入过量药品的目的是将杂质除净。
②过量的碳酸钠溶液既可除去粗盐中的钙离子,也可除去过量的钡离子,因此,加入药品时,碳酸钠溶液须在氯化钡溶液之后添加。
③试剂加完后,过滤,滤液中加稀盐酸至溶液pH为7即可。
