第五章 多组分系统热力学及相平衡
- 格式:doc
- 大小:58.00 KB
- 文档页数:3



第五章相平衡一、选择题1、下列体系中哪一个是均相体系:( )(A)水雾和水蒸气混合在一起; (B)乳状液(C)水和被水饱和的空气 (D)两种不同的金属形成的固熔体2、克拉佩龙方程表明:( )(A)两相平衡时的平衡压力随温度而变化的变化率(B)任意状态下压力随温度的变化率(C)它适用于任何物质的两相平衡(D)以上说法都不对3、压力升高时,单组分体系的熔点将如何变化:()(A) 升高(B) 降低(C) 不变(D) 不一定4、对于下列平衡系统:①高温下水被分解;②同①,同时通入一些H2(g) 和O2(g);③H2 和O2同时溶于水中,其组元数K和自由度数f的值完全正确的是:()(A) ①K = 1,f= 1 ②K = 2,f= 2 ③K = 3,f = 3 ;(B) ①K = 2,f= 2 ②K = 3,f= 3 ③K = 1,f = 1(C) ①K = 3,f= 3 ②K = 1,f= 1 ③K = 2,f = 2(D) ①K = 1,f= 2 ②K = 2,f= 3 ③K = 3,f = 35、水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3 种(B) 2 种(C) 1 种(D) 不可能有硫酸水合物与之平衡共存6、298 K 时,蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度为:()(A) C= 2,φ= 2,f*= 1 (B) C= 2,φ = 2,f*= 2 (C) C= 2,φ= 1,f*= 2 (D) C= 2,φ = 1,f*= 37、如右图所示,当水处在三相点平衡时,若系统发生绝热膨胀,水的相态将如何变化? ( )(A)气相、固相消失,全部变成液态;(B)气相、液相消失,全部变成固态;(C)液相消失,固相、气相共存;(D)固相消失,液相、气相共存8、对简单低共熔体系,在最低共熔点,当温度继续下降时,体系存在( )(A)一相 (B)二相 (C)一相或二相 (D)三相9、已知纯A和纯B的饱和蒸气压p A*<p B*,且A和B所组成的体系具有最高恒沸点。

第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
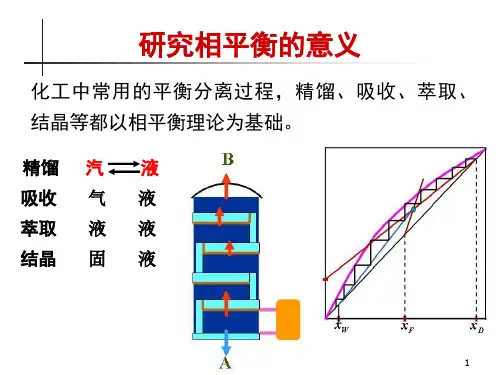
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。

物理化学肖衍繁答案【篇一:物理化学复习题】程名称:物理化学教材:《物理化学》,肖衍繁李文斌主编,天津大学出版社辅导教师:史春辉联系电话:4153173第一章气体一、填空题1、物质的量为5mol的理想气体混合物,其中组分b的物质的量为2mol,已知在30℃下该混合气体的体积为10dm3,则组分b的分压力pb=_________kpa,分体积vb=________dm3。
(填入具体数值) 3、在任何温度、压力条件下,压缩因子恒为1的气体为________________。
若某条件下的真实气体的z1,则说明该气体的vm___________同样条件下的理想气体的vm,也就是该真实气体比同条件下的理想气体___________压缩。
4、一物质处在临界状态时,其表现为____________________________。
5、已知a、b两种气体临界温度关系为tc(a)tc(b),则两种气体相对易液化的气体为_________。
6、已知耐压容器中某物质的温度为30℃,而且它的对比温度tr=9.12,则该容器中的物质为_________体,而该物质的临界温度tc=__________k。
二、选择题1、如左图所示,被隔板分隔成体积相等的两容器中,在温度t下,分别放有物质的量各为1mol的理想气体a和b,它们的压力皆为p。
若将隔板抽掉后,两气体则进行混合,平衡后气体b的分压力pb=_________。
a、2pb、4pc、p/2d、p2、在温度为t、体积恒定为v的容器中,内含a、b两组分的理想气体混合物,它们的分压力与分体积分别为pa、pb、va、vb。
若又往容器中再加入物质的量为nc的理想气体c,则组分a的分压力pa___________,组分b的分体积vb____________。
a、变大b、变小c、不变d、无法判断3、已知co2的临界参数tc=30.98℃,pc=7.375mpa。
有一钢瓶中贮存着29℃的co2,则该co2_________状态。




多组分系统热力学
多组分系统热力学是研究多个组分构成的系统的热力学行为的科学。
在多组分系统中,各个组分之间可能会相互作用,从而影响整个系统的热力学性质。
多组分系统热力学的研究内容包括:
1.热力学第一定律:能量守恒定律,即在一个封闭系统中,能量不
能被创造或消除,只能从一种形式转化为另一种形式。
2.热力学第二定律:熵增定律,即在一个封闭系统中,熵(即系统
的混乱程度)只能增加,不能减少。
这意味着,系统总是朝着熵增的方向演化,而不是熵减的方向。
3.相平衡:研究在给定的温度和压力下,不同物质之间是如何平衡
的。
4.化学平衡:研究在给定的温度和压力下,化学反应是如何平衡的。
5.热力学第三定律:绝对零度不能达到原理,即任何物质在绝对零
度下的熵均为零。
这些定律和原理对于理解多组分系统的热力学行为非常重要。
在化学工程、材料科学、生物工程等领域中,多组分系统热力学被广泛应用于研究复杂系统的热力学性质和行为。

第五章 多组分系统热力学与相平衡(一)主要公式及其适用条件1、拉乌尔定律 A *A A x p p =式中*A p 是与溶液在同一温度下纯A 液体的饱和蒸气压。
此式适用于理想液态混合物中的任一组分或理想稀溶液中的溶剂A 。
2、亨利定律 B B ,B x k p x =式中k x ,B 为溶液的组成用摩尔分数x 表示时溶质B 的亨利系数,其值与溶质、溶剂的性质及温度有关。
亨利定律也可以c B 、b B 等表示,但相应的亨利系数的大小和单位皆不相同。
此式只适用于理想稀溶液中的性质。
3、理想液态混合物中任一组分B 的化学势表示式 B B B ln x RT +=O μμ在理想液态混合物的温度下,p =p O =100kPa 的纯B(l)的状态定为B 的标准态,相应的化学势O B μ称为B 的标准化学势。
4、理想稀溶液化学势的表示式(1)溶剂A A A A ln x RT +=O μμ温度为T 、p =p O =100kPa 下,纯(A )的状态定为溶剂的标准状态。
(2)溶质B B ,B B ln x RT x +=O μμ)/ln(B ,B O O +=c c RT c μ=)/ln(B ,B O O +b b RT b μ同一种溶质B 在温度T 、p =p O =100kPa 下,用不同的组成表示化学势时,标准状态不同,O B μ不同,但B μ为定值。
5、稀溶液的依数性(1)蒸气压降低 B *A A *A *A A /)(/x p p p p p =-=∆式中x B 为溶质B 的摩尔分数。
此式适用于只有A 和B 两个组分形成的理想液态混合物或稀溶液中的溶剂。
(2)凝固点降低 ∆T f = K f b B式中O ∆=A m,fus A 2*f f /)(H M T R K ,称为溶剂A 的凝固点降低常数,它只与溶剂A 的性质有关。
此式适用于稀溶液且凝固时析出的为纯A(s),即无固溶体生成。
(3)沸点升高 ∆T b = K b b B式中O ∆=A m,vap A 2*/)(H M T R K b b ,称为沸点升高常数,它只与溶剂的性质有关。
第一章 理想气体1、理想气体:在任何温度、压力下都遵循P V=nRT 状态方程的气体。
2、分压力:混合气体中某一组分的压力。
在混合气体中,各种组分的气体分子分别占有相同的体积(即容器的总空间)和具有相同的温度。
混合气体的总压力是各种分子对器壁产生撞击的共同作用的结果。
每一种组分所产生的压力叫分压力,它可看作在该温度下各组分分子单独存在于容器中时所产生的压力B P 。
P y P B B =,其中∑=BBB B n n y 。
分压定律:∑=BB P P道尔顿定律:混合气体的总压力等于与混合气体温度、体积相同条件下各组分单独存在时所产生的压力的总和。
∑=BB V RT n P )/(3、压缩因子ZZ=)(/)(理实m m V V 4、范德华状态方程 RT b V V ap m m=-+))((2 nRT nb V Van p =-+))((225、临界状态(临界状态任何物质的表面张力都等于0)临界点C ——蒸气与液体两者合二为一,不可区分,气液界面消失; 临界参数:(1)临界温度c T ——气体能够液化的最高温度。
高于这个温度,无论如何加压 气体都不可能液化;(2)临界压力c p ——气体在临界温度下液化的最低压力; (3)临界体积c V ——临界温度和临界压力下的摩尔体积。
6、饱和蒸气压:一定条件下,能与液体平衡共存的它的蒸气的压力。
取决于状态,主要取决于温度,温度越高,饱和蒸气压越高。
7、沸点:蒸气压等于外压时的温度。
8、对应状态原理——处在相同对比状态的气体具有相似的物理性质。
对比参数:表示不同气体离开各自临界状态的倍数 (1)对比温度c r T T T /= (2)对比摩尔体积c r V V V /= (3)对比压力c r p p p /= 9、rr r c r r r c c c T Vp Z T V p RT V p Z =⋅=10、压缩因子图:先查出临界参数,再求出对比参数r T 和r p ,从图中找出对应的Z 。
第五章 多组分系统热力学与相平衡
主要公式及其适用条件
1. 拉乌尔定律与亨利定律(对非电解质溶液)
拉乌尔定律:
A *
A A x p p = 其中,*
A p 为纯溶剂A 之饱和蒸气压,A p 为稀溶液中溶剂A 的饱和蒸气分压,
x A 为稀溶液中A 的摩尔分数。
亨利定律: B B B B B B B c k b k x k p c,b,x,===
其中,B p 为稀溶液中挥发性溶质在气相中的平衡分压,B B B c,b ,x ,k k ,k 及为用不同单位表示浓度时,不同的亨利常数。
2. 理想液态混合物
定义:其任一组分在全部组成范围内都符合拉乌尔定律的液态混合物。
B
B B x p p *=
其中,0≤x B ≤1 , B 为任一组分。
3. 理想液态混合物中任一组分B 的化学势
)ln((l)(l)B *
B B x RT μμ+=
其中,(l)*
B μ为纯液体B 在温度T ﹑压力p 下的化学势。
若纯液体B 在温度T ﹑压力0
p 下标准化学势为(l)0B μ,则有:
m =+≈⎰*
00
B
B
B B (l)(l)(l)d (l)0
p
*,p μμV p μ 其中,m B (l)
*
,V 为纯液态B 在温度T 下的摩尔体积。
4. 理想液态混合物的混合性质
① 0Δm i x =V
;
② 0Δm i x
=H ; ③ B
=-∑∑mix B B
B B
Δ()ln()S n R
x
x ;
④ S T G
m i x m i x ΔΔ-=
5. 理想稀溶液
① 溶剂的化学势:
m =++⎰0A A
A A
(l )(l )l n ()(l )d
p
*
,
p μμR T
x V p 当p 与0
p 相差不大时,最后一项可忽略。
② 溶质B 的化学势:
)ln(
ln(
(g)ln(
(g))ln(
(g)(g)(0
B
B 0B
B B 0
B 0B
B B B b b RT )p b k RT μ)
p b k RT μp p RT μμμb,b,++=+=+==溶质)
我们定义:
⎰∞+=+p
p b,b,0
p
V μ)p b k RT μd ln(
(g)B 0
B
0B 0B
(溶质)(溶质)
同理,有:
⎰⎰∞∞+=++=+p
p x,x,p
p c,c 0
0p V μp
k RT μp
V μ)p c k RT μd (溶质)(溶质)
d (溶质)(溶质)B 0B 0
B 0B B 0
B
00
B ,0B
)ln(
(g)ln(
(g)
⎰⎰⎰∞∞
∞++=++=++=p p x ,
p
p c,p
p b,0
p
V x RT μ
p V c c RT μp V b b RT μμd ()ln()(d )()ln()(d )()ln(B B 0B B 0B 0
B
B 0
B 0
B B 溶质)溶质溶质溶质溶质(溶质)(溶质)
注:(1)当p 与0
p 相差不大时,最后一项积分均可忽略。
(2)溶质B 的标准态为0
p 下B 的浓度分别为...x ,c c ,b b 1B 0B 0B === ,
时,B 仍然遵循亨利定律时的假想状态。
此时,其化学势分别为)(0B ,溶质
b μ﹑)(0B ,溶质
c μ﹑)(0B ,溶质
x μ。
6. 分配定律
在一定温度与压力下,当溶质B 在两种共存的不互溶的液体α﹑β间达到平衡时,若B 在α﹑β两相分子形式相同,且形成理想稀溶液,则B 在两相中浓度之比为一常数,即分配系数。
ααββ==
B B B B ()
()
()
()
b c K ,K b c
7. 稀溶液的依数性
① 溶剂蒸气压下降:B *
A A Δx p p =
② 凝固点降低:(条件:溶质不与溶剂形成固态溶液,仅溶剂以纯固体析出)
A m,fus A
f f B
f f ΔH ΔM )R(T k b k T 2*==
③ 沸点升高:(条件:溶质不挥发)
A m,vap A
b b B b b ΔΔH M )R(T k b k T 2*==
④ 渗透压: Π=B V n R T 8. 吉布斯相律
2+-=P C F
9. 杠杆规则。