多相多组分系统热力学
- 格式:ppt
- 大小:4.55 MB
- 文档页数:2


第二章 多相多组分系统热力学习题及答案§2. 1 均相多组分系统热力学(P68)1. 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若V = A +B b 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系; (2)说明A 、B 、A/n 1的物理意义; (3)溶液浓度增大时V 1和V 2将如何变化解:(1) 由b 2的定义“1kg 溶剂中所含溶质的物质的量”,因此本题中可视溶剂水为1kg ,从而认为将 b 2=n 2。
★112222,,,,2T P n T P n V V V B Cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ 据偏摩尔量的集合公式V=n 1V 1+n 2V 2,★V 1 =2211()V n V n -=2211()V b V n - =22222211[A+Bb +C(b )-Bb -2C(b )]n =2211[A-C(b )]n = 2211A C (b )n n - (2)20lim b V A →=,故A 表示当b 2→0,纯溶剂的体积,即1kg 溶剂水的体积;220lim b V B →=,故B 表示当b 2→0,无限稀溶液中溶质的偏摩尔体积;2101lim b AV n →=,A/n 1表示溶剂水的摩尔体积。
(3)由以上V 1和V 2 的表达式可知,溶液浓度(b 2)增大时,V 2 增大,V 1减小。
2. 哪个偏微商既是化学势又是偏摩尔量哪些偏微商称为化学势但不是偏摩尔量答:化学势表达式: ,,c B B T P n G n μ⎛⎫∂= ⎪∂⎝⎭= ,,cB T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S V n U n ⎛⎫∂ ⎪∂⎝⎭偏摩尔量: ,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭,,,c B B T P n F F n ⎛⎫∂= ⎪∂⎝⎭,,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭,,,cBB T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 可见,只有偏微商,,c B T P n G n ⎛⎫∂ ⎪∂⎝⎭既是化学势又是偏摩尔量,,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭、,,c B S P n H n ⎛⎫∂ ⎪∂⎝⎭、,,cB S V n U n ⎛⎫∂ ⎪∂⎝⎭称为化学势,但不是偏摩尔量。



第二章多相多组分系统热力学2007-4-24§2.1 均相多组分系统热力学 练习1 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若 V = A +B b 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系;答: b2: 1kg 溶剂中含溶质的物质的量, b 2=n 2, 112222,,,,2T P n T P n V V V B cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ ∵ V=n 1V 1+n 2V 2( 偏摩尔量的集合公式)∴ V 1=(1/n 1)(V-n 2V 2)= (1/n 1)( V-b 2V 2)= (1/n 1)(A+Bb 2+c(b 2)2-Bb 2-2cb 2)= (1/n 1)[A-c(b 2)2] (2)说明A ,B , A/n 1 的物理意义;由V = A +B b 2+C (b 2)2 , V=A;A: b 2→0, 纯溶剂的体积,即1kg 溶剂的体积B; V 2=B+2cb 2, b 2→0, 无限稀释溶液中溶质的偏摩尔体积A/n 1:V 1= (1/n 1)[A-c(b 2)2],∵b 2→0,V = A +B b 2+C (b 2)2, 纯溶剂的体积为A, ∴A/n 1 为溶剂的摩尔体积。
(3)溶液浓度增大时V 1和V 2将如何变化?由V 1,V 2 的表达式可知, b 2 增大,V 2 也增加,V 1降低。
2哪个偏微商既是化学势又是偏摩尔量?哪些偏微商称为化学势但不是偏摩尔量? 答: 偏摩尔量定义为,,c B B T P n Z Z n ⎛⎫∂= ⎪∂⎝⎭所以,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭ ,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭ ,,cBB T P n F F n ⎛⎫∂= ⎪∂⎝⎭ ,,cB B T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 化学势定义为:,,c B B T P n G n μ⎛⎫∂=⎪∂⎝⎭= ,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,c B S V n U n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭ 可见,偏摩尔Gibbs 自由能既是偏摩尔量又是化学势。


1、在恒温抽空的玻璃罩中封入两杯液面相同的糖水(A) 和纯水(B)。
经历若干时间后,两杯液面的高度将是:( A)(A) A 杯高于B 杯(B) A 杯等于B 杯(C) A 杯低于B 杯(D) 视温度而定2、在温度T时,纯液体A 的饱和蒸气压为p A*,化学势为μA*,并且已知在p∃压力下的凝固点为T f*,当A 中溶入少量与A 不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μ A,T f ,则( D)(A) p A*< p A, μA*<μA,T f* < T f(B) p A*> p A, μA*<μA,T f* < T f(C) p A*< p A, μA*<μA,T f* > T f(D) p A*> p A, μA*>μA,T f* > T f3、已知373.15 K 时,液体A 的饱和蒸气压为133.32 kPa,另一液体B 可与A 构成理想液体混合物。
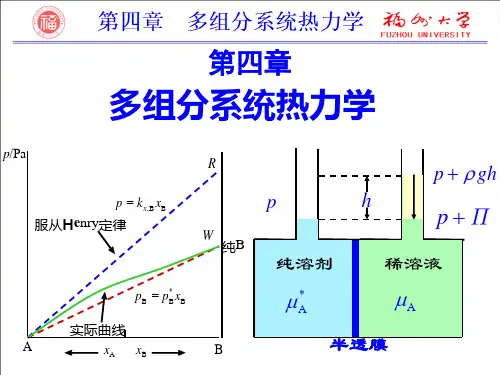
当 A 在溶液中的物质的量分数为1/2 时,A 在气相中的物质量分数为2/3 时,则在373.15 K时,液体B 的饱和蒸气压应为:( A)(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa4、关于亨利系数,下列说法中正确的是: ( D)(A)其值与温度、浓度和压力有关(B)其值与温度、溶质性质和浓度有关(C)其值与温度、溶剂性质和浓度有关(D)其值与温度、溶质和溶剂性质及浓度的标度有关5、关于亨利定律,下面的表述中不正确的是:(C)(A)若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律(B)温度越高、压力越低,亨利定律越正确(C)因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律(D)温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关6、298 K时,HCl(g,M r=36.5)溶解在甲苯中的亨利常数为245 kPa⋅kg⋅mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为:( A)(A) 138 kPa (B) 11.99 kPa (C) 4.9 kPa (D) 49 kPa7、下述诸说法正确的是:( D)(1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其Gibbs自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律(A) (1),(2) (B) (2),(3) (C) (2),(4) (D) (3),(4)8、设N2和O2皆为理想气体。

第三章 多组分系统热力学§ 引言基本概念 1、多组分系统两种或两种以上的物质(或称为组分)所形成的系统称为多组分系统。
多组分系统可以是均相的,也可以是多相的。
它(如:多组分单相系统)的热力学性质,则不仅由系统的温度、压力所决定,还与系统的相的组成有关。
2、混合物(mixture )多组分均匀系统中,各组分均可选用相同的方法处理,有相同的标准态,遵守相同的经验定律,这种系统称为混合物。
混合物有气相、液相和固相之分。
3、溶液(solution )含有一种以上组分的液体相或固体相称之为溶液。
溶液有液态溶液和固态溶液之分,但没有气态溶液。
4、溶剂(solvent )和溶质(solute )如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂,气态或固态物质称为溶质。
如果都具有相同状态,则把含量多的一种称为溶剂,含量少的称为溶质。
溶剂和溶质要用不同方法处理,他们的标准态、化学势的表示式不同,服从不同的经验定律。
溶质有电解质和非电解质之分,本章主要讨论非电介质所形成的溶液。
如果在溶液中含溶质很少,这种溶液称为稀溶液,常用符号“∞”表示。
多种气体混合在一起,因混合非常均匀,称为气态混合物,而不作为气态溶液处理。
多组分系统的组成表示法 1、B 的质量浓度B def(B)m Vρ 即用B 的质量m B 除以混合物的体积V 。
B ρ的单位是: kg ·m —3。
2、B 的质量分数BAAdef(B)m w m ∑ 即B 的质量m B 与混合物的质量之比。
w B 的单位为1。
3、B 的浓度B Bdefn c V即B 的物质的量与混合物体积V 的比值。
c B 常用单位是mol ·L —1。
4、B 的摩尔分数B BAAdefn x n ∑ B 的物质的量与混合物总的物质的量之比称为溶质B 的摩尔分数,又称为物质的量分数。
摩尔分数的单位为1。
气态混合物中摩尔分数常用y B 表示。


一、 选择题1、 下列偏微分中,能称为偏摩尔量的是:( A )(A ),,()B T P nc C B V n ≠⎛⎫∂ ⎪∂⎝⎭ (B) ,,()B S P nc C B H n ≠⎛⎫∂ ⎪∂⎝⎭ (C) ,,()B P V nc C B G n ≠⎛⎫∂ ⎪∂⎝⎭ (D) ,,()B T H ncC B S n ≠⎛⎫∂ ⎪∂⎝⎭ 2、某溶液由2mol A 和1.5mol B 混合而成,总体积为0.42 dm 3。
该溶液中已知A 的偏摩尔体积V A =0.03 dm 3•mol -1 ,则组分B 的偏摩尔体积V B 为 ( C )(A )0.20 dm 3•mol -1 (B) 0.30 dm 3•mol -1( C) 0.24 dm 3•mol -1 (D) 0.28 dm 3•mol -13、在一定温度和压力下,设纯的A(1)的化学势为μ*,其标准态化学势为μθ。
若在A 中加入另一液相B(1),形成理想的液态混合物,这时A(1)的化学势为μA ,标准态化学势为μA θ,则两种化学势之间的关系为 ( B )(A ) μ*=μA , μθ=μA θ (B) μ*>μA , μθ=μA θ( C) μ*=μA , μθ>μA θ (D) μ*>μA , μθ<μA θ4*、在298K 时,设液体A 和B 能形成理想的液态混合物,它们的蒸气形成理想的气体混合物。
已知纯A 和纯B 的饱和蒸气压分别为50A p kPa *=,60B p kPa *=,若液相中0.4A x =,则平衡的气相中B 的摩尔分数B y 的值为 ( A )(A ) y B =0.64 (B) y B =0.25( C) y B =0.50 (D) y B =0. 405、设373K ,100kPa 时,2()H O g 的化学势为1μ;373K ,50kPa 时,2()H O g 的化学势为2μ。
如果两者有如下4个关系式(1 ) μ1θ=μ2θ (2) μ2-μ1 =RTln2( 3) μ2-μ1 =-RTln2 (4) μ2=μ1- RTln0.5这些关系中正确的是 (B)(A) (1), (2) (B) (1), (3)(C ) (3), (4) (D) (2), (4)6、在298K 时,已知①2()H g 和②2()O g 在水中的Henry 系数分别为9,17.1210x k Pa =⨯,9,2 4.410x k Pa =⨯。