4-多组分系统热力学解析
- 格式:ppt
- 大小:1.39 MB
- 文档页数:51









第四章 多组分系统热力学 主要内容1.混合物和溶液(1)多组分系统的分类含一个以上组分的系统称为多组分系统。
多组分系统可以是均相(单相)的,也可以是非均相(多相)的。
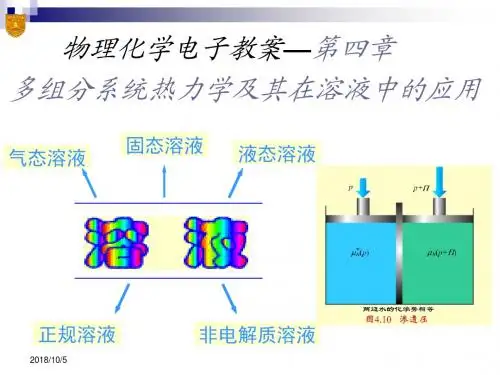
将多组分均相系统区分为混合物和溶液,并以不同的方法加以研究:(Ⅰ)混合物:各组分均选用同样的标准态和方法处理;(Ⅱ)溶液:组分要区分为溶剂及溶质,对溶剂及溶质则选用不同的标准态和方法加以研究。
(2)混合物及溶液的分类混合物有气态混合物液态混合物和固态混合物;溶液亦有气态溶液液态溶液和固态溶液。
按溶液中溶质的导电性能来区分,溶液又分为电解质溶液和非电解质溶液(分子溶液)。
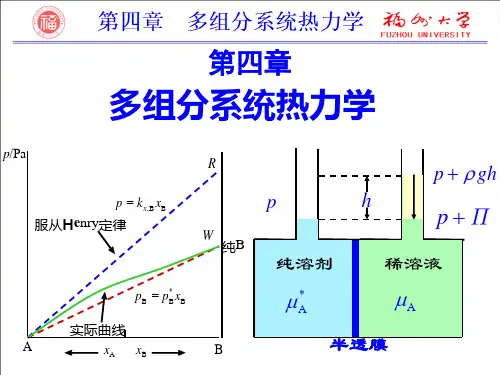
2.拉乌尔定律与亨利定律拉乌尔定律与亨利定律是稀溶液中两个重要的经验规律。
(1)拉乌尔定律平衡时,稀溶液中溶剂A 在气相中的蒸气分压A p 等于纯溶剂在同一温度下的饱和蒸气压与该溶液中溶剂的摩尔分数A x 的乘积。
这就是拉乌尔定律。
用数学式表达拉乌尔定律为 A *A Ax p p = (2)亨利定律一定温度下,微溶气体B 在溶剂A 中的溶解度B x 与该气体在气相中的分压B p 成正比。
也可表述为:一定温度下,稀溶液中挥发性溶质B 在平衡气相中的分压力B p 与该溶质B 在平衡液相中的摩尔分数B x 成正比。
这就是亨利定律。
用数学式表达亨利定律为: B B ,B x k p x =B ,x k 、B ,b k 为以不同组成标度表示的亨利系数,其单位分别为Pa ,Pa·kg·mol -1。
应用亨利定律时,要注意其不同表达式所对应的亨利系数及其单位。
还要注意亨利定律适用于稀溶液中的溶质分子同气相同种分子相平衡,即亨利定律适用于稀溶液中的溶质在液相及气相中具有相同分子形态的场合。
3.偏摩尔量(1)偏摩尔量的定义设X 代表V ,U ,H,S ,A ,G 这些广度性质,则对多组份系统(混合物或溶液)即 X =f (T ,p ,n A ,n B ,…)定义 ()B C C,,,B B def ≠⎪⎪⎭⎫ ⎝⎛∂∂n p T n X X式中,X B称为广度性质X (X=V ,U ,H ,S ,A ,G 等)的偏摩尔量,它们分别为只有系统的广延量才具有偏摩尔量,偏摩尔量是强度量。
第四章 多组分系统热力学三.思考题参考答案1.偏摩尔量与摩尔量有什么异同答:对于单组分系统,只有摩尔量,而没有偏摩尔量。
或者说,在单组分系统中,偏摩尔量就等于摩尔量。
只有对多组分系统,物质的量也成为系统的变量,当某物质的量发生改变时,也会引起系统的容量性质的改变,这时才引入了偏摩尔量的概念。
系统总的容量性质要用偏摩尔量的加和公式计算,而不能用纯的物质的摩尔量乘以物质的量来计算。
2.什么是化学势与偏摩尔量有什么区别答:化学势的广义定义是:保持某热力学函数的两个特征变量和除B 以外的其他组分不变时,该热力学函数对B 物质的量B n 求偏微分。
通常所说的化学势是指它的狭意定义,即偏摩尔Gibbs 自由能,即在等温、等压下,保持除B 以外的其它物质组成不变时,Gibbs 自由能随B 物质的量的改变的变化率称为化学势。
用公式表示为:C B B ,,(C B)T p n G n μ≠⎛⎫∂= ⎪∂⎝⎭ 偏摩尔量是指,在等温、等压条件下,保持除B 以外的其余组分不变,系统的广度性质X 随组分B 的物质的量B n 的变化率,称为物质B 的某种广度性质X 的偏摩尔量,用B X 表示。
也可以看作在一个等温、等压、保持组成不变的多组分系统中,当B 1 mol n =时,物质B 所具有的广度性质B X ,偏摩尔量的定义式为C defB B ,,(C B)T p n X X n ≠⎛⎫∂= ⎪∂⎝⎭ 化学势与偏摩尔量的定义不同,偏微分的下标也不同。
但有一个例外,即Gibbs 自由能的偏摩尔量和化学势是一回事,狭意的化学势就是偏摩尔Gibbs 自由能。
3.Roult 定律和Henry 定律的表示式和适用条件分别是什么答:Roult 定律的表示式为:*A A A p p x =。
式中*A p 为纯溶剂的蒸气压,A p 为溶液中溶剂的蒸气压,A x 为溶剂的摩尔分数。
该公式用来计算溶剂的蒸气压A p 。
适用条件为:定温、稀溶液、非挥发性溶质,后来推广到液态混合物。