强弱电解质的比较1
- 格式:ppt
- 大小:224.50 KB
- 文档页数:8

专题7 模块2 热点题型一强、弱电解质的判断与强酸、弱酸的比较一.强、弱电解质的判断方法(1)在相同浓度、相同温度下,与强电解质做导电性对比实验。
(2)浓度与pH的关系。
如0.1 mol·L-1 CH3COOH溶液,其pH>1,则可证明CH3COOH是弱电解质。
(3)测定对应盐的酸碱性。
如CH3COONa溶液呈碱性,则证明CH3COOH是弱酸。
(4)稀释前后的pH与稀释倍数的关系。
例如,将pH=2的酸溶液稀释至原体积的1 000倍,若pH小于5,则证明该酸为弱酸;若pH为5,则证明该酸为强酸。
(5)利用实验证明存在电离平衡。
如醋酸溶液中滴入紫色石蕊溶液变红,再加CH3COONa固体,颜色变浅,证明CH3COOH是弱电解质。
(6)在相同浓度、相同温度下,比较与金属反应的速率的快慢。
如将锌粒投入到等浓度的盐酸和醋酸溶液中,起始速率前者比后者快。
二.证明弱电解质的实验方法证明电解质为弱电解质的实验设计(以CH3COOH为例)可从以下方面进行思考:(1)从弱电解质的电离特点分析①称取一定量的无水醋酸配制0.1 mol·L-1的醋酸溶液,测定该溶液的pH>1。
②配制浓度相同的盐酸和醋酸,取相同体积的盐酸和醋酸分别加入烧杯中,接通电源,观察灯泡亮度,接盐酸的灯泡更亮。
③配制相同浓度的盐酸和醋酸,分别测定两溶液的pH,醋酸溶液的pH大。
(2)从影响弱电解质电离平衡的外界因素分析①用已知浓度的盐酸和醋酸溶液分别配制pH=1的两种溶液,取相同体积溶液并加入足量的锌,用排水法收集生成的氢气,醋酸产生氢气的量多。
②把一定浓度的醋酸溶液分成两等份,其中一份加入醋酸钠固体,然后分别加入形状相同质量相同的锌,未加醋酸钠固体的生成氢气的速率更快。
(3)从盐类水解的角度分析①配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液,然后加热,溶液红色变深。
②配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液,溶液变淡红色。


离子反应李仕才考点一电解质及其电离1.电解质和非电解质(1)电解质:在水溶液中或熔融状态下,能导电的化合物,如NaOH、H2SO4、NaCl。
(2)非电解质:在水溶液中和熔融状态下,都不导电的化合物,如蔗糖、酒精。
2.强电解质和弱电解质(1)(2)强电解质和弱电解质的比较3.电离(1)概念:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
(2)电离条件:共价化合物的电离条件是溶于水,离子化合物的电离条件是溶于水或熔融。
4.电离方程式的书写(1)强电解质:完全电离,用===表示。
如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为H2SO4===2H++SO2-4、NaOH===Na++OH-、(NH4)2SO4===2NH+4+SO2-4。
(2)弱电解质:部分电离,用表示。
①多元弱酸分步电离,且电离程度逐步减弱,酸性主要由第一步电离决定。
如H2S的电离方程式为H2++HS-,HS-++S2-。
②多元弱碱分步电离,但一步写出。
如Cu(OH)22++2OH-。
③两性氢氧化物双向电离。
如Al(OH)3的电离方程式:H++AlO-2+H233++3OH-。
(3)酸式盐①强酸酸式盐完全电离,一步到底。
如NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H ++SO 2-4,在熔融状态下的电离方程式为NaHSO 4===Na ++HSO -4。
②多元弱酸酸式盐,第一步完全电离,其余部分电离。
如NaHCO 3===Na ++HCO -3、HCO -3++CO 2-3。
判断正误(正确的打“√”,错误的打“×”)1.液氯不导电,氯水导电是因为氯气与水反应生成电解质电离而导电,故氯气是非电解质。
( × )2.NaCl 固体不导电,熔融的KCl 能导电,所以前者是非电解质,而后者是电解质。
( × )3.H 2SO 4是强电解质,故浓硫酸具有强的导电性。
( × )4.氨水导电,液氨不导电,所以氨水是电解质。

专题3 溶液中的离子反应第一单元弱电解质的电离平衡第1课时强电解质和弱电解质[目标要求] 1.了解电解质与非电解质,强电解质与弱电解质的概念。
2.认识强弱电解质与物质类别、物质结构的关系。
3.了解常见的强、弱电解质。
4.了解电解质在水溶液中的电离及溶液的导电性。
一、强弱电解质1.电解质和非电解质(1)根据化合物在水溶液中或熔融状态下是否产生自由移动的离子,可把化合物分为电解质和非电解质。
电解质:在水溶液中或熔融状态下能产生自由移动的离子的化合物。
非电解质:在水溶液中或熔融状态下不能产生自由移动的离子的化合物。
电解质和非电解质的范畴都是化合物,所以单质既不是电解质,也不是非电解质。
(2)Na、Cl2、NH3、SO2、NO2溶于水后,其溶液都能导电。
它们不是(填“是”或“不是”)电解质,在其水溶液中的电解质分别是(水除外)NaOH、HCl和HClO、NH3·H2O、H2SO3、HNO3。
(3)常见的电解质有酸、碱、盐、离子型氧化物。
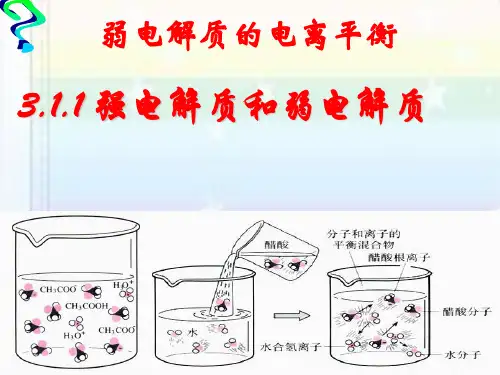
2.强电解质和弱电解质实验探究(Ⅰ):同浓度醋酸和盐酸的电离程度实验步骤:在两只锥形瓶中分别加入等体积的浓度均为1 mol·L-1的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察实验现象。
实验现象:如下表所示。
实验结论:同浓度盐酸的电离程度大于醋酸。
实验探究(Ⅱ):同浓度的NaOH溶液与氨水的电离程度实验步骤:取pH 为12的氢氧化钠和氨水各1 mL 于锥形瓶中,分别用酚酞作为指示剂,用HCl 作为标准溶液进行滴定。
实验现象:两溶液消耗HCl 标准溶液的体积:氨水溶液>氢氧化钠溶液。
实验结论:NaOH 和NH 3·H 2O 的电离程度不同,pH 相同的NaOH 的浓度小于NH 3·H 2O 的浓度,说明NaOH 完全电离,而NH 3·H 2O 只是部分电离。






强弱电解质的实验判定方法一、从弱电解质的概念出发,不能完全电离的是弱电解质溶质的物质的量浓度与溶液中 、 的关系来判断其电离程度如某一元酸的浓度为 ,若其 < (理论依据) 即 (实验方法),则可证明该酸是弱电解质。
电离程度小的是弱电解质。
相同温度下、在相同浓度,与另一电解质(如强电解质)进行比较, 小的是弱电解质实验方法为:导电能力弱的为弱电解质;(但导电能力强的不一定为强电解质)反应速率慢的是弱电解质;(但反应速率快的不一定为强电解质)如物质的量浓度相同的醋酸溶液与盐酸分别与同样的锌粒反应开始时产生气体的速率醋酸慢,说明醋酸是弱电解质;弱电解质溶液中还有溶质的分子存在。
同温度下, 值(或 )、体积均相同的弱电解质和强电解质,与足量物质反应时消耗量或者生成量多的是弱电解质。
但作为实验方法,一定 的弱电解质溶液在实验室是难以配制的。
如 值、体积均相同的盐酸和醋酸,分别与等浓度的 溶液恰好反应时,消耗碱溶液多的是醋酸;分别与足量的 粒反应时,产生气体多的是醋酸又如常温下,中和 的 溶液消耗 的 溶液的体积大于 常温下,将 的 溶液与 的 溶液等体积混合后溶液呈酸性二、存在电离平衡的是弱电解质,即改变条件时平衡会移动。
升高温度电离程度增大;加入盐离子会逆制电离;如向醋酸溶液中滴入石蕊试液变红,再加 ,颜色变浅。
加水稀释会促进电离,从稀释前后的 与稀释倍数的变化关系。
不太稀的强酸溶液每稀释 倍, 增大一个单位;不太稀的弱酸溶液每稀释 倍, 增大小于一个单位。
如测 的 稀释 倍后所得溶液 < ;又如将 值均为 的盐酸、醋酸稀释相同的倍数 如 倍 , 值变化小的是醋酸。
三、盐类的水解:测定对应盐的酸碱性。
如测 溶液的 值, 溶液呈碱性,则证明 是弱酸。
四、酸和盐发生复分解反应一般规律:左强右弱法 若 则 若 为弱酸 则 为更弱的弱酸。
在等浓度的两种一元弱酸钠盐溶液中分别通入适量 ,发生如下反应:则两弱酸酸性强弱比较正确的是. 较强 . 较强 .两者差别不大 .无法比较分 已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有 、 、 三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:① + - 少量 -+ -② (少量)+ - -+③ (少量)+ - -+回答下列问题:相同条件下, 、 、 三种酸中酸性最强的是 。
高中化学常考易错知识点——电解质与非电解质1.电解质和非电解质的比较注意单质和混合物既不是电解质也不是非电解质2.强电解质和弱电解质的比较3.电离电解质在水溶液中或熔融状态下离解成自由移动离子的过程。
易错点1误认为能导电的物质一定是电解质。
正确解析能导电的物质不一定是电解质,如Fe能导电,但它既不属于电解质,已不属于非电解质。
易错点2误认为电解质一定能导电。
正确解析电解质不一定导电,如固态NaCl、液态HCl等。
易错点3误认为不导电的物质一定是非电解质。
正确解析非电解质不导电,但不导电的物质不一定是非电解质,如金刚石、单质硫等一些非金属单质。
易错点4误认为溶于水能导电的物质一定是电解质。
正确解析电解质必须是化合物本身电离出的离子导电,否则不属于电解质。
如CO2、NH3等物质的水溶液虽能导电,但它们并不是电解质,因为它们是与水反应后生成了电解质,才使溶液导电的。
易错点5误认为强电解质溶液的导电性比弱电解质溶液的导电性强。
正确解析电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。
电解质溶液导电能力的大小,决定于溶液中自由移动的离子的浓度和离子的电荷数,和电解质的强弱没有必然联系,如 1 mol·L-1的醋酸溶液的导电能力就大于0.000 01 mol·L -1的盐酸,所以说盐酸的导电能力一定大于醋酸是错误的。
易错点6误认为BaSO4投入水中,导电性较弱,故它是弱电解质。
正确解析电解质的强弱与其溶解性无关。
某些盐如BaSO4等虽难溶于水,但溶于水的部分却是完全电离的,所以它们是强电解质;相反,能溶于水的未必都是强电解质,如CH3COOH、NH3·H2O等虽然能溶于水,但溶解时只有部分电离,故这些是弱电解质。
易错点7误认为强电解质都是离子化合物,弱电解质都是共价化合物。
正确解析HCl属于强电解质,但它属于共价化合物。
4.依据元素周期表,突破强、弱电解质的记忆ⅠA族:除LiOH外其余都是强碱。