2015年高中化学《化学与技术》专题一 第一单元 水的净化与污水处理教案 苏教版选修2
- 格式:doc
- 大小:30.50 KB
- 文档页数:2
水的净化与污水处理【学习目标】1.能说出纯水和天然水的区别。
2.了解沉淀、过滤、吸附等常用的净化水的方法。
3.理解过滤的原理,并初步学会过滤的原理和操作。
【学习重难点】1.了解沉淀、过滤、吸附等常用的净化水的方法。
2.理解过滤的原理,并初步学会过滤的原理和操作。
【学习过程】一、水的净化方法1.自然界的水含有杂质和细菌等物质,为混合物,不宜直接饮用。
2.针对水质的不同,常用的水的净化方法有:沉淀、过滤、吸附、消毒、蒸馏等。
(1)沉淀和吸附:常用明矾、活性炭等对水中的杂质进行沉降或吸附。
(2)过滤:除去水中的不溶性杂质的方法。
(3)蒸馏:除去水中可溶性杂质的方法,净化程度相对较高,得到蒸馏水可以看做是纯净物。
(4)杀菌:水中含有细菌、病毒,可放入适量的药物进行杀菌消毒。
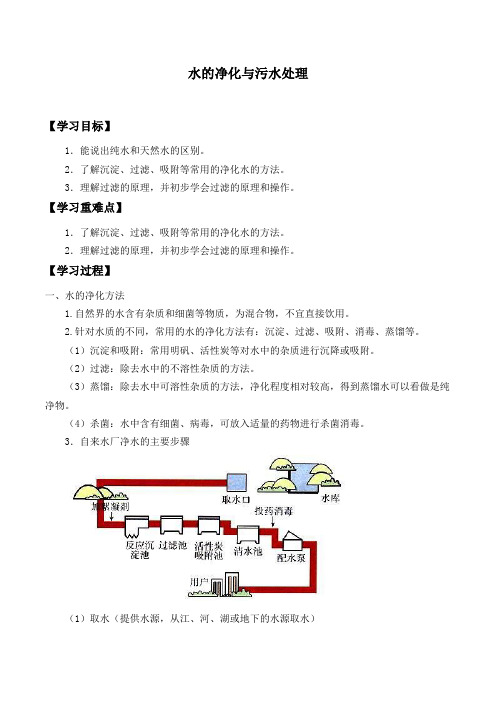
3.自来水厂净水的主要步骤(1)取水(提供水源,从江、河、湖或地下的水源取水)(2)加絮凝剂(用明矾除去水体中的不溶于水的固体杂质)(3)反应沉淀池(除去水体中一些可溶于水的物质,这些物质对人体有严重的危害)(4)过滤池(除去以上各步的沉淀物与原有水体中的漂浮物)(5)活性炭吸附池(除去水体中一些可溶于水的有气味的有颜色的杂质)(6)清水池(经过吸附后,还有少量杂质要除去)(7)投药消毒(水体中存在一些有毒、有害的病毒、病菌等,通过化学消毒剂才能除去)(8)配水泵(经过以上步骤后,所得的水基本上是比较干净的水,可供用户使用)注:(1)“投药消毒”步骤中所用的消毒剂主要有氯气、臭氧、二氧化氯等,发生化学变化,其余的各步大都是物理变化。
(2)经过多步净化后最后所得水仍含有少量可溶性杂质,仍属于混合物。
4.过滤是一种从液体中分离出不溶性固体的方法,利用它可将不溶于水的固体杂质与水分离开。
(1)过滤操作中要做到“一贴、二低、三靠”:一贴:原因是。
二低:A.漏斗内滤纸边缘低于漏斗口边缘B.原因是。
三靠:A. B. C.(2)通过过滤滤液仍然浑浊可能的原因:①滤纸破损;②滤液边缘高于滤纸边缘;③仪器不干净等。

《水的净化》现场课教案(全国优质课获奖案例)《水的净化》教学设计【指导思想】突出科学课程的新理念,注重培养学生主动研究、乐于探究、敢于创新的意识和精神,从而提升学生的核心素养。
充分挖掘课程资源,联系学生生活实际,把课堂由课内向课外延伸,把学生由课本知识引向生活实际。
围绕水的净化,创设系列“水”的问题情境,组织学生进行实验探究活动,联系学生的生活经验,激发学生研究兴趣,激励学生走向成功,感受成功的喜悦。
在活动中培养学生的探究能力和健康的生活观念,感受化学对改善个人生活和促进社会发展的积极作用,增强学生对自然和社会的责任感。
【课程标准、教材分析】水是继学生研究了空气、氧气等气体性质后,研究的另一种身边的化学物质,本课题以水为载体,探讨了常用的净化水的方法与技能等。
教材处理方法是将课标要求的沉降、过滤、吸附和蒸馏等净化水的方法有序的联系,其中过滤是初中化学中重要的实验操作技能,也是本课题中重点研究的内容。
教材中也介绍了自来水的生产过程,让学生体会到水源净化的必要性及树立节约用水的意识(课标要求)。
【学生分析】已有经历及存在的问题:2、对于水质和水净化是有一定的了解,晓得一些生活中净化水的方法。
3.学生经过前面的研究,曾经掌握了一些简单的尝试操作技能。
但对化学探究研究方法的了解还处于发蒙阶段。
4、学生在生活中打仗到过滤,但不清楚过滤能撤除水中的难溶性固体以及过滤的具体操作及注意事项。
在本课研究中可能会遇到的问题:在过滤操作中,学生容易违规操作,导致实验失败。
解决方法:教学过程中注重对学生可能出现的问题及时的启发引导。
-1-【教学目标】1.经由过程合理的选择清水方法(沉淀、过滤、吸拥护蒸馏等),理解水的分歧需要,让学生养成资源开发意识,科学耗能观念,水循环的守恒观等,激发学生爱护水资源。
2.了解自来水的生产过程,让学生体会到水源净化的必要性及树立节约用水的意识3.初步学会过滤的操作方法,培养学生自动研究、乐于探究、敢于创新的意识和精神,从而提升学生的核心素养。

苏教版化学选修2《水的净化与污水处理》word教案11.用明矾净化后的自来水是()A.含悬浮杂质少的水B.硬水C.软水D.纯水解析:选A。
明矾净水是利用Al3+水解生成Al(OH)3胶体吸附一些悬浮的杂质。
2.自来水厂常用Cl2给自来水消毒。
若用自来水配制下列溶液,可不能...产生明显药品变质的是()A.石蕊试液B.硝酸银溶液C.硫化钠溶液D.氯化铝溶液解析:选D。
经Cl2消毒的自来水中含有Cl2、Cl-、H+、ClO-、HClO等粒子,能与石蕊试液作用(可使其被漂白),与AgNO3溶液作用(生成AgCl白色沉淀),与Na2S溶液反应(将S2-氧化为S)。
3.下列所述情形可能引起水污染的是()①都市生活污水的任意排放②农业生产中农药、化肥使用不当③海上油轮石油泄漏④工业生产中废液、废渣、废气的排放A.①③B.①④C.②④D.①②③④解析:选D。
上述过程均能造成水体污染。
4.下列试剂:①过氧化氢;②臭氧;③液氯;④漂白粉;⑤过氧化钠;⑥二氧化氯,其中可用于自来水的杀菌消毒的是()A.①②⑤B.③④⑥C.①②③④⑥D.①②③④⑤⑥解析:选C。
由上述物质的用途可知,Na2O2是一种供氧剂,尽管遇水生成强氧化性的物质,但生成的NaOH溶于水是一种有害物质。
5.(2011年无锡高二检测)勤洗手和经常对环境进行消毒是预防传染病的有效途径。
某消毒液为无色液体,用红色石蕊试纸检验,发觉试纸先变蓝后褪色。
则该消毒液的要紧成分可能是()A.KMnO4B.H2O2C.NaClO D.NH3·H2O解析:选C。
无色液体第一排除A(KMnO4显紫色)。
红色石蕊试纸先变蓝后褪色,说明该消毒剂显碱性且具有漂白性,NH3·H2O不具有漂白能力,而H2O2显弱酸性,故只能选C。
6.最近科学研究说明,用氯气杀灭自来水中的病菌并非优良方法,氯胺(NH2Cl)在中性或酸性条件下是一种更好的强消毒剂。
氯胺的消毒原理之一是()A.NH2Cl+HCl===NH3↑+Cl2↑B.NH2Cl+H2O NH3+HClOC.NH2Cl===NH+2+Cl-D.NH2Cl+HClO NH2ClO+HCl解析:选B。

第一单元水的净化与污水处理第1课时生活用水的净化【教学目标】1.了解天然水中所含的主要杂质成分,知道生活用水的要求与处理方法。
2.了解自来水生产的一般工艺流程,能用盐类水解反应解释水处理工艺中某些常见混凝剂净水的基本原理。
3.联系实际,了解水质污染状况、检测方法、净化处理情况,形成保护水资源的意识,感受化学科学在水资源保护、水处理方面的重要作用。
【教学重点】污水处理中主要的化学方法及其原理【教学设计】【引入】播放一段水资源的现状视频。
从这段视频中我们可以获得什么?【学生】1.水资源分布不均匀;2.用水形势严峻;3.水污染严重;4.人类自身的认识程度不够;5.其它……【教师】水是我们生活的必需,从现状看形势比较紧张,这有待于我们全民参与保护水的行动中来,非一朝一日所能解决,希望同学们能从自己身边的小事做起。
那么什么样的水才可以饮用?如何将天然水变成我们的引用水?这一节课我们就来学习一下。
【学生】查阅自己已经获得的资料,展示了饮用水的标准:1.为防止介水传染病的发生和传播,要求生活饮用水不含病原微生物。
2.水中所含化学物质及放射性物质不得对人体健康产生危害,要求水中的化学物质及放射性物质不引起急性和慢性中毒及潜在的远期危害(致癌、致畸、致突变作用)。
3.水的感官性状是人们对饮用水的直观感觉,是评价水质的重要依据。
生活饮用水必须确保感官良好,为人民所乐于饮用。
生活饮用水水质标准共35项。
其中感官性状和一般化学指标15项,主要为了保证饮用水的感官性状良好;毒理学指标15项、放射指标2项,是为了保证水质对人不产生毒性和潜在危害;细菌学指标3项是为了保证饮用水在流行病学上安全而制定的。
【教师】这是国家规定的生活饮用水的标准,有些地方我们还不能了解。
但是对于第3条水质标准这一项中部分知识就和我们相关了。
它常见的检测项目包括:水温、PH、导电率、固体悬浮物、溶解氧(DO)、化学需氧量(COD)、生化需氧量(BOD)等。


4、《水的净化》教学设计一等奖1、导入新课自然界的水能直接饮用吗?如果不能,经过怎样的处理才能得到我们饮用的自来水学生回答:”可直接饮用的有泉水,井水。
而河水,海水却不能直接饮用“创设情景、引入新课2、推进新课提问:浑浊的河水在静置一些时间后有什么变化?回答:底部有沉淀,上面的水相对清,但仍有一些悬浮物存在。
3、实验演示净化桌上的一杯泥水(由于加了红墨水而显红色),加入明矾分析:明矾溶于水生成的胶状物可以吸附水中的悬浮物,从而使其沉降到底部,称为絮凝剂。
提问:如何将这些沉淀和水分开?举出生活中将固体和液体分开的实例。
提问:这些实例有什么共同特点?分析:实验室用过滤装置(展示事物)把不溶于水的物质与水分开现象:悬浮物沉到底部,水变得更清思考:井水也可用明矾净化回答:用沙漏将饺子和汤分开,用滤布将豆浆和豆腐渣分离等回答:都是液体能通过,固体不能通过,把固体和液体分开。
加深认识絮凝剂的作用4、学生实验分析过滤操作的要点:一贴;二低;三靠。
指出学生操作过程中的不足或错误提问:比较过滤前的过滤前和过滤后有什么变化?山泉水为何总是很清?过滤后的水仍为红色,为什么?如何将色去掉?展示:借助活性炭净水器示意图,简介活性炭。
利用活性炭的吸附性,可能吸附水中的一些溶解性的杂质、如除去色素和异味设问:自来水厂是如何将江水河水净化为我们能饮用的自来水的呢?展示:自来水厂的净水过程提问:经过以上处理后的水,清辙透明,是不是纯净水了?为什么?分析:通过沉淀,过滤的方法只除去不溶性杂质,水中还有许多可溶性的杂质。
生活中我们可能有这样的经验,经常用来烧水的水壶和装水的开水瓶结有一层水垢,这是因为水中溶有可溶性的钙和镁化合物,加热或放久了,这些化合物就会生成沉淀——水垢,像这样含有较多可溶性的钙和镁化合物的水叫硬水、不含或含较少可溶性的钙和镁化合物的水叫软水。
提问:如何区分硬水和软水?提问:硬水有哪些危害?分析:其实硬水的危害还不止这些,比如长期饮用硬水不利于健康,它可引起消化道功能紊乱。
1.用明矾净化后的自来水是()A.含悬浮杂质少的水B.硬水C.软水D.纯水解析:选A。
明矾净水是利用Al3+水解生成Al(OH)3胶体吸附一些悬浮的杂质。
2.自来水厂常用Cl2给自来水消毒。
若用自来水配制下列溶液,不会产生明显药品变质的是()A.石蕊试液B.硝酸银溶液C.硫化钠溶液D.氯化铝溶液解析:选D。
经Cl2消毒的自来水中含有Cl2、Cl-、H+、ClO-、HClO等粒子,能与石蕊试液作用(可使其被漂白),与AgNO3溶液作用(生成AgCl白色沉淀),与Na2S溶液反应(将S2-氧化为S)。
3.下列所述情况可能引起水污染的是()①城市生活污水的任意排放②农业生产中农药、化肥使用不当③海上油轮石油泄漏④工业生产中废液、废渣、废气的排放A.①③B.①④C.②④D.①②③④解析:选D。
上述过程均能造成水体污染。
4.下列试剂:①过氧化氢;②臭氧;③液氯;④漂白粉;⑤过氧化钠;⑥二氧化氯,其中可用于自来水的杀菌消毒的是()A.①②⑤B.③④⑥C.①②③④⑥D.①②③④⑤⑥解析:选C。
由上述物质的用途可知,Na2O2是一种供氧剂,虽然遇水生成强氧化性的物质,但生成的NaOH溶于水是一种有害物质。
5.(2011年无锡高二检测)勤洗手和经常对环境进行消毒是预防传染病的有效途径。
某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。
则该消毒液的主要成分可能是() A.KMnO4B.H2O2C.NaClO D.NH3·H2O解析:选C。
无色液体首先排除A(KMnO4显紫色)。
红色石蕊试纸先变蓝后褪色,说明该消毒剂显碱性且具有漂白性,NH3·H2O不具有漂白能力,而H2O2显弱酸性,故只能选C。
6.最近科学研究表明,用氯气杀灭自来水中的病菌并非优良方法,氯胺(NH2Cl)在中性或酸性条件下是一种更好的强消毒剂。
氯胺的消毒原理之一是()A.NH2Cl+HCl===NH3↑+Cl2↑B.NH2Cl+H2O NH3+HClOC.NH2Cl===NH+2+Cl-D.NH2Cl+HClO NH2ClO+HCl解析:选B。
《化学与技术》教案(全册)专题一多样化的水处理技术〔课程标准要求〕1、知道化学在水处理中的应用2、了解海水的综合利用,认识化学科学发展对自然资源利用的作用〔教学内容增减建议〕增加污水处理中电化学处理、从海水中提取镁,掌握明矾净水的原理、水的消毒原理,富营养化的化学原理,大量内容阅读了解[课时安排]第一单元2课时,第二单元3课时,复习1课时,习题1课时,共7课时第一单元水的净化与污水处理(第一课时)〔知识回顾〕1.写出FeCl3 AlCl3的水解方程式,思考如何得到氢氧化铝和氢氧化铁胶体。
2.写出制备漂白粉的化学方程式,思考漂白粉消毒的原理是什么?知识学习:1.阅读表1-1找出你认为有毒、应当除去的微粒。
你能利用所学的知识对这些有害物质进行处理吗?2.明矾净水主要处理的水中哪些微粒?原理是什么?3.澄清的水是干净的水吗?九寨沟的水折射出漂亮的蓝色?是良好的饮用水吗?你认为需要怎样的处理?氯水的消毒原理是什么?4.结合图1-3完成课后P8的习题3,体会自来水厂净化天然水的设计意图,写出相关的方程式。
5.自来水能直接饮用吗?理由是什么?习题巩固:1.在净水过程中用到混凝剂,其中可以作为混凝剂使用的是A、偏铝酸钠B、氧化铝C、氯化铝D、明矾2.下列广告用语在科学上没有错误的是A.这种饮料中不含任何化学物质B.这种蒸馏水绝对纯净,其中不含任何离子C.这种口服液含丰富的氮、磷、锌等微量元素D.没有水就没有生命3.下列过程中,不涉及化学变化的是A.甘油加水作护肤剂B.用明矾净水C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味D.烧菜用过的铁锅,经放置常出现红棕色斑迹4.长时间烧沸的天然水不宜喝的主要原因是A.水中的氧气少了B.水中的亚硝酸盐浓度大了C.水中的钙镁离子多了D.水中的二氧化碳多了5.目前,科学家致力于研制高效、安全、无毒的饮用水消毒剂。
(1)近年来,某些自来水厂在用液氯进行处理的同时还加入少量液氨,其反应的化学方程为:NH3+HClO===H2O+NH2Cl(一氯氨)。
第一单元水的净化与污水处理-苏教版选修化学与技术教案一、教学目标1.知识目标•掌握水的净化原理及净化工艺;•熟悉污水处理的原理和处理工艺;•了解水的污染及其危害。
2.能力目标•能够分析和设计水的净化方案;•能够分析和设计污水处理方案;•能够评估水的污染状况。
3.情感目标•培养学生对水资源保护的意识;•培养学生的团队协作意识;•培养学生的环保责任感。
二、教学内容1.水的净化(1)水的来源和用途1.水的来源:自来水、地下水、河水、湖水、雨水等;2.水的用途:饮用、农业灌溉、工业生产、城市供水等。
(2)水的净化原理1.物理净化:筛选、沉淀、过滤等;2.化学净化:加药处理(如氯化、硫酸铝等);3.生物净化:微生物处理,如活性污泥法、生物膜法等。
(3)水的净化工艺1.水处理过程:预处理、混凝沉淀、过滤、消毒等;2.污水回用:工业用水、农业灌溉等。
2.污水处理(1)污水的组成及其危害1.污水组成:有机物、无机物、微生物等;2.污水危害:影响水体水质、导致水污染等。
(2)污水处理原理1.物理处理:格栅除污、沉淀除污等;2.化学处理:加药处理、高级氧化等;3.生物处理:活性污泥法、人工湿地处理等;(3)污水处理工艺1.生化池处理工艺:活性污泥法、人工湿地法等;2.物化混合池处理工艺:加药混合-沉淀-过滤等;3.处理后的污水回用:如工业用水、农业灌溉等。
三、教学方法1.问题导入法通过提问的方式引发学生对水净化和污水处理的兴趣,激发学生主动学习的积极性。
2.案例分析法通过实际案例分析,引导学生掌握水净化和污水处理方案设计的基本原则和方法。
3.小组讨论法引导学生分组讨论,团队合作,思考和探究水资源保护的方法和措施,培养学生时刻关注环保问题的意识和责任感。
四、教学评估1.知识考核通过测试等方法考核学生对水的净化和污水处理相关知识的掌握情况,判断学生成果的达成程度。
2.能力考核通过教师布置设计任务,对学生针对某个实际应用场景进行方案设计和方案评估,评估学生分析、设计和评估能力的成长情况。
第一单元水的净化与污水处理(第一课时)
〔知识回顾〕
2.写出FeCl3 AlCl3的水解方程式,思考如何得到氢氧化铝和氢氧化铁胶体。
3.写出制备漂白粉的化学方程式,思考漂白粉消毒的原理是什么?
知识学习:
2.阅读表1-1找出你认为有毒、应当除去的微粒。
你能利用所学的知识对这些有害物质
进行处理吗?
3.明矾净水主要处理的水中哪些微粒?原理是什么?
4.澄清的水是干净的水吗?九寨沟的水折射出漂亮的蓝色?是良好的饮用水吗?
你认为需要怎样的处理?氯水的消毒原理是什么?
5.结合图1-3完成课后P8的习题3,体会自来水厂净化天然水的设计意图,写出相关的方程
式。
6.自来水能直接饮用吗?理由是什么?
习题巩固:
2.在净水过程中用到混凝剂,其中可以作为混凝剂使用的是
A、偏铝酸钠
B、氧化铝
C、氯化铝
D、明矾
3.下列广告用语在科学上没有错误的是
A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任
何离子
C.这种口服液含丰富的氮、磷、锌等微量元素
D.没有水就没有生命
4.下列过程中,不涉及化学变化的是
A.甘油加水作护肤剂
B.用明矾净水
C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
D.烧菜用过的铁锅,经放置常出现红棕色斑迹
5.长时间烧沸的天然水不宜喝的主要原因是
A.水中的氧气少了
B.水中的亚硝酸盐浓度大了
C.水中的钙镁离子多了
D.水中的二氧化碳多了
6.目前,科学家致力于研制高效、安全、无毒的饮用水消毒剂。
(1)近年来,某些自来水厂在用液氯进行处理的同时还加入少量液氨,其反应的化学方
程为:NH3+HClO===H2O+NH2Cl(一氯氨)。
NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因是:_____________________________。
(2)科研人员发现在氯消毒的饮用水中,含有微量对人体有潜在危害作用的含氯化合物。
世界环保联盟即将全面禁止在自来水中加氯气,推广采用光谱性高效杀菌消毒剂二氧化氯(ClO2,黄绿色气体)。
目前欧洲和我国主要采用Kesting法(原料为氯酸钠和盐酸)制ClO2,该法的缺点是同时产生Cl2(占ClO2体积的一半),使产物纯度低。
①试写出该法制ClO2的化学反应方程式:_____________________________。
②Cl2和ClO2都是通过氧化作用而杀菌消毒,试计算在等质量时,ClO2的氧化能力是Cl2
的多少倍。
二、污水处理:
1.阅读本节调查研究思考水体富营养化是如何产生的?你认为该污染主要由表中哪些因
素导致?
2.DO和BOD的含义是什么?BOD5的含义是什么?为什么BOD5高,河水就会出现恶臭?
3.你了解的处理污水的方法有哪些?该方法主要用于处理怎样的污水?
习题巩固:
3.国际上提出了“预防污染”这一新概念,绿色化学是“预防污染”的基本手段,下列各
项中属于绿色化学的是
A、处理废弃物
B、治理污染点
C、减少有毒物
D、杜绝污染源
4.新华社报道:我国太湖因蓝藻疯狂繁殖而造成水质的严重污染。
(1)蓝藻的疯狂生长说明湖水中哪些元素超标
(2)蓝藻的疯长会如何破坏生态平衡?
(3)已知洗衣粉的成分为(Na5P3O10),三聚磷酸钠,已知三聚磷酸是三个H3PO4分子脱2分子水形成的,写出H3PO4、三聚磷酸的结构式。
(4)青岛市政府规定从今年禁止磷洗衣粉使用,而把其中的Na5P3O10用Na2SiO3代替,写出其软化硬水时离子方程式。
23.工厂为了除含Cr2O72-离子的酸性废水,采用以下处理方法:以铁作为电极进行电解鼓
入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准,其原理是:
①将Cr2O72-离子还原为可溶性三价铬离子。
②电解除铬过程中,使溶液的PH不断升高,使工业废水由酸性变为碱性,再把三价铬离
子变成不溶性氢氧化物除去。
根据上述内容回答下列问题:
(1)用铁作电极电解时,电极反应式为:阳极,阴极。
(2)在水溶液中将Cr2O72-离子还原成Cr3+的还原剂是溶液中的离子,此氧化还原反应的离子方程式是。
(3)在处理废水中使溶液的PH不断升高,由酸性转变碱性是通过和途径来实现的。
(4)将Cr3+转变成不溶性氢氧化物的离子反应式为,同时还有生成
24.在自然净化中要把有机污染物自发地转变为简单的无机物质,需要水中含有一定的氧
气,使有机物(C,H,O)+O2→CO2+H2O。
1 L水中含有的有机物质转变为无机物所需要的氧的量称为生化需氧量(BOD),用g·L-1为单位表示。
如果水中的氧气比BOD少,水就发臭,鱼和其他淡水生物就不能生存。
若某地区一条河水中含有机物10 ppm(即质量分数为百万分之十),此有机物分子式用C6H10O5表示,而在正常大气条件下,氧气在水中的溶解量是0.0092 g·L-1。
(1)写出有机物在有氧条件下转化为无机物的化学方程式。
(2)这条河水的BOD是多少?河水中的鱼类能否维持生命?
河道旁有甲乙两工厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含三种离子是、、。
(2)乙厂的废水中含有另外三种离子,如果加一定量(活性炭、FeSO4、铁粉)
可以回收其中的金属。
(3)另一种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的转化为沉淀,经过滤后的废水主要含,可用来__ _____。