专题三常见的烃脂肪烃
- 格式:doc
- 大小:82.99 KB
- 文档页数:7



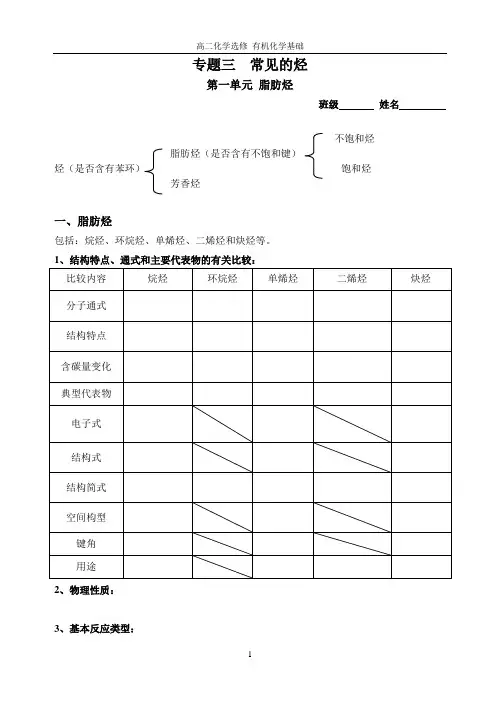
专题三常见的烃第一单元脂肪烃班级姓名不饱和烃脂肪烃(是否含有不饱和键)烃(是否含有苯环)饱和烃芳香烃一、脂肪烃包括:烷烃、环烷烃、单烯烃、二烯烃和炔烃等。
2、物理性质:3、基本反应类型:(1) 取代反应:有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应(2) 加成反应:构成有机物不饱和键(碳碳双键、叁键或者碳氧双键等)的两个原子和其他的原子或者原子团直接结合而生成新物质的反应(3) 聚合反应:由相对分子量小的化合物分子互相结合成相对分子量大的高分子的反应加聚反应:具有不饱和键的有机物通过加成聚合得到高分子化合物的反应4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:(2)氧化反应:(3)分解反应:(裂解裂化)5、烯烃的化学性质(与乙烯相似)(1)加成反应:【注意】烯烃的不对称加成及马氏规则(当不对称烯烃与卤化氢发生加成反应时,通常H 加到含H多的不饱和碳原子一侧),以丙烯与溴化氢的加成为例:(2)氧化反应:(3) 加聚反应:6、二烯烃的化学性质:(1)二烯烃的加成反应:(以1,3—丁二烯与溴的加成为例)(2) 加聚反应:7、炔烃的化学性质(1)加成反应:(2)加聚反应:(3)氧化反应【补充】加聚反应有关内容1、单体、聚合度、链节单体:形成高分子化合物的小分子物质链节:重复出现的简单的结构单元聚合度:链节重复的次数2、写出丙烯的加聚反应3、写出2—甲基—1,3—丁二烯通过1,4—加成合成橡胶的反应4、判断高聚物单体的方法(加聚反应):(1)天然橡胶(聚异戊二烯)(2)聚苯乙烯(3)聚四氟乙烯(4)聚甲基丙烯酸甲酯(5)(6)(7)丁苯橡胶(8)(9)。

互动课堂疏导引导一、烃的基本知识 1。
烃的分类烃分为脂肪烃和芳香烃,其中脂肪烃的分子中一定不含有苯环,芳香烃的分子中一定含有苯环。
根据脂肪烃的结构,人们把脂肪烃分为饱和烃和不饱和烃。
饱和烃:碳原子之间的共价键全部为碳碳单键,其中的碳原子皆为饱和碳原子.如:烷烃.不饱和烃:分子中含有双键和叁键等不饱和键的脂肪烃,其中的碳原子有不饱和碳原子。
如:烯烃、炔烃. 2。
常见的脂肪烃⎪⎩⎪⎨⎧⎩⎨⎧炔烃烯烃简称不饱和烃不饱和脂肪烃乙烷甲烷烷烃简称饱和烃饱和脂肪烃脂肪烃)(),(:)( 二、脂肪烃的性质 1。
烷烃的性质 (1)物理性质随着碳原子数的增多,烷烃同系物的物理性质呈现周期性变化,即熔沸点逐渐升高,密度逐渐增大。
注:①所有烷烃均难溶于水,密度均小于1。
②常温下烷烃的状态:C 1—C 4 气态 C 5—C 16 液态 C 17—固态 (2)化学性质①与卤素单质的反应 CH 3CH 3+Cl 2CH 3CH 2Cl+HCl可逐步取代,所得有机产物有:C 2H 5Cl 、C 2H 4Cl 2、C 2H 3Cl 3、C 2H 2Cl 4,C 2HCl 5、C 2Cl 6,其中氯乙烷为其一氯代物,以上物质均称为氯代物。
取代反应:像烷烃的卤代反应那样,有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
②与氧气的反应CH 4+2O 2−−→−点燃CO 2+2H 2OC n H 2n +2+213+n O 2−−→−点燃nCO 2+(n+1)H 2O知识总结不同的烃,碳元素所占的质量分数有所不同。
分子中碳原子数相同而碳元素的质量分数越低的烃,完全燃烧时放出的热量越多。
在所有烃中,烷烃(特别是甲烷)的碳元素的质量分数比相应的其他烃都低。
因此人们倾向于选用烷烃,尤其是相对分子质量小的烃作燃料。
2.烯烃、炔烃的性质 (1)物理性质①烯烃:随着分子里碳原子数的增加:a 状态:g→l→s;b 沸点:逐渐升高;c 密度:逐渐变大(但小于1 g·cm -3). 常温常压下,n≤4的烯烃为气态。


烃类知识点归纳总结高中一、脂肪烃1.1 饱和脂肪烃饱和脂肪烃的分子式为CnH2n+2,是碳原子间是单键相连的烃类化合物。
常见的饱和脂肪烃包括甲烷、乙烷、丙烷等。
这些烃具有较高的稳定性和化学惰性。
1.2 不饱和脂肪烃不饱和脂肪烃的分子式为CnH2n,是碳原子间存在双键或三键结构的烃类化合物。
常见的不饱和脂肪烃包括乙烯、丙烯等。
这些烃具有较高的反应性和化学活性。
1.3 烃的物理性质烃的物理性质包括密度、沸点、熔点等。
不同种类的烃具有不同的物理性质,这些性质对于烃的生产和应用具有重要的意义。
1.4 烃的化学性质烃的化学性质包括燃烧、氧化、加成反应等。
这些化学性质决定了烃在化工生产中的应用。
二、芳香烃2.1 芳香烃的结构芳香烃的结构特点是由芳香环组成,其中的碳原子间存在特殊的共轭结构。
常见的芳香烃包括苯、甲苯、苯乙烯等。
2.2 芳香烃的物理性质芳香烃的物理性质包括密度、沸点、熔点等。
与脂肪烃不同,芳香烃具有特殊的物理性质,这些性质对于芳香烃的生产和应用具有重要的意义。
2.3 芳香烃的化学性质芳香烃的化学性质包括亲电取代反应、亲核取代反应、加成反应等。
芳香烃的化学性质与脂肪烃有所不同,但同样决定了芳香烃在化工生产中的应用。
三、烃在生产中的应用3.1 烃的燃料应用烃是重要的燃料,可以用于生产汽油、柴油、天然气等。
这些燃料在交通运输、工业生产等领域具有广泛的应用。
3.2 烃的化工原料应用烃是化工生产中重要的原料,可以用于生产乙烯、丙烯、丙烷等化工产品。
这些化工产品在日常生活、医药、农药等方面都有重要的应用。
3.3 烃的医药应用烃可以用于生产各种医药原料,如麻醉剂、抗生素、激素等。
这些医药原料在医疗保健领域具有重要的应用价值。
3.4 烃的农药应用烃可以用于生产各种农药原料,如杀虫剂、杀菌剂等。
这些农药原料在农业生产中起到了重要的作用。
综上所述,烃是一类重要的有机化合物,在生产和应用中具有广泛的应用价值。
对于高中生物和化学学习者而言,掌握烃的相关知识点,有助于理解有机化合物的特性和应用,提高化学素养,促进科学素养的发展。



常见的烃本专题的主要内容包括:脂肪烃的性质、脂肪烃的来源与石油化学工业、苯的结构与性质、芳香烃的来源与应用等;涉及的实验探究包括:烯烃、炔烃与溴水的作用、苯与溴的作用、苯与浓硫酸和浓硝酸的作用等。
第一节脂肪烃一、烃的分类①分子中不含苯环②分子中含有苯环③含有不饱和键④不含不饱和键二、脂肪烃的性质1.烷、烯、炔烃的物理性质物理性质 变化规律状态当碳原子数小于或等于4时,烷、烯、炔烃在常温下呈气态,其他的烷、烯、炔烃常温下呈固态或液态(新戊烷常温下为气态)溶解性 都不溶于水,易溶于有机溶剂沸点 随碳原子数的增加,沸点逐渐升高。
分子数相同的烃,支链越多,沸点越低密度随碳原子数的增加,相对密度逐渐增大。
烷、烯、炔烃的相对密度小于水的密度2.烷烃的化学性质(以甲烷为例)3.烯烃的化学性质(以乙烯为例) (1)氧化反应①能使酸性KMnO 4溶液褪色。
②可燃性 化学方程式:C 2H 4+3O 2−−→−点燃2CO 2+2H 2O;现象:产生明亮火焰,冒黑烟。
(2)加成反应 ①单烯烃与卤素单质、H 2、卤化氢、水加成:CH 2===CH 2+Br 2−→−Br —CH 2CH 2—Br 。
CH 2===CH 2+H 2CH 3CH 3。
CH 2===CH 2+HBr −−→−催化剂CH 3CH 2Br 。
CH 2===CH 2+H 2O −−→−催化剂CH 3CH 2OH 。
②单双键交替烯烃的加成如1,3-丁二烯与溴单质加成的化学方程式为:1,2-加成:CH 2===CH —CH===CH 2+Br 2−→−1,4-加成: CH 2===CH —CH===CH 2+Br 2−→−(3)加聚反应n CH 2===CH 2−−→−催化剂4.炔烃的化学性质(以乙炔为例)三、脂肪烃的来源与石油化学工业 1.石油的物理性质和成分(1)颜色状态:黄绿色至黑褐色的黏稠液体。
(2)组成:主要是由气态烃、液态烃和固态烃组成的混合物,其中还含有少量不属于烃的物质。

炔烃、脂肪烃的来源和石油化学工业一、选择题1.中国南海海域是全球范围内石油储量与可开采储量较丰富、开采潜力较大的地方,有“第二个波斯湾”之称。
下列关于石油的说法正确的是( C )A .石油属于可再生矿物能源B .石油只含有碳、氢、氧三种元素C .石油裂化的主要目的是提高轻质液体燃料的产量和质量D .石油分馏的各馏分均是纯净物解析:石油属于不可再生矿物能源,故A 错误;石油中含有碳、氢、氧、氮、硫等元素,故B 错误;石油裂化的主要目的是提高轻质液体燃料的产量和质量,故C 正确;石油分馏得到的各馏分仍是混合物,故D 错误。
2.下列有关乙炔的叙述中,既不同于乙烯又不同于乙烷的是( D )A .能燃烧生成二氧化碳和水B .能跟溴水发生加成反应C .能跟酸性KMnO 4溶液发生氧化反应D .能与氯化氢反应生成氯乙烯解析:乙炔、乙烯、乙烷都能燃烧生成二氧化碳和水;乙炔、乙烯都能与溴水发生加成反应;乙烯、乙炔都能与酸性KMnO 4溶液发生氧化反应;只有乙炔可与HCl 加成生成氯乙烯。
3.鉴别甲烷、乙烯、乙炔三种气体可采用的方法是( D )A .通入溴水中,观察溴水是否褪色B .通入酸性高锰酸钾溶液中,观察颜色变化C .点燃,检验燃烧产物D .点燃,观察火焰明亮程度及产生黑烟量的多少解析:乙烯、乙炔均能使溴水、酸性KMnO 4溶液褪色;三者点燃后均能产生CO 2和H 2O,但因含碳量不同,火焰的明亮程度及产生黑烟量不同,所以点燃,观察火焰明亮程度及产生黑烟量的多少可以鉴别三者,甲烷燃烧产生明亮的淡蓝色火焰,乙烯燃烧冒黑烟,乙炔燃烧产生浓烟,故选D 。
4.下列说法错误的是( D )石油――→①分馏产品――→②乙烯――→③CH 2BrCH 2BrA .石油主要是由烃组成的混合物B .①主要发生物理变化C.②包括裂化、裂解等过程D.③是加成反应,产物名称是二溴乙烷解析:石油的主要成分是各种烷烃、环烷烃、芳香烃的混合物,即石油主要是由烃组成的混合物,故A正确;分馏是利用沸点不同进行分离的,所以分馏属于物理变化,故B正确;裂化、裂解等过程是把大分子的烃转化为小分子烃,过程中有乙烯生成,所以②包括裂化、裂解等过程,故C正确;乙烯与溴加成生成CH2BrCH2Br,所以③是加成反应,CH2BrCH2Br的名称为1,2二溴乙烷,故D错误。
专题3 常见的烃第一单元脂肪烃第二课时脂肪烃第二课时脂肪烃的的来源与石油化学工业随堂基础巩固[随堂基础巩固]1.下列物质有固定沸点的是( ) A.石油B.汽油C.煤油D.新戊烷解析:A、B、C均为混合物,没有固定熔沸点。
而D是纯净物。
答案:D[2.下列石油制品中,沸点范围最低的是( ) A.柴油B.润滑油C.汽油D.煤油答案:C3.下列关于煤、石油、天然气等资源的说法正确的是( ) A.石油裂解得到的汽油是纯净物B.石油产品都可用于聚合反应C.天然气是一种清洁的化石燃料D.水煤气是通过煤的液化得到的气体燃料解析:汽油是混合物,A项错误;石油的分馏和直馏产品中不含烯烃,不能发生聚合反应,B项错误;水煤气是由煤通过汽化反应得到的燃料,D项错误。
答案:C4.广州亚运会火炬使用的燃料是一种常用燃料,其分子式为C3H8。
(1)它属于________。
A.烷烃B.烯烃C.炔烃D.芳香烃(2)下列关于这种燃料说法正确的是________。
A.常温常压下为液体B.与1丁烯互为同分异构体C.分子中所有原子共平面,一氯代物有5种[D.1 mol这种燃料完全燃烧需5 mol氧气(3)居民所用石油液化气的主要成分是丁烷,在使用过程中,常有一些杂质以液态沉积于钢瓶中,这些杂质可能是________。
A.甲烷和丙烷B.乙烷和甲醛C.乙烷和丁烷D.戊烷和己烷(4)1丁烯与溴的四氯化碳反应后,所得到的一个有机物分子中所含的手性碳原子个数为________个。
解析:(1)C3H8中只含有碳和氢两种元素,且满足C n H2n+2的通式,故为烷烃。
(2)分子中只含有三个碳,故应为气体,A项错误;B项C3H8属于烷烃,故不可能与烯烃互为同分异构体,错误;分子中的H原子,不可能处于同一平面上,因为烷烃中的碳原子与周围原子构成四面体形,C项错误;D项可写出相应的化学反应方程式进行判断。
(3)杂质为液态,其含碳原子应超过四个,则应选D项。
专题三常见的烃
第一单元脂肪烃
基本要求:
1、能正确区分脂肪烃、芳香烃、饱和烃和不饱和烃。
2、了解烷烃、烯烃、炔烃物理性质的变化与分子中碳原子数的关系。
3、以典型代表物为例,掌握烷烃、烯烃、炔烃等有机化合物的化学性质,进一
步掌握取代反应、加成反应、加聚反应等典型的有机反应类型。
4、了解不饱和烃与氢气、水、卤化氢等物质的加成反应。
5、能根据烯烃的加聚反应分析有机高分子的链接和单体。
6、知道脂肪烃的来源,了解石油化学工业中分馏、裂化、裂解等处理方法的主
要原理及产物,了解石油化工产品对人们生活的影响。
发展要求:
了解合成常见高分子化合物的方法
说明:1、烯烃的不对称加成反应及马氏规则不作要求。
2、环状脂肪烃的结构与性质不作要求。
第1、2课时脂肪烃的性质
一、烷烃(又可称饱和烃)
1、结构特点:可用“单”、“链”、“饱”概括。
(单键、锯齿、四面体)
分子式通式:C n H2n+2
2、物理性质:
(1)熔沸点:①碳原子数越多,相对分子质量越大,熔沸点越高;
(如:甲烷<乙烷<丙烷<正丁烷)
②碳原子数相同时,支链数越多,熔沸点越低。
(如:正丁烷>异丁烷;正戊烷>异戊烷>新戊烷)
③常温常压下是气体的烷烃,其碳原子数小于等于4,此外,
新戊烷常温常压下也是气体。
随着分子中碳原子数目的增加,
状态由气态逐渐过渡到液态和固态。
(2)密度:碳原子数越多,密度越大;液态烷烃的密度小于水的密度。
(3)溶解性:不溶于水,易溶于有机溶剂。
有的液态烷烃本身就是有机溶剂,如己烷、汽油、煤油等。
3、化学性质:
一般比较稳定。
与酸、碱、氧化剂都不发生反应,也难与其它物质化合。
(1)取代反应
写出CH
4光照下与Cl
2
反应的方程式
(2)氧化反应(使酸性KMnO
4
溶液褪色)
燃烧的通式: 甲烷燃烧的现象:
随着碳原子数的增加,往往燃烧越来越不充分(烷烃C n H 2n+2中,n 越大,w(C)越大),火焰明亮,并伴有黑烟。
(3)高温分解反应:
甲烷隔绝空气高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃,这在石油化工上有很重要的应用,称为_________________。
二、烯烃(分子中含有 碳碳双键 的不饱和烃)
1、单烯烃: 分子中含有一个碳碳双键 多烯烃: 分子中含有两个及以上碳碳双键
单烯烃(简称烯烃) 分子式的通式:C n H 2n 组成特点: 碳氢原子个数比1:2
二烯烃:分子中含有二个碳碳双键。
二烯烃又可分为孤立二烯烃和共轭二烯烃;共轭二烯烃的结构特点是单双键交替排列,在加成反应时不同于一般的单烯烃;而孤立二烯烃是在二个双键之间相隔二个或二个以上的单键,化学性质和单烯烃相同。
2、物理性质(类似于烷烃)
3、化学性质:
(1)加成反应(与H 2、X 2、HX 、H 2O 、HCN 等)
例:①写出下列反应的化学方程式: 乙烯通入溴水中: 乙烯与水的反应: 乙烯与溴化氢反应:
② 阅读课本P42 “马氏加成规则”,丙烯与氯化氢、H 2O 反应后,会生成什么产物呢?试写出反应方程式。
③1,3-丁二烯与溴单质可能发生的两种加成反应,试写出反应方程式。
1,2-加成:
1,4-加成:
(双键中一根键容易断裂) CH 2=CH -CH =CH 2 + Br 2
Br Br
Br
Br
1 2 3 4 1 2 3 4
1 2 3 4 1,2—加成 -80℃
1 2 3 4 Br
Br 1,4—加成
60℃
1
4 Br
Br
(
2)
氧
化
反应
①燃烧:用通式表示烯烃的燃烧化学方程式_______________________
烯烃C n H2n中,w(C)不变
乙烯燃烧的现象:
②烯烃可使酸性KMnO4溶液褪色,烯烃被氧化的产物的对应关系为:例:现已知某烯烃的化学式为C5H10,它与酸性高锰酸钾溶液反应后得到的产
物为乙酸和丙酸,推测出此烯烃的结构简式为。
若与酸性高锰酸钾溶
液反应后得到的产物是二氧化碳和丁酮
,则此烯烃的结构简式为
(3)加聚反应
A 、乙烯型加聚反应
(1)聚乙烯的合成:nCH2= CH2[ ]n
乙烯聚乙烯
注意:a 单体——用以形成高分子化合物的小分子物质
b 链节——高分子化合物中不断重复的基本结构单元
c 聚合度——链节的数目n叫做。
由于n不同因此高聚物都是混合物。
CH3 CH2—C—CH3
O
—CH2—CH2—
(2) 聚苯乙烯的合成
2
—CH2 ]n
苯乙烯聚苯乙烯
(3) 聚氯乙烯的合成
n CH2=CHCl [ CH2—CH ]n
氯乙烯聚氯乙烯
(4) 聚丙烯的合成
n CH2= CHCH3[ CH2—CH ]n
丙烯聚丙烯
这一类加聚反应都可以理解为以乙烯为母体,其它原子或原子团,去取代乙烯上的H原子。
例:试写出乙烯和丙烯以物质的量之比1:1混合,在一定条件下发生加聚反应的化学方程式。
B、1,3-丁二烯型加聚反应
nCH2=CH-CH=CH2
二烯烃的加聚反应可以理解为以1,3-丁二烯为母体,其它原子或原子团,去取代1,3-丁二烯上的H原子。
例:天然橡胶是异戊二烯(CH2=C-CH=CH2通过加聚反应形成的一类高分子物质。
写出相关的化学方程式。
nCH2=C-CH=CH2
小结:对于加聚反应所形成的高分子物质,其主链碳原子是原来的不饱和碳原子。
催化剂
Cl
催化剂
催化剂
CH3
1 2 3 4
催化剂-CH
2
-CH=CH-CH2-
[ ]n
CH3
CH3
催化剂-CH
2
-CH=CH-CH2-
[ ]n
CH3
三、炔烃(分子中含有碳碳叁键的不饱和烃)
1、单炔烃:分子中含有一个碳碳叁键烃
其分子式的通式为C n H2n-2,与同碳原子数的二烯烃、环烯烃互为同分异构体。
2、物理性质(类似于烷烃)
3、化学性质:
(1)加成反应(与H2、X2、HX、H2O、HCN等,按1:1或1:2的比例)乙炔与氢气1:2反应_________________________________________________
丙炔与氯化氢1:1反应_______________________________________________
乙炔与水反应___________________________________________________ (2)氧化反应
①写出乙炔燃烧反应的化学方程式_____________________________
乙炔燃烧的现象_____________________________,与甲烷、乙烯燃烧对比,出现不同的现象的原因是
炔烃C n H2n-2中,n越大,w(C)越小
②炔烃可使酸性KMnO4溶液褪色,炔烃被氧化的产物的对应关系为:
HC≡氧化为CO2R-C≡氧化为R-COOH (3)聚合反应
第3课时脂肪烃的来源
1、实验室制法
(1)乙烯的实验室制法
CH2=CH2+H2O (消去反应)
原理:CH3CH2OH 浓硫酸
170℃
装置:液+ 液气体
注意事项:
①浓H2SO4的作用:催化剂,吸水剂
②碎瓷片的作用是防止反应液暴沸
③温度必须达到170℃否则会有其它产物生成
④温度计应插入反应液中,作用是测量反应液的
温度,以便控制反应的进行。
(2)乙炔的实验室制法
原理:CaC 2 + 2H
2O CH ≡CH ↑+ C a (OH )2 装置:固 + 液 → 气 收集方法:排水收集法
注意事项:①一般用饱和食盐水与CaC 2反应,这样可以减缓反应速率
②制取H 2、CO 2、H 2S 可用启普发生气,但制乙炔不能用。
③制取乙炔时,应在导气管附近塞入少量棉花。
④在点燃乙炔前必须先检查纯度,否则易出现爆炸事故。
⑤制得的乙炔有臭味是因为含H 2S 、PH 3,除杂宜用硫酸铜溶液。
2、 工业来源
(1)石油的成分——各种烃的混合物
(2)石油炼制方法
A 分馏——根据石油中各物质的沸点不同,用加热的方法,使各成分分离,
是石油炼制过程中最常用的方法
B 裂化——为了提高轻质油(如汽油)的产量,用加热或催化剂使石油中碳
链较长的有机物分解为碳链较短的物质,通常分为热裂化和催化裂化
C 裂解——深度裂化,目的是为了获得小分子的烯烃
D 催化重整——获得芳香烃的主要途径。