双缩脲法测蛋白质含量
- 格式:pptx
- 大小:11.67 MB
- 文档页数:19

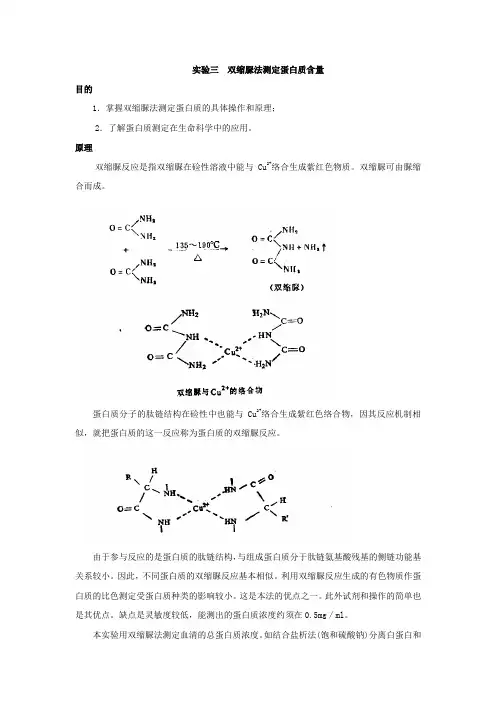
实验三双缩脲法测定蛋白质含量目的1.掌握双缩脲法测定蛋白质的具体操作和原理;2.了解蛋白质测定在生命科学中的应用。
原理双缩脲反应是指双缩脲在硷性溶液中能与Cu2+络合生成紫红色物质。
双缩脲可由脲缩合而成。
蛋白质分子的肽链结构在硷性中也能与Cu2+络合生成紫红色络合物,因其反应机制相似,就把蛋白质的这一反应称为蛋白质的双缩脲反应。
由于参与反应的是蛋白质的肽链结构,与组成蛋白质分于肽链氨基酸残基的侧链功能基关系较小。
因此,不同蛋白质的双缩脲反应基本相似。
利用双缩脲反应生成的有色物质作蛋白质的比色测定受蛋白质种类的影响较小。
这是本法的优点之一。
此外试剂和操作的简单也是其优点。
缺点是灵敏度较低,能测出的蛋白质浓度约须在0.5mg/ml。
本实验用双缩脲法测定血清的总蛋白质浓度。
如结合盐析法(饱和硫酸钠)分离白蛋白和球蛋白还可用于血清白蛋白和球蛋白浓度及其比值(A/G)的测定。
器材1.试管及试智架2.0.2m1微量吸管(或200ul微量加液器)3.1ml、2ml、5ml刻度吸管4.721型分光光度计试剂1.0.9%NaCl2.双缩脲试剂称取CuSO45H2O结晶(AR级试剂)1.5g,酒石酸钾钠(AR级试剂)6.0g溶于500ml水中,添加10%NaOH 300ml及KI1.0g.混匀后加水稀释至1000ml。
本试剂可长期保存。
3.牛血清白蛋白标准液此溶液可用于替代标准血清。
称取试剂级冻干牛血清白蛋白300mg置lOOml容量瓶中,用0.9%NaCl溶解后稀释至刻度,避免振摇起泡,置4℃冰箱保存。
此标准液浓度为300mg/m1。
4.被检血清样本操怍1. 取试管1支,以0.2m1微量吸管(或200ul微量加液器)吸取被检血清0.200ml(吸管外壁须用滤纸片拭净)。
慢慢放入试管底部。
最后一点液体应吹出,靠落在试管壁上。
2.加入0.9%NaCl 3.80ml,充分混匀但不要振摇起泡。
3.另取试管二支,标上号码,其一用吸管加入操作2所准备的血清样本稀释液1.00ml 另一管加入牛血清白蛋白标准液1.00ml。


双缩脲法测定蛋白质的含量
目的:了解双缩脲测定蛋白质的原理
掌握分光光度计的使用方法
原理:双缩脲(NH2-CO-NH-CO-NH2)在碱性溶液中与二价铜离子产生紫色络合物,在580nm处有最大吸收峰。
蛋白质分子中含有肽键也能发生此反应,且紫色的深浅与蛋白质的浓度成正比,符合朗伯-比尔定律,因此利用分光光度计测定其吸光度(A),利用标准曲线经计算可得蛋白质含量。
操作:
一、标准曲线的绘制(以酪蛋白为标准物已绘好标准曲线,贴在试验台侧面)
二、样品测定(先洗净烘干3个具塞锥形瓶,烘箱在走廊)
准确称取烘干样品0.1克两份,分别放入两个干燥的具塞锥形瓶中,另取一锥型瓶作空白。
各瓶中分别加入碳酸铜1克,无水乙醇20毫升,10%KOH 20毫升。
每加一种试剂后都要摇匀。
振摇10分钟,静置片刻,分别过滤,取滤液用分光光度计在580nm波长下读取吸光度(A)值,在标准曲线上查出相应的蛋白质含量。
三、结果计算
也可代入根据标准曲线得到的直线公式进行计算。

实验17 蛋白质含量测定(双缩脲法)一、目的掌握双缩脲法测定蛋白质含量的原理和方法。
掌握分光光度计的使用方法。
二、原理碱性溶液中双缩脲(NH 2 一co 一NH 一co 一NH 2 )能与Cu 2 + 产生紫红色的络合物,这一反应称为“双缩脲反应”。
蛋白质分子中的肽键也能与铜离子发生双缩脲反应,溶液紫红色的深浅与蛋白质含量在一定范围内符合朗伯一比尔定律,而与蛋白质的氨基酸组成及分子质量无关。
其可测定范围为1- l0mg 蛋白质,适用于精度要求不高的蛋白质含量测定。
Tris ,一些氨基酸,EDTA等会干扰该测定。
三、仪器、试剂和材料1 .仪器(1) 分光光度计( 2 )分析天平( 3 )振荡机( 4 )刻度吸管:1m1X2 ,5m1X2 ,10m1 X 1 (5 )具塞三角瓶:1OOml (6 )漏斗:13 个2 .试剂( 1 )双缩脲试剂:取硫酸铜(Cu S0 4 5H 2 O ) 1.5g 和酒石酸钾钠(NaKC 4 H 4 O 6 .4H 2 O ) 6.0g ,溶于500m1 蒸馏水中,在搅拌的同时加入300m1 10% NaOH 溶液,定容至1000 ml ,贮于涂石蜡的试剂瓶中。
( 2 )0.05mol/L 的NaOH 。
(3) 标准酪蛋自溶液:准确称取酪蛋白0.5g 溶于0.05mol/ L 的NaOH 溶液中,并定容至100m1, 即为5mg/m1 的标准溶液。
3 .材料小麦、玉米或其他谷物样品,风干、磨碎并通过100 目铜筛。
四、操作步骤1 .标准曲线的绘制取 6 支试管,编号,按下表加入试剂:准曲线。
2 .样品测定( 1 )将磨碎过筛的谷物样品在80 ℃下烘至恒重,取出置于燥器中冷却待用。
( 2 )称取烘干样品约0.2g 两份,分别放入两个干燥的三角瓶中。
然后在各瓶中分别加入5ml 0.O5mol /L 的NaOH 溶液湿润,之后再加入20ml 的双缩脲试剂,震荡15min ,室温静置反应30min ,分别过滤,取滤液在540nm 波长下比色,在标准曲线上查出相应的蛋白质含量(mg )。


实验二十蛋白质含量测定一一双缩腺法测定蛋白质含量一、实验目的学习和掌握用双缩腺法测定蛋白质含量的原理和方法。
二、实验原理在碱性溶液中,双缩腺(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩腺反应。
凡分子中含二个或二个以上酰胺基 (一CO-NH2),或与此相似的基团[如一CH2-NH2,— CS-NH2,— C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(-CO-NH ―),可发生双缩腺反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1〜10mg蛋白质。
干扰这一测定的物质主要有:硫酸钱、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩腺法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1 •双缩腺试剂:取CuSO4・5H20.)和酒石酸钾钠・)以少量蒸憾水溶解,再加/ L NaOH 溶液300ml, KI,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2・标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA咸标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O或%NaCI配制,酪蛋白用L NaOH配制。
[器材]1. 试管:15Xl50mm试管7只;2. 1ml,5ml 移液管;3. 坐标纸4. 721分光光度计。
四、实验操作取试管7支,编号,按下表操作:混匀,37C水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零, 读取各管吸光度值。

双缩脲法测定蛋白质含量一、双缩脲法实验原理双缩脲法测定蛋白质含量实验中,双缩脲是在大约180°C条件下加热两个尿素分子,以达到释放出一个氨分子而获得的产物。
在强碱性溶液中,缩二脲和硫酸铜形成紫色络合物,称为缩二脲反应。
任何包含两个酰胺基或两个直接连接的肽键或可以通过中间碳原子连接的肽键的化合物都将发生缩二脲反应。
紫色复合色的强度与蛋白质浓度成正比,与蛋白质分子量和氨基酸组成无关。
它可以用来确定蛋白质含量。
测量范围是1-10mg蛋白质。
干扰测定的主要物质是:硫酸铵,Tris缓冲液和某些氨基酸。
这种方法的优点是速度快,不同的蛋白质产生相似的颜色,干扰物质少。
主要缺点是灵敏度差。
因此,缩二脲法通常不用于蛋白质的精确测定。
二,双缩脲法所需材料1种试剂:标准蛋白溶液的制备:用标准结晶牛血清白蛋白(bsa)或标准酪蛋白制备10mg/ml标准蛋白溶液。
可以用0.66a280校准纯度,bsa浓度为1mg/ml。
如有必要,可以使用标准蛋白质预先通过微凯氏定氮法测定蛋白质氮含量,计算其纯度,然后称重,并根据其纯度制备标准蛋白质溶液。
用H2O或0.9%NaCl制备牛血清白蛋白,用0.05NaOH制备酪蛋白。
双缩脲试剂制备:称取1.50g硫酸铜(CuSO4•5H2O),6.0g酒石酸钾钠(KNaC4H4O6•4H2O),溶于500ml水,在搅拌下加入300ml10%NaOH溶液,用水稀释至1升,储存在塑料瓶(或内壁涂有石蜡的瓶子)。
该试剂可以长期保存。
如果在储存瓶中出现黑色沉淀物,则需要对其进行重新配制。
2台设备:可见光分光光度计,15个大试管,涡旋混合器等三,双缩脲法的实验步骤1标准曲线的确定:将12个试管分为两组,分别加入0、0.2、0.4、0.6、0.8、1.0ml蛋白质标准溶液,用水补足1ml,再加入4ml缩二脲试剂。
摇匀后,在室温(20-25℃)下放置30分钟,并在540nm下测量颜色。
第一个不含蛋白质溶液的试管是空白对照溶液。

双缩脲法测定蛋白质含量实验报告实验目的:通过双缩脲法测定不同食品中蛋白质的含量,掌握蛋白质含量的测定方法,为食品质量检测提供参考。
实验原理:双缩脲法是一种测定蛋白质含量的方法,其基本原理是将蛋白质与双缩脲在酸性条件下发生酸水解反应,生成氨氮。
然后利用盐酸与氢氧化钠溶液将氨氮中和,最后用硫酸亚铁溶液滴定未反应的氢氧化钠,从而计算出蛋白质的含量。
实验步骤:1. 样品制备,将不同食品样品按照一定比例加入试管中,加入适量的双缩脲溶液和盐酸溶液,混合均匀后静置片刻。
2. 酸水解反应,将试管放入沸水中进行酸水解反应,控制时间和温度,使反应充分进行。
3. 氨氮的中和,取出试管,加入氢氧化钠溶液,使氨氮中和。
4. 滴定,用硫酸亚铁溶液滴定未反应的氢氧化钠,记录滴定消耗的体积。
5. 计算,根据滴定的体积计算出样品中蛋白质的含量。
实验结果:经过实验测定,不同食品样品中蛋白质含量分别为,样品A为12.5g/100g,样品B为9.8g/100g,样品C为15.2g/100g。
实验分析:通过实验测定得出的结果,可以看出样品C中蛋白质含量最高,样品B次之,样品A最低。
这与我们平常对这些食品的认知基本一致,也验证了实验方法的准确性和可靠性。
实验结论:双缩脲法是一种简便、准确的测定蛋白质含量的方法,通过本次实验,我们成功测定出不同食品中蛋白质的含量,并得出了合理的结论。
这为我们今后进行食品质量检测提供了参考和依据。
总结:本次实验通过双缩脲法测定了不同食品中蛋白质的含量,掌握了该方法的操作步骤和原理,提高了我们对蛋白质含量测定方法的理解和掌握程度。
同时,也增强了我们对食品质量检测的实际操作能力和实验数据分析能力,为今后的实验和科研工作打下了坚实的基础。

双缩脲法测定蛋白质含量实验报告双缩脲法测定蛋白质含量实验报告引言:蛋白质是生命体内不可或缺的重要营养物质,对于维持生命活动和促进生长发育具有重要作用。
因此,准确测定蛋白质含量对于研究生物学、医学等领域具有重要意义。
本实验选用双缩脲法测定蛋白质含量,通过对其原理、步骤和结果的详细描述,探讨该方法的可行性和准确性。
实验原理:双缩脲法是一种常用的测定蛋白质含量的方法。
该方法基于蛋白质与双缩脲在碱性条件下发生酸解反应,生成氨基酸和缩脲。
然后,通过与酚类试剂发生酚酞反应,产生红色化合物,利用比色法测定其吸光度,从而间接测定蛋白质含量。
实验步骤:1. 准备样品:将待测样品溶解在适量的缩脲溶液中,并加入一定量的氢氧化钠溶液,使其呈碱性。
2. 酸解反应:将样品置于水浴中,加热至沸腾,保持一段时间,使蛋白质充分酸解。
3. 加入酚类试剂:待样品冷却后,加入酚类试剂,与缩脲反应生成红色化合物。
4. 比色测定:将反应液转移到比色皿中,利用分光光度计测定其吸光度。
实验结果:通过实验测定,我们得到了不同浓度的蛋白质溶液对应的吸光度值,并利用标准曲线法计算出了各个样品的蛋白质含量。
结果显示,吸光度与蛋白质浓度呈正相关关系,且线性关系良好。
通过对样品的测定,我们准确地测定了其蛋白质含量。
讨论:双缩脲法测定蛋白质含量具有操作简单、结果准确、灵敏度高等优点,被广泛应用于生物学、医学等领域。
然而,该方法也存在一些局限性。
首先,该方法对于某些特殊的蛋白质样品可能不适用,例如含有酶活性的蛋白质。
其次,该方法对于其他物质的干扰较为敏感,如胆红素、尿素等,可能会导致结果的误差。
因此,在实际应用中,我们需要根据具体情况选择合适的方法来测定蛋白质含量。
结论:通过本次实验,我们成功地利用双缩脲法测定了不同样品中蛋白质的含量,并得到了准确的结果。
该方法操作简单、结果准确,适用于大多数蛋白质样品的测定。
然而,在实际应用中,我们需要注意该方法的局限性,并结合具体情况选择合适的方法进行蛋白质含量的测定。

双缩脲法测定蛋白质含量实验二十蛋白质含量测定——双缩脲法测定蛋白质含量一、实验目的学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
二、实验原理在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1~10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1.双缩脲试剂:取CuSO4·5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml,KI 1.0g,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2.标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05mol/L NaOH配制。
[器材]1.试管:15×150mm 试管7只;2.1ml,5ml移液管;3.坐标纸;4.721分光光度计。
四、实验操作取试管7支,编号,按下表操作:混匀,37℃水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。
实验二十蛋白质含量测定一一双缩脲法测定蛋白质含量一、实验目的学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
、实验原理在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(一CO-NH2),或与此相似的基团[如一CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH —),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1〜10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近, 敏度以及干扰物质少。
主要的缺点是灵差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1 •双缩脲试剂:取CuSO4 • 5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml, KI 1.0g,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2. 标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O或0.9%NaCI配制,酪蛋白用0.05mol/L NaOH配制。
[器材]1. 试管:15X 150mm试管7只;2. 1ml,5ml 移液管;3. 坐标纸;4. 721分光光度计。
四、实验操作取试管7支,编号,按下表操作:混匀,37C水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。
实验二十蛋白质含量测定——双缩脲法测定蛋白质含量一、实验目的学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
二、实验原理在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1~10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1.双缩脲试剂:取CuSO4·5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml,KI 1.0g,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2.标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05mol/L NaOH配制。
[器材]1.试管:15×150mm 试管7只;2.1ml,5ml移液管;3.坐标纸;4.721分光光度计。
四、实验操作混匀,37℃水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。