双缩脲法测定蛋白质
- 格式:ppt
- 大小:195.00 KB
- 文档页数:25
实验三双缩脲法测定蛋白质含量目的1.掌握双缩脲法测定蛋白质的具体操作和原理;2.了解蛋白质测定在生命科学中的应用。
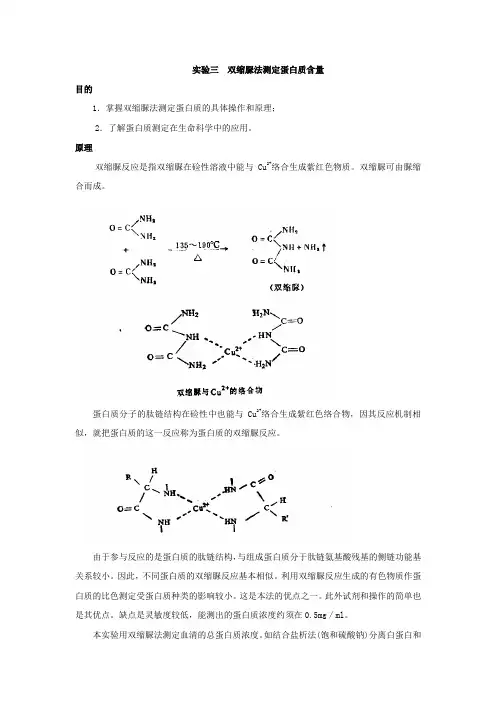
原理双缩脲反应是指双缩脲在硷性溶液中能与Cu2+络合生成紫红色物质。
双缩脲可由脲缩合而成。
蛋白质分子的肽链结构在硷性中也能与Cu2+络合生成紫红色络合物,因其反应机制相似,就把蛋白质的这一反应称为蛋白质的双缩脲反应。
由于参与反应的是蛋白质的肽链结构,与组成蛋白质分于肽链氨基酸残基的侧链功能基关系较小。
因此,不同蛋白质的双缩脲反应基本相似。
利用双缩脲反应生成的有色物质作蛋白质的比色测定受蛋白质种类的影响较小。
这是本法的优点之一。
此外试剂和操作的简单也是其优点。
缺点是灵敏度较低,能测出的蛋白质浓度约须在0.5mg/ml。
本实验用双缩脲法测定血清的总蛋白质浓度。
如结合盐析法(饱和硫酸钠)分离白蛋白和球蛋白还可用于血清白蛋白和球蛋白浓度及其比值(A/G)的测定。
器材1.试管及试智架2.0.2m1微量吸管(或200ul微量加液器)3.1ml、2ml、5ml刻度吸管4.721型分光光度计试剂1.0.9%NaCl2.双缩脲试剂称取CuSO45H2O结晶(AR级试剂)1.5g,酒石酸钾钠(AR级试剂)6.0g溶于500ml水中,添加10%NaOH 300ml及KI1.0g.混匀后加水稀释至1000ml。
本试剂可长期保存。
3.牛血清白蛋白标准液此溶液可用于替代标准血清。
称取试剂级冻干牛血清白蛋白300mg置lOOml容量瓶中,用0.9%NaCl溶解后稀释至刻度,避免振摇起泡,置4℃冰箱保存。
此标准液浓度为300mg/m1。
4.被检血清样本操怍1. 取试管1支,以0.2m1微量吸管(或200ul微量加液器)吸取被检血清0.200ml(吸管外壁须用滤纸片拭净)。
慢慢放入试管底部。
最后一点液体应吹出,靠落在试管壁上。
2.加入0.9%NaCl 3.80ml,充分混匀但不要振摇起泡。
3.另取试管二支,标上号码,其一用吸管加入操作2所准备的血清样本稀释液1.00ml 另一管加入牛血清白蛋白标准液1.00ml。


实验46.双缩脲法定量测定蛋白质一、实验目的1、学会使用移液管,掌握双缩脲法测定尿蛋白的原理和操作方法。
2、掌握分光光度计的使用,初步了解比色法的基本原理。
二、实验原理蛋白质是含氮的有机高分子化合物,分子中含有多个与双缩脲分子相似的结构(肽键),碱性硫酸铜溶液中,蛋白质与硫酸铜的Cu2+离子等络合生成紫红色络合物,其颜色深浅与蛋白质含量成正比,可用比色法测定。
经比色法求出尿中蛋白质的含量。
反应如下:三、实验试剂与材料仪器试剂1.标准酪蛋白溶液(10mg/ml)酪蛋白预先用微量凯氏定氮法测定蛋白质含量,根据纯度称量配成标准液10.0mg/ml,用0.05N氢氧化钠溶液配制。
2. 双缩肽试剂取硫酸铜(CuSO4·5H2O.AR)1.5G和酒石酸钾钠(KNaC4H2O·4H2O.AR)6.0g分别用蒸馏水250ml溶解后,一并转入1000ml容量瓶中混合,再加入10%的NAaOH溶液300ml,随加随摇匀。
最后用蒸馏水稀释到刻度,贮存于塑料瓶中,可长期保存,如有红色或黑色沉淀出现,需重新配制。
3.未知浓度酪蛋白溶液:称取上述实验中酪蛋白0.5g,放入100ml烧杯中,加25ml0.2NNaOH 溶液,摇匀隔水加热,将溶液转移到50ml容量瓶中。
用少量蒸馏水洗烧杯数次,洗液并入容量瓶中,最后加水至刻度,摇匀,置冰箱中保存。
仪器1.721分光光度计(使用光径为10mm的比色皿)2.刻度吸管1ml1支、2 ml2支、5ml1支3.试管(15mm×150mm)7支4.托盘天平5.分析天平6.量筒:500 ml、100 ml各1支7.容量瓶:50 ml、1000ml各1支8.恒温水浴(20-250C,如室温接近可不用)。
四、实验方法上述试剂加完后,混匀,室温放置30分钟以内测完,比色(540nm )。
记下各管光吸收度,做A 540-蛋白质浓度曲线。
2.样品测定:取未知酪蛋白浓度样品液三管各1.0ml ,同上6号管操作测光密度,在标准曲线上查出其对应蛋白质毫克数,即为所测酪蛋白溶液浓度(mg/ml )。

1. 理解并掌握双缩脲法测定蛋白质含量的原理。
2. 学会使用双缩脲试剂进行蛋白质含量的测定。
3. 通过实验,了解实验误差的产生及其控制方法。
二、实验原理双缩脲法是一种基于蛋白质分子中肽键与铜离子反应产生紫色络合物的分析方法。
当蛋白质分子中的肽键在碱性条件下与铜离子作用时,会形成紫红色的络合物。
该络合物在540nm波长处的吸光度与蛋白质含量呈正比关系,因此可以通过测定吸光度来推算蛋白质的含量。
三、实验材料与仪器1. 实验材料:- 蛋白质标准品- 待测蛋白质样品- 双缩脲试剂- 6mol/L的NaOH溶液- 0.1g/mL的硫酸铜溶液- 7支试管- 移液器- 分光光度计2. 实验仪器:- 磁力搅拌器- 电子天平- 移液管- 量筒1. 标准曲线的制作:- 取7支试管,分别加入0、0.2、0.4、0.6、0.8、1.0ml的蛋白质标准品溶液,用水补足至1ml。
- 各管中加入4ml双缩脲试剂,充分摇匀。
- 在室温下反应30分钟。
- 使用分光光度计在540nm波长处测定吸光度。
- 以蛋白质标准品浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定:- 取待测蛋白质样品1ml,加入4ml双缩脲试剂,充分摇匀。
- 在室温下反应30分钟。
- 使用分光光度计在540nm波长处测定吸光度。
- 从标准曲线上查找对应的蛋白质含量。
五、实验结果与分析根据实验步骤,绘制标准曲线,并在标准曲线上查找待测样品的蛋白质含量。
实验结果显示,待测样品的蛋白质含量为X mg/mL。
六、实验讨论1. 误差分析:- 误差主要来源于实验操作、试剂质量、仪器精度等因素。
- 为了减少误差,需要严格控制实验操作,使用高精度的仪器,并确保试剂质量。
2. 干扰因素:- 双缩脲法测定蛋白质含量时,一些物质可能会产生干扰,如三羟甲基氨基甲烷、一些氨基酸和EDTA等。
- 为了排除干扰,可以在实验前对样品进行预处理,如透析、凝胶过滤等。
3. 注意事项:- 在使用双缩脲试剂时,必须注意试剂的配制和储存条件。

双缩脲法测定蛋白质含量实验报告一、实验目的1、掌握双缩脲法测定蛋白质含量的原理和方法。
2、熟悉分光光度计的使用。
3、学会绘制标准曲线,并通过标准曲线计算未知样品中蛋白质的含量。
二、实验原理双缩脲(NH₂CONHCONH₂)在碱性溶液中能与铜离子(Cu²⁺)作用,形成紫红色的络合物。
由于蛋白质分子中含有多个与双缩脲结构相似的肽键,因此也能发生类似的反应。
而且,反应所产生的颜色深浅与蛋白质的浓度成正比,在 540nm 波长处有最大吸收峰。
据此,可以通过比色法测定蛋白质的含量。
三、实验材料与仪器1、材料标准蛋白质溶液:浓度为 10mg/mL 的牛血清白蛋白溶液。
未知蛋白质样品溶液。
双缩脲试剂:由硫酸铜(CuSO₄·5H₂O)、酒石酸钾钠(NaKC₄H₄O₆·4H₂O)和氢氧化钠(NaOH)配制而成。
2、仪器分光光度计。
移液管(1mL、5mL、10mL)。
容量瓶(100mL)。
试管及试管架。
四、实验步骤1、标准曲线的绘制取 6 支干净的试管,编号为 1 6 号。
按照下表在各试管中分别加入试剂:|试管编号|1|2|3|4|5|6||||||||||标准蛋白质溶液(mL)|0|02|04|06|08|10||蒸馏水(mL)|10|08|06|04|02|0||蛋白质含量(mg)|0|2|4|6|8|10|向各试管中加入 4mL 双缩脲试剂,摇匀后,在室温下放置 30 分钟。
以 1 号试管为空白对照,在 540nm 波长处,用分光光度计测定各试管中溶液的吸光度值(A)。
以蛋白质含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
2、样品蛋白质含量的测定取 2 支干净的试管,编号为 7 号和 8 号。
在 7 号试管中加入 1mL 未知蛋白质样品溶液,8 号试管中加入1mL 蒸馏水作为空白对照。
向 7 号和 8 号试管中分别加入 4mL 双缩脲试剂,摇匀后,在室温下放置 30 分钟。
以 8 号试管为空白对照,在 540nm 波长处,用分光光度计测定 7 号试管中溶液的吸光度值。


双缩脲法测定蛋白质含量一、双缩脲法实验原理双缩脲法测定蛋白质含量实验中,双缩脲是在大约180°C条件下加热两个尿素分子,以达到释放出一个氨分子而获得的产物。
在强碱性溶液中,缩二脲和硫酸铜形成紫色络合物,称为缩二脲反应。
任何包含两个酰胺基或两个直接连接的肽键或可以通过中间碳原子连接的肽键的化合物都将发生缩二脲反应。
紫色复合色的强度与蛋白质浓度成正比,与蛋白质分子量和氨基酸组成无关。
它可以用来确定蛋白质含量。
测量范围是1-10mg蛋白质。
干扰测定的主要物质是:硫酸铵,Tris缓冲液和某些氨基酸。
这种方法的优点是速度快,不同的蛋白质产生相似的颜色,干扰物质少。
主要缺点是灵敏度差。
因此,缩二脲法通常不用于蛋白质的精确测定。
二,双缩脲法所需材料1种试剂:标准蛋白溶液的制备:用标准结晶牛血清白蛋白(bsa)或标准酪蛋白制备10mg/ml标准蛋白溶液。
可以用0.66a280校准纯度,bsa浓度为1mg/ml。
如有必要,可以使用标准蛋白质预先通过微凯氏定氮法测定蛋白质氮含量,计算其纯度,然后称重,并根据其纯度制备标准蛋白质溶液。
用H2O或0.9%NaCl制备牛血清白蛋白,用0.05NaOH制备酪蛋白。
双缩脲试剂制备:称取1.50g硫酸铜(CuSO4•5H2O),6.0g酒石酸钾钠(KNaC4H4O6•4H2O),溶于500ml水,在搅拌下加入300ml10%NaOH溶液,用水稀释至1升,储存在塑料瓶(或内壁涂有石蜡的瓶子)。
该试剂可以长期保存。
如果在储存瓶中出现黑色沉淀物,则需要对其进行重新配制。
2台设备:可见光分光光度计,15个大试管,涡旋混合器等三,双缩脲法的实验步骤1标准曲线的确定:将12个试管分为两组,分别加入0、0.2、0.4、0.6、0.8、1.0ml蛋白质标准溶液,用水补足1ml,再加入4ml缩二脲试剂。
摇匀后,在室温(20-25℃)下放置30分钟,并在540nm下测量颜色。
第一个不含蛋白质溶液的试管是空白对照溶液。

双缩脲检验蛋白质步骤蛋白质是生命体内重要的基础组成部分,研究蛋白质的结构和功能对于理解生命活动具有重要意义。
双缩脲法是一种常用的蛋白质检测方法,它能够通过比色法测定蛋白质的含量。
下面将介绍双缩脲法检验蛋白质的步骤。
1. 准备样品需要准备待检测的蛋白质样品。
样品可以是细胞提取液、血清或其他含有蛋白质的溶液。
为了保证实验的准确性,样品应该是新鲜的,并且需要根据实验需要进行适当的稀释。
2. 制备双缩脲试剂双缩脲试剂是双缩脲法中的关键试剂,用于将蛋白质与缩脲反应生成可测定的复合物。
制备双缩脲试剂的方法是将缩脲溶解于碱性溶液中,并添加少量表面活性剂,然后进行混合和搅拌,直至完全溶解。
3. 加入样品和双缩脲试剂将准备好的样品滴加到含有双缩脲试剂的试管中,并进行充分混合。
在混合过程中,蛋白质与双缩脲试剂发生反应,生成稳定的复合物。
4. 孵育反应混合物将反应混合物孵育在适当的温度下,使蛋白质与双缩脲试剂充分反应。
通常,孵育时间为15-30分钟,可以根据实验需要进行调整。
5. 比色测定在反应混合物孵育结束后,使用紫外可见光谱仪或分光光度计对反应溶液进行比色测定。
双缩脲试剂与蛋白质反应后会产生一种特定的吸收峰,根据吸光度的变化可以确定蛋白质的含量。
6. 构建标准曲线为了准确测定蛋白质的含量,需要根据已知浓度的标准品制备一系列浓度不同的标准溶液,并对这些标准溶液进行双缩脲法测定。
然后,根据标准溶液的吸光度值和浓度值绘制标准曲线,利用标准曲线可以计算出待测样品中蛋白质的含量。
7. 计算蛋白质含量根据待测样品的吸光度值和标准曲线,可以计算出待测样品中蛋白质的含量。
通常,使用线性回归方程或差值法进行计算。
通过以上步骤,我们可以使用双缩脲法对蛋白质进行准确测定。
双缩脲法具有操作简单、结果稳定可靠的优点,被广泛应用于生物化学、分子生物学和生物医学研究中。
它不仅可以用于测定蛋白质的总量,还可以用于检测特定蛋白质的含量,对于研究蛋白质的生理功能和病理变化具有重要意义。

实验一:双缩脲法测定蛋白质含量一目的掌握双缩脲法测定蛋白质含量的原理及方法。
二原理双缩脲( )是两分子尿素经180℃左右加热,放出一分子氨( NH3)后得到的产物。
在强碱溶液中,双缩脲与CUSO4形成紫色络合物,称为双缩脲反应。
其原因是含有两个及以上肽键或类似肽键有化合物都具有类似双缩脲反应。
蛋白质含有多个肽键,在碱性溶液中能与CU2+络合成紫红色的络合物。
其颜色的深浅与被测样品中蛋白质浓度呈正比,而与蛋白质分子量和氨基酸成分无关,故可用来测定蛋白质含量。
该法对样品中蛋白质含量要求相对较高,一般在1—10mg/L蛋白质。
tris(三甲羟基氨基甲烷)、一些氨基酸、EDTA(乙二胺四乙酸)、草二酰胺、多肽等会于扰该测定。
在一定浓度范围内,反应后颜色与被测样品蛋白质含量呈线性关系,即蛋白质浓度越高,体系的颜色越深。
反应产物在540nm处有最大吸收峰(吸光度)。
将未知浓度的样品溶液与一系列已知浓度的标准蛋白质溶液同时与双缩脲试剂反应,并在540nm处比色,可通过标准浓度蛋白质绘制的标准曲线,求得未知样品中的蛋白质含量(浓度)。
由于本法操作简便、迅速、蛋白质浓度与光密度的线性关系好,故对蛋白质快速而不需要十分精确的测定可用此法。
三仪器与器材可见光分光光度计、水浴锅、分析天平、振荡机(器)、漏斗、试管架、具塞三角瓶(100ml)容量瓶(250 ml、500 ml、1000 ml)、刻度吸管(1.0 ml 2.0 ml 5.0 ml)试管(1.5cmX15cm)。
四试剂1、双缩脲试剂称取硫酸铜(CUSO4·5H2O)1.5g,酒石酸钾钠()6.0g,分别用250 ml蒸馏水溶解后,一并转入1000 m l容量瓶中,在搅拌下(可用旋涡混合器或摇动)加入30 ml10%(质量分数)NaOH溶液,然后用蒸馏水稀释至刻度(1000ml)。
将该试剂贮存于塑料瓶或内壁涂以石蜡的瓶内。
此试剂可长期保存(须无红色或黑色沉淀出现),长期使用。

实验二十蛋白质含量测定一一双缩脲法测定蛋白质含量一、实验目的学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
、实验原理在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(一CO-NH2),或与此相似的基团[如一CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH —),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1〜10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近, 敏度以及干扰物质少。
主要的缺点是灵差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1 •双缩脲试剂:取CuSO4 • 5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml, KI 1.0g,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2. 标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O或0.9%NaCI配制,酪蛋白用0.05mol/L NaOH配制。
[器材]1. 试管:15X 150mm试管7只;2. 1ml,5ml 移液管;3. 坐标纸;4. 721分光光度计。
四、实验操作取试管7支,编号,按下表操作:混匀,37C水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。

双缩脲试剂法测定蛋白质的原理双缩脲试剂法是一种常用的测定蛋白质含量的方法,其原理基于蛋白质与双缩脲反应生成比色产物。
蛋白质是生物体内最基本的有机物质之一,它在细胞结构、代谢、免疫、调节等方面起着重要作用。
因此,准确测定蛋白质的含量对于生物学研究、药物开发等领域具有重要意义。
双缩脲试剂法是一种常用的测定蛋白质含量的方法之一。
双缩脲试剂法的原理是基于蛋白质与双缩脲反应生成比色产物。
双缩脲试剂是一种含有两个缩脲基团的化合物,它能够与蛋白质中的酪氨酸、组氨酸等含有酚羟基或胺基的氨基酸发生反应,形成稳定的化合物。
这种化合物具有特定的光吸收特性,可以通过光谱仪测量其吸光度,并根据吸光度与蛋白质浓度的关系来计算蛋白质的含量。
具体操作时,首先将待测的蛋白质样品与双缩脲试剂按照一定的比例混合,使其充分反应。
反应后,通过离心等方法将产生的比色产物沉淀下来。
然后,将沉淀溶解并转移到比色皿中,利用光谱仪测量其吸光度。
根据标准曲线,可以将吸光度值转化为蛋白质的浓度。
双缩脲试剂法具有操作简单、灵敏度高、可靠性好等优点。
同时,它还可以适用于多种类型的蛋白质测定,包括溶液中的蛋白质、细胞裂解液中的蛋白质以及组织、器官等复杂样品中的蛋白质。
然而,双缩脲试剂法也存在一些限制。
首先,它只能测定含有酚羟基或胺基的氨基酸的蛋白质,对于其他类型的蛋白质可能不适用。
其次,双缩脲试剂在与蛋白质反应时可能会受到其他物质的干扰,影响测定结果的准确性。
因此,在进行蛋白质测定时,需要根据具体样品的特点选择合适的方法,并进行必要的干扰检测和校正。
总结起来,双缩脲试剂法是一种常用的测定蛋白质含量的方法,其原理是基于蛋白质与双缩脲反应生成比色产物。
它具有操作简单、灵敏度高、可靠性好等优点,适用于多种类型的蛋白质测定。
然而,该方法也存在一定的限制,需要根据具体样品的特点选择合适的方法,并进行必要的干扰检测和校正,以确保测定结果的准确性。
仅供个人参考不得用于商业用途For personal use only in study and research; not for commercial use 实验17 蛋白质含量测定(双缩脲法)一、目的掌握双缩脲法测定蛋白质含量的原理和方法。
掌握分光光度计的使用方法。
二、原理碱性溶液中双缩脲(NH 2 一co 一NH 一co 一NH 2 )能与Cu 2 + 产生紫红色的络合物,这一反应称为“双缩脲反应”。
蛋白质分子中的肽键也能与铜离子发生双缩脲反应,溶液紫红色的深浅与蛋白质含量在一定范围内符合朗伯一比尔定律,而与蛋白质的氨基酸组成及分子质量无关。
其可测定范围为1- l0mg 蛋白质,适用于精度要求不高的蛋白质含量测定。
Tris ,一些氨基酸,EDTA 等会干扰该测定。
三、仪器、试剂和材料1 .仪器(1) 分光光度计(2 )分析天平(3 )振荡机(4 )刻度吸管:1m1X2 ,5m1X2 ,10m1 X 1 (5 )具塞三角瓶:1OOml (6 )漏斗:13 个2 .试剂( 1 )双缩脲试剂:取硫酸铜(Cu S0 4 5H 2 O )1.5g 和酒石酸钾钠(NaKC 4 H 4 O 6 .4H 2 O ) 6.0g ,溶于500m1 蒸馏水中,在搅拌的同时加入300m1 10% NaOH 溶液,定容至1000 ml ,贮于涂石蜡的试剂瓶中。
( 2 )0.05mol/L 的NaOH 。
(3) 标准酪蛋自溶液:准确称取酪蛋白0.5g 溶于0.05mol/ L 的NaOH 溶液中,并定容至100m1, 即为5mg/m1 的标准溶液。
3 .材料小麦、玉米或其他谷物样品,风干、磨碎并通过100 目铜筛。
四、操作步骤1 .标准曲线的绘制取 6 支试管,编号,按下表加入试剂:震荡15min ,室温静置30min ,54Onm 比色,以蛋白质含量(mg )为横坐标,吸光度为纵坐标,绘制标准曲线。
2 .样品测定( 1 )将磨碎过筛的谷物样品在80 ℃下烘至恒重,取出置于燥器中冷却待用。
双缩脲检验蛋白质的原理在生物学中,蛋白质是一种非常重要的分子,它们是生命体中许多重要功能的基础。
因此,对蛋白质的分析和检测是生物学中非常重要的研究方向之一。
在蛋白质分析中,双缩脲法是一种广泛应用的方法,可以用于测定蛋白质的含量和纯度。
本文将介绍双缩脲法检验蛋白质的原理和应用。
一、双缩脲法的原理双缩脲法是一种典型的蛋白质检测方法,其原理基于蛋白质与双缩脲反应的特性。
蛋白质是由一系列氨基酸组成的大分子,氨基酸中含有一些可以与双缩脲发生反应的官能团。
当双缩脲与蛋白质反应时,会形成一种稳定的复合物,这个复合物可以被定量测定。
双缩脲法的具体操作步骤如下:1. 将待测试的样品与双缩脲混合,使其充分反应。
2. 将反应产物通过过滤等方法分离出来,去除未反应的双缩脲和其他杂质。
3. 通过紫外分光光度计等仪器对分离出的产物进行测定,以确定蛋白质的含量和纯度。
二、双缩脲法的应用双缩脲法可以应用于许多领域,例如:1. 生物医学研究:双缩脲法可以用于测定血清、尿液等生物样品中的蛋白质含量和纯度,从而为生物医学研究提供有价值的信息。
2. 食品科学:双缩脲法可以用于测定食品中的蛋白质含量和纯度,从而为食品科学研究提供有价值的信息。
3. 工业生产:双缩脲法可以应用于工业生产中的蛋白质分析,如酶制剂的生产等。
三、双缩脲法的优缺点双缩脲法作为一种常用的蛋白质检测方法,具有以下优点:1. 灵敏度高:双缩脲法可以检测到非常低浓度的蛋白质,具有很高的灵敏度。
2. 精确性高:双缩脲法可以精确地测定蛋白质的含量和纯度,避免了传统方法中的一些误差。
3. 可重复性好:双缩脲法可以重复测定同一样品,得到相似的结果,具有很好的可重复性。
然而,双缩脲法也存在一些缺点:1. 需要专业设备:双缩脲法需要使用紫外分光光度计等专业设备,增加了实验成本。
2. 对样品的要求高:双缩脲法对样品的要求比较高,需要样品纯度较高,否则会影响实验结果。
3. 不适用于所有蛋白质:由于不同的蛋白质与双缩脲反应的特性不同,双缩脲法不适用于所有蛋白质的分析。
双缩脲法测定蛋白质含量The manuscript was revised on the evening of 2021实验二十蛋白质含量测定——双缩脲法测定蛋白质含量一、实验目的学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
二、实验原理在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1~10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1.双缩脲试剂:取CuSO4·5H20.)和酒石酸钾钠.)以少量蒸馏水溶解,再加/L NaOH溶液300ml,KI ,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2.标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O 或%NaCl配制,酪蛋白用L NaOH配制。
[器材]1.试管:15×150mm 试管7只;2.1ml,5ml移液管;3.坐标纸;4.721分光光度计。
双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。
在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。
凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
测定范围为1~10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。
(二)试剂与器材1.试剂:(1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10mg/ml 的标准蛋白溶液,可用BSA浓度1mg/ml的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05N NaOH配制。
(2)双缩脲试剂:称以1.50克硫酸铜(CuSO4•5H2O)和6.0克酒石酸钾钠(KNaC4H4O6•4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。
此试剂可长期保存。
若贮存瓶中有黑色沉淀出现,则需要重新配制。
2.器材:可见光分光光度计、大试管15支、旋涡混合器等。
(三)操作方法1.标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。
充分摇匀后,在室温(20~25℃)下放置30分钟,于540nm处进行比色测定。
用未加蛋白质溶液的第一支试管作为空白对照液。