第五章 相 图 5
- 格式:doc
- 大小:6.57 MB
- 文档页数:6






第五章 相平衡一、本章基本要求1.掌握相、组分数和自由度的意义。
2.了解相律的推导过程及其在相图中的应用。
3.了解克劳修斯—克拉珀龙方程式的推导,掌握其在单组分两相平衡系统中的应用。
4.掌握各种相图中点、线及面的意义。
5.根据相图能够画出步冷曲线,或由一系列步冷曲线绘制相图.6.掌握杠杆规则在相图中的应用.7.结合二组分气液平衡相图,了解蒸馏与精馏的原理。
8.对三组分系统,了解水盐系统的应用,相图在萃取过程中的应用及分配定律的应用。
二、 基本公式和内容提要(一)基本公式相律的普遍形式:f K n =-Φ+ 克拉珀龙方程:mm d ln d V T H T p ∆∆= 克劳修斯—克拉珀龙方程的各种形式:微分式: 2m vap d ln d RT H T p ∆= vap m H ∆与温度无关或温度变化范围较小vap m H ∆可视为常数,定积分:vap m 211211ln ()H p p R T T ∆=- 不定积分式:vap mln H p C RT ∆=-+ 特鲁顿规则:K)J/(mol 88b mvap ⋅≈∆T H杠杆规则:以系统点为支点,与之对应的两个相点为作用点,有如下关系:1122()()n x x n x x -=-其中n 1 、n 2 分别表示平衡两相的摩尔数,x 、x 1、x 2分别表示系统的组成及其对应的平衡两相的组成。
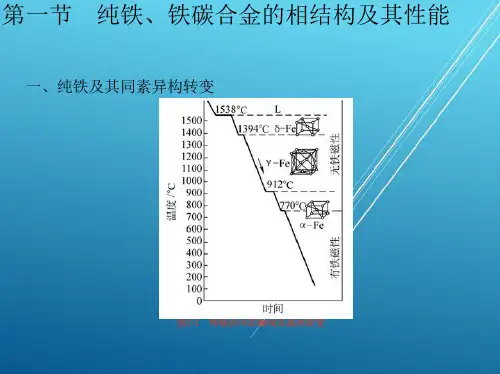
(二)内容提要1.单组分系统 单组分系统相律的一般表达式为:f =1-Φ+2=3-Φ图5-1 水的相图可见单组分系统最多只能有三相平衡共存,并且最多有两个独立变量,一般可选择温度和压力。
水的相图为单组分系统中的最简单相图之一。
图5—1中三条曲线将平面划分成固、液及气相三个区.单相区内f =2。
AB 、AD 和AE 分别表示气液、气固和固液两相平衡线。
两相共存时f =1.虚线AC表示应该结冰而未结冰的过冷水与水蒸气平衡共存。
A 点为三相点,这时f =0,水以气、液、固三相共存。


5.7 三元相图的应用举例5.7.1. CaO-Al2O3-SiO2系统三元相图具体的硅酸盐系统三元相图往往图形比较复杂。
我们首先以CaO-Al2O3-SiO2系统为例说明判读一张实际相图的步骤(见图5-42)。
本系统15个无变量点标于图中。
(1) 首先看系统中生成了多少化合物,找出各化合物的初晶区,根据化合物组成点与其初晶区的位置关系,判断化合物的性质。
本系统共有10个二元化合物,其中四个是一致熔化合物:CS、C2S、C12A7、A3S2,六个不一致熔化合物:C3S2、C3S、C3A、CA、CA2、CA6。
两个三元化合物都是一致熔的:CAS2(钙长石)及C2AS(铝方柱石)。
这些化合物的熔点或分解温度都标在相图上各自的组成点附近。
(2) 如果界线上未标明等温线,也未标明界线的温降方向,则需要运用连线规则,首先判明各界线的温度下降方向,再用切线规则判明界线性质。
然后,在界线上打上相应的单箭头或双箭头。
图5-42 CaO-Al2O3-SiO2系统三元相图(3) 运用重心规则判断各无变量点的性质。
如果在判断界线的性质时,已经画出了与各界线相对应的连线,则与无变量点相对应的副三角形已经自然形成了;如果先画出与各无变量点相对应的副三角形,则与各界线相对应的连线也会自然形成。
需要注意的是,不能随意在二个组成点之间连连线或在三个组成点间连副三角形。
如A3S2与CA组成点之间不能连连线,因为相图上这二个化合物的初晶区并无共同的界线,液相与这二个晶相并无平衡共存关系;在A3S2、CA、Al2O3的组成点间也不能连副三角形,因为相图上不存在这三个初晶区相交的无变量点,它们并无共同析晶的关系。
三元相图上的无变量点必定都处于三个初晶区,三条界线的交点,而不可能出现其它的形式,否则是违反相律的。
在一般情况下,有多少个无变量点,就可以将系统划分成多少个相应的副三角形(有时副三角形可能少于无变量点的数目)。
本系统共有15个无变量点,所以整个相图可以划分成15个副三角形。
在副三角形化以后,根据配料点所处的位置,运用三角形规则,就可以很容易地预先判断任一配料的结晶产物和结晶终点。
(4) 仔细观察相图上是否指示系统中存在晶型转变、液相分层或形成固溶体等现象。
本相图在富硅部分液相有分液区(2L),它是从CaO-SiO2二元的分液区发展而来的。
此外,在SiO2初晶区还有一条1470℃的方石英与鳞石英之间的晶型转变线。
CaO-Al2O3-SiO2系统与许多硅酸盐产品有关,其富钙部分相图与硅酸盐水泥生产关系尤为密切。
在这一部分相图上(图5-43),共有三个无变量点h、k、F,h、k是单转熔点,F 是低共熔点。
与这三个无变量点相对应的副三角形是CaO-C3A-C3S、C3S-C3A-C2S、C2S-C3A-C12A7。
用切线规则判断,CaO与C3S初晶区的界线在Z点从转熔界线变为共熔界线,而C3S与C2S初晶区的界线则在Y点从共熔性质变为转熔性质。
在Yk段,冷却时,L+C2S→C3S,即C2S被回吸,生成C3S。
但到达k点,L k+C3S→C2S+C3A,即C3S被回吸,生成C2S。
这个有趣的现象说明,系统从三相图进人四相图,是一种质的飞跃,而不是量的渐变,不能简单地从三相图关系类推四相图关系。
图5-43 CaO-Al2O3-SiO2系统的富钙部分相图我们以硅酸盐水泥熟料的典型配料,图上的点3为例,分析一下结晶路程。
将配料3加热到高温完全熔融(约2000℃),然后平衡冷却析晶,从熔体中首先析出C2S,液相组成沿C2S—3连线的延长线变化到C2S-C3S界线,开始从液相中同时析出C2S与C3S。
液相点随温度下降沿界线变化到Y点时,共析晶过程结束,转熔过程开始,C2S被回吸,析出C3S。
当系统冷却到k点温度(1455℃),液相点沿Yk界线到达k点,系统进入相图的无变量状态,L k液相与C3S晶体不断反应生成C2S与C3A。
由于配料点处于三角形C3S-C3A-C2S内,最后L k首先耗尽,结晶过程在k点结束。
获得的结晶产物是C3S、C3A、C2S。
下面我们就硅酸盐水泥生产中的配料、烧成及冷却,结合相图加以讨论,以提高利用相图分析实际问题的能力。
(1) 硅酸盐水泥的配料硅酸盐水泥熟料中含有C3S、C3A、C2S、C4AF四种矿物,相应的组成氧化物为CaO、SiO2、Al2O3、Fe2O3。
因为Fe2O3含量较低(2%~5%),可以合并入Al2O3一并考虑,C4AF则相应计入C3A,这样可以用CaO-Al2O3-SiO2三元来表示硅酸盐水泥的配料组成。
根据三角形规则,配料点落在何副三角形中,最后析晶产物便是这个副三角形三个角顶所表示的三种晶相。
图中1点配料处于三角形CaO-C3A-C3S中,平衡析晶产物中将有游离CaO。
2点配料处于三角形C2S-C3A-C12A7内,平衡析晶产物中将有C12A7,而没有C3S,前者的水硬活性很差,而后者是水泥中最重要的水硬矿物。
因此,这二种配料都不符合硅酸盐水泥熟料矿物组成的要求。
硅酸盐水泥生产中熟料的实际组成是含62%~67%CaO,20%~24% SiO2,6.5%~13%( Al2O3+Fe2O3),即在三角形C3S-C3A-C2S内的小圆圈内波动。
从相图的观点看,这个配料是合理的,因为最后析晶产物都是水硬性能良好的胶凝矿物。
以C3S-C3A-C2S 作为一个浓度三角形,根据配料点在此三角形中的位置,可以读出平衡析晶时水泥熟料中各矿物的含量。
(2) 烧成工艺上不可能将配料加热到2000℃左右完全熔融,然后平衡冷却析晶。
实际上是采用部分熔融的烧结法生产熟料。
因此,熟料矿物的形成并非完全来自液相析晶,固态组分之间的固相反应起着更为重要的作用。
为了加速组分间的固相反应,液相开始出现的温度及液相量至关重要。
如果是非常缓慢的平衡加热,则加热熔融过程应是缓慢冷却平衡析晶的逆过程,且在同一温度下,应具有完全相同的平衡状态。
以配料3为例,其结晶终点是k点,则平衡加热时应在k点出现与C3S、C3A、C2S平衡的L k液相,但C3S很难通过纯固相反应生成(如果很容易,水泥就不需要在1450℃的高温下烧成了),在1200℃以下组分间通过固相反应生成的是反应速度较快的C12A7、C3A、C2S。
因此,液相开始出现的温度并不是k点的1445℃,而是与这三个晶相图的F点温度1335℃(事实上,由于工艺配料中含有Na2O、K2O、MgO 等其它氧化物,液相开始出现的温度还要低,约1250℃)。
F点是一个低共熔点,加热时C2S+C12A7+C3A→L F,即C12A7、C3A、C2S低共熔形成F点液相。
当C12A7熔完后,液相组成将沿Fk界线变化,升温过程中,C3A与C2S继续熔入液相,液相量随温度升高不断增加。
系统中一旦形成液相,生成C3S的固相反应:C2S+CaO→C3S的反应速度即大大增加。
从某种意义上说,水泥烧成的核心问题是如何创造良好的动力学条件促成熟料中的主要矿物C3S 的大量生成。
C12A7是在非平衡加热过程中在系统中出现的一个非平衡相,但它的出现降低了液相开始形成的温度,对促进热力学平衡相C3S的大量生成是有帮助的。
(3) 冷却水泥配料达到烧成温度时所获得的液相量约20%~30%。
在随后的降温过程中,为了防止C3S分解及β-C2S发生晶型转化,工艺上采取快速冷却措施,而不是缓慢冷却,因而冷却过程也是不平衡的。
这种不平衡的冷却过程可以用下面二种模式来加以讨论。
①急冷:此时冷却速度超过熔体的临界冷却速度,液相完全失去析晶能力,全部转变为低温下的玻璃体。
②液相独立析晶:如果冷却速度不是快到使液相完全失去析晶能力,但也不是慢到足以使它能够和系统中其它晶相保持原有的相图关系,则此时液相犹如一个原始配料的高温熔体那样独自析晶,重新建立一个新的平衡体系,不受系统中已存在的其它晶相的制约。
这种现象特别容易发生在转熔点上的液相。
譬如在k点,L k+C3S→C2S+C3A,生成的C2S和C3A 往往包裹在C3S的表面,阻止了L k与C3S的进一步反应,此时液相将作为一个原始熔体开始独立析晶,沿kF界线析出C2S和C3A,到F点后又有C12A7析出。
因为k点在三角形C2S-C3A-C12A7内,独立析晶的析晶终点必在与其相应的无变量点F。
因此,在发生液相独立析晶时,尽管原始配料点处在三角形C3S-C3A-C2S内,其最终获得的产物中可能有四个晶相,除了C3S、C3A、C2S外,还可能有C12A7,这是由过程的非平衡性质造成的。
由于冷却时在k点发生L k+C3S→C2S+C3A的转熔过程,C3S要消耗,如在k点发生液相独立析晶或急冷成玻璃体,可以阻止这一转熔过程。
因此,对某些硅酸盐水泥配料,快速冷却反而可以增加熟料中C3S的含量。
必须指出,所谓急冷成玻璃体或发生液相独立析晶,这不过是非平衡冷却过程的二种理想化了的模式,实际过程很可能比这二种理想化模式更复杂,或者二者兼而有之。
5.7.2.K2O-Al2O3-SiO2系统三元相图本系统有五个二元化合物及四个三元化合物。
在这四个三元化合物的组成中,K2O含量与Al2O3含量的比值是相等的,因而它们排列在一条SiO2与二元化合物K2O·Al2O3的连线上(图5-44)。
三元化合物钾长石KAS6(图中的W点)是一个不一致熔化合物,其分解温度较低,在1150℃即分解为KAS4和富硅液相(液相量约为50%),因而是一种熔剂性矿物。
白榴石KAS4(图中的X点)是一致熔化合物,熔点1686℃。
钾霞石KAS2(图中的Y点)也是一个一致熔化合物,熔点1800℃。
化合物KAS(图中的Z点)的性质迄今未明,其初晶区的范围尚未能予以确定。
由于K2O高温下易于挥发等实验上的困难,本系统的相图不是完整的,仅给出了K2O含量在50%以下部分的相图。
图中的M点和E点是二个不同的无变量点。
M点处于莫来石、鳞石英和钾长石三个初晶区的交点,是一个三元无变量点,按照重心规则,它是一个低共熔点(985℃)。
M点左侧的E点是鳞石英和钾长石初晶区界线与相应的连线SiO2-W的交点,是该界线上的温度最高点,也是鳞石英与钾长石的低共熔点(990℃)。
图5-44 K2O-Al2O3-SiO2系统三元相图本系统与日用陶瓷及普通电瓷生产密切相关。
日用陶瓷及普通电瓷一般用粘土(高岭土)、长石和石英配料。
高岭土的主要矿物组成是高岭石Al2O3·2SiO2·2H2O,煅烧脱水后的化学组成为Al2O3·2SiO2,称为烧高岭。
图5-45上的D点即为烧高岭的组成点,D点不是相图上固有的一个二元化合物组成点,而是一个附加的辅加点,用以表示配料中的一种原料的组成。
根据重心原理,用高岭土、长石、石英三种原料配制的陶瓷坯料组成点必处于辅助三角形QWD(常被称为配料三角形)内,而在相图上则是处于副三角形QWm(常称为产物三角形)内。