用ImagePro Plus 分析免疫组化图片
- 格式:ppt
- 大小:19.41 MB
- 文档页数:83



免疫组化照片密度定量分析==转载链接/boyedlover/blog/item/a291eb1bf08dd3dfac6e7570.h tml2009-11-23 21:53Imagepro plus 应用实例2-免疫组化照片密度定量分析。
估计这是大家用得最多的,所以先讲这个了。
免疫组化技术现在是很成熟的方法,但是对免疫组化照片的分析并没有一个权威的说法。
现在可以查到无数篇应用图像分析来分析免疫组化的文献,但几乎没有哪一篇能详细地叙述分析的过程与方法。
首先,免疫组化的样品应该是用DAB对免疫组化产物染色,同时用苏木对细胞核进行复染。
镜下观察样品,细胞核被染上了蓝色,胞浆间有黄色(强阳性的地方会呈现棕黄色)。
居然经常能看到其他颜色的免疫组化照片,这肯定是样品制作过程中有了差错。
用肉眼观察免疫组化切片的结果只能是定性的,不准确的。
使用图像分析软件定量地(至少是半定量)对照片测量出一个数值来自然比用肉眼看更准确。
切片上阳性反应物量是由图片上黄色染色的深浅与面积一起表现的。
所以最终要测量的就是图片上黄色部分的累积光密度(IOD),这是个没有单位的相对数值。
就是把图片上每个黄色的象素点的强度值全部累加起来得到的值。
IOD除以一个适当的面积,就是一个平均光密度。
这个面积可以就是照片的面积,也可以是照片上一个组织区域的面积,或者是有黄色的区域的面积。
必须根据切片的实际情况来适当选择。
对于细胞核的免疫组化切片,在细胞核上,由于有蓝色复染,所以需要另一种分析方法。
将另作讲解。
这张照片曝光稍大。
但仍能表现出免疫组化的黄色染色与细胞核的蓝染。
在拍摄照片时,需要注意的地方是:1.所有的照片必须以同样的显微镜环境与拍摄条件来拍摄。
在拍摄照片时,要保持显微镜光源亮度的稳定,用同样的曝光时间拍摄照片。
在更换视野或切片时,除了对焦距这个操作外,其他所有的操作都不能有变化。
强阳性的样品就是暗的黄的,弱阳性的样品则亮一些,阴性样品就是一片白。


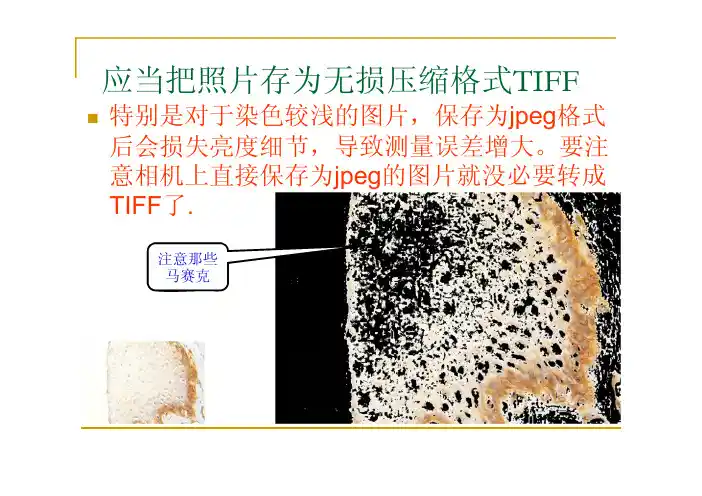
应当把照片存为无损压缩格式TIFF 特别是对于染色较浅的图片,保存为jpeg格式后会损失亮度细节,导致测量误差增大。
要注意相机上直接保存为jpeg的图片就没必要转成TIFF了.注意那些马赛克总结拍摄注意事项:调整显微镜光源亮度,足够白,足够亮。
调整相机曝光时间,使背景呈现白色。
灰度值最好能达到230以上。
确认相机未使用自动白平衡功能。
但可以使用手动校正白平衡功能校正背景色彩为纯白色。
使用同样的显微镜工作条件与相机工作条件一次拍摄完所有照片。
保存照片为TIFF格式。
3.2用Image-pro plus分析免疫组化图片与photoshop不同,image-pro plus是一个图片分析测量软件。
IPP的功能不是用来美化图片,如果照片效果不好或分析结果不理想,要从切片处理与拍摄过程上找原因,而不应试图通过对图片的修饰与处理来解决问题。
通过IPP的分析测量只应当准确地反映图片本身的真实测量数据。
3.2.1开始使用IPPIPP的程序界面是典型的windows风格。
它包含了最常用的一些windows程序的一些通用工具。
进入IPP后的第一件事就是打开一幅待分析的图片。
将分析图片信息保存到数据库中 在程序中保存分析图片过程信息是保存实验原始数据的基本原则,必须遵守。
将图片信息及图片分析过程及分析的信息存入IPP程序数据库是一种保存实验原始数据的操作。
要注意对同一张图片进行同样的操作,由于一些手动的操作无法准确地重复,所以会出现两次同样的测量得到有差异的结果的情况。
这也是保存测量结果的理由之一。
3.2.2.设置并保存测量条件设置光密度校正设置测量项目.设置分色选择参数3.2.2.1光密度校正方法校正光密度步骤小结.1.调出intensity carliberation窗口,点New按纽建立一个新的校正.2.选择std option density,此时可见到反向的校正曲线.3.选择背景空白值对应的灰度.相当于分光光度计中的调整100%透射.4.选择此校正为system carliberation,使之能应用于所有照片.3.2.2.2选择测量参数需要测量选择区域的面积(area)与累积光密度(IOD).在测量选项中也有平均光密度这一项,但它不适用于当前的测量,不能选用.选择面积时一般要设置一个过滤值,忽略掉面积过小的点,一般可设置为最小20象素.还要设置一下测量的显示选项(option),一般是选择显示选择区域填充红色.还有一些其他的设置.选择测量参数在分析免疫组化图象时,一般是测量选定的具有特定颜色的区域的面积与累积光密度(IOD)对免疫组化的显微照片,一般应分析它的平均光密度.即时IOD/area.根据图象的特点,要分别测量选择区域的IOD及area.对不同的组织照片,要使用不同的测量指标来进行比较。

免疫组化照片密度定量分析==转载链接/boyedlover/blog/item/a291eb1bf08dd3dfac6e7570.h tml2009-11-23 21:53Imagepro plus 应用实例2-免疫组化照片密度定量分析。
估计这是大家用得最多的,所以先讲这个了。
免疫组化技术现在是很成熟的方法,但是对免疫组化照片的分析并没有一个权威的说法。
现在可以查到无数篇应用图像分析来分析免疫组化的文献,但几乎没有哪一篇能详细地叙述分析的过程与方法。
首先,免疫组化的样品应该是用DAB对免疫组化产物染色,同时用苏木对细胞核进行复染。
镜下观察样品,细胞核被染上了蓝色,胞浆间有黄色(强阳性的地方会呈现棕黄色)。
居然经常能看到其他颜色的免疫组化照片,这肯定是样品制作过程中有了差错。
用肉眼观察免疫组化切片的结果只能是定性的,不准确的。
使用图像分析软件定量地(至少是半定量)对照片测量出一个数值来自然比用肉眼看更准确。
切片上阳性反应物量是由图片上黄色染色的深浅与面积一起表现的。
所以最终要测量的就是图片上黄色部分的累积光密度(IOD),这是个没有单位的相对数值。
就是把图片上每个黄色的象素点的强度值全部累加起来得到的值。
IOD除以一个适当的面积,就是一个平均光密度。
这个面积可以就是照片的面积,也可以是照片上一个组织区域的面积,或者是有黄色的区域的面积。
必须根据切片的实际情况来适当选择。
对于细胞核的免疫组化切片,在细胞核上,由于有蓝色复染,所以需要另一种分析方法。
将另作讲解。
这张照片曝光稍大。
但仍能表现出免疫组化的黄色染色与细胞核的蓝染。
在拍摄照片时,需要注意的地方是:1.所有的照片必须以同样的显微镜环境与拍摄条件来拍摄。
在拍摄照片时,要保持显微镜光源亮度的稳定,用同样的曝光时间拍摄照片。
在更换视野或切片时,除了对焦距这个操作外,其他所有的操作都不能有变化。
强阳性的样品就是暗的黄的,弱阳性的样品则亮一些,阴性样品就是一片白。



手把手教你使用Imagepro-Plus(七)——图象分析策略2006-08-03 10:26文章来源: 丁香园点击次数:1127有了图象分析软件,该怎么应用它来分析工作中的图片呢?这就涉及到图片分析的策略。
这并没有一个权威的或者是已经有定论的方法。
因此我在这里只能讲讲我自己作过的一些显微镜图片分析处理的方法。
从我自己的体会来说,几乎每一项分析其策略都不同。
我也不敢说自己的作法就是正确的。
也没有多少文献可供参考。
比如免疫组化染色图片的图象分析方法,查过一些文献,提到图片的数字分析处理时往往就几句话。
有许多还是用图象分析仪测量的。
我怀疑他们自己也没弄明白具体的分析策略是什么。
有人是这样作的:使用正圆形AOI工具,在一张免疫组化图片上随机选取五个位置,分别测量这五个位置上这个正圆形区域的平均光密度,得到一个平均光密度值与标准差。
我认为这样作是错误的。
因为这个平均光密度值的真值就是这张图片整个的平均光密度值。
因此只要选一个矩形AOI,大小就是这张图片的尺寸,其平均光密度值就是刚才那个平均值的真值,没有标准差。
要作好免疫组化图片的数字分析,从拍摄显微镜照片时开始就要考虑操作细节了。
作切片时要保证各个切片条件的一致就不说了,在使用数码相机拍摄切片照片时得注意什么呢?1.显微镜的亮度要前后保持一致。
这包括电源的电压要稳定,最好给显微镜加稳压电源,光源亮度调节在拍摄一组照片的过程中不能动,聚光镜也不能调。
2.数码相机不能用自动调节设置,全部用手动设置。
包括曝光时间、变焦、光圈。
还有一个很多人都想不到的地方:自动白平衡功能要关掉。
前面的照片中有几张看上去背景是浅蓝色的,这就是数码相机的自动白平衡功能在起作用。
因为整个画面都是黄色的染色,相机就会认为画面色温偏低,要进行一下较正,给加点蓝色吧。
浅蓝色背景其光密度与浅黄色的阳性区域差不多,这样就给准确测量光密度带来了更大的误差。
3.拍摄荧光照片时自动曝光所带来的影响更大。
⽤Image-pro_plus(IPP)分析免疫组化图⽚⽤Image-pro plus(IPP)分析免疫组化图⽚免疫组化的定量研究的理论上是可⾏的,但是实际应⽤起来影响因素太多。
国外基本上没有对免疫组化定量的,最多只是半定量研究。
建议只⽤免疫组化做定性和定位研究。
但是⽬前关于免疫组化蛋⽩定量分析也⽐较多⽽且使结果更加直观,简单介绍⼀下使⽤⽅法和注意事项,共同学习。
⽤IPP分析免疫组化图⽚过程选取图⽚上具有染料⾊调的区域(AOI,area of interesting)?测量该区域的IOD。
选择并测量有效统计区域的⾯积计算选择区域内的光密度平均值IOD/area(density mean)计算同⼀实验组切⽚各照⽚的平均及标准差。
⽤统计学⽅法分析各实验组的平均density mean之间是否有显著性差异。
拍照注意事项:正确调整显微镜光源为⽇光⾊温的⽩⾊光。
此时是加蓝⾊滤光⽚,灯丝电压为10V左右。
⼀般的显微镜上都会有指⽰的。
此时的镜下视野会感觉明亮得有点刺眼。
不能通过调整光圈的⽅法减低亮度,这会影响到图象的清晰度。
光圈与聚光镜要按照柯勒⽅法调整以保证照⽚的清晰.不能加过⼤的灰度镜减低亮度。
⽤25%的灰度滤光⽚还⾏。
6%的灰度滤光⽚会导致⾊彩失真。
如果照明光源不⽩,有偏⾊,将直接影响到照⽚⾊彩,从⽽使得测量结果不准确。
为保证显微镜光源的稳定⼀致,所有照⽚应该⼀次拍摄完成。
不能分数次拍摄。
若能给显微镜加上稳压电源就更好了。
这能保证显微镜光源亮度的稳定。
要把相机曝光时间控制到使视野中空⽩的地⽅呈现纯亮的⽩⾊。
拍摄出的照⽚上,没有组织的空⽩处的背景灰度值应达到230左右可以使⽤图象分析软件测量⼀下空⽩处的背景灰度值。
低于230的背景灰度值很容易产⽣⾊彩的偏离,会影响到图像分析数值的偏差。
把空⽩灰度值调到230相当于在分光光度计上调节100%透射。
免疫组化阳性细胞计数⽅法:image pro plus 6.0软件1.打开图⽚,点击count and measure objects 图标2.点击measure3.点击select measurement4.选中area。
Imageproplus的主要用途是分析测量图象。
1.基本操作2.AOI技巧3.AOI技巧续4.编制宏操作5.计数6.校正标尺7.几何测量8.图象分析策略9.其他有趣的功能10。
讨厌的光密度11.免疫组化光密度图片的测量12.免疫组化光密度图片的自动测量13.荧光照片的测量14.双染料染色照片的合成方法打开ipp后的界面是这样的,该从何处下手呢?这张照片中的黄色部分是免疫组化染色的阳性表达成分。
处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的"量"。
对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,呈现出浅蓝色,是为背景。
所以首先要把图片中呈现黄色的区域给挑选出来,然后才是测量这些挑出来的区域的各种测量参数,如面积、平均半径、周长、光密度等等。
这部分需要挑出来进行测量的区域是我们最感兴趣的地方,叫作AOI(area of interest)。
AOI是IPP中最有用最重要的概念。
然而在选择AOI之前必须转换图象intensity格式。
校正光密度单位的操作要在打开第一张图片后立即进行。
将光密度单位设定为system之后就不必再对后面的每一张照片都进行光密度校正了。
在默认的intensity格式中,是图片灰度,越黑数值越小,越白数值越大。
而实际上我们测量的染色强度是光密度,染色越深,光密度值越大。
如果不进行光密度单位的转换,测量的数值将完全是错误的。
转换光密度单位的方法如下:点击:measure--carliberation--intensity,调出intensity校正窗口。
然后在窗口中点new 按纽,再点一下下面的std optical density选项,这时可以看到窗口中的直线变成了反向的曲线。
然后还要点一下最上面的system按纽。
最后点close关闭窗口。
这样就把程序系统的灰度单位转换成了光密度单位。