脑核蛋白抽提
- 格式:pdf
- 大小:11.96 KB
- 文档页数:2

蛋白提取概念
蛋白提取是指从生物组织或细胞中提取蛋白质的过程。
蛋白质是生物体内功能最为重要的分子之一,在许多生物研究和应用领域具有重要作用。
蛋白提取的目的是分离和获取特定的蛋白质样品,以便后续的研究和应用。
蛋白提取通常涉及以下步骤:
1. 组织或细胞破碎:将生物样品经过破碎处理,以释放蛋白质。
2. 蛋白溶解:将破碎的样品转移到适当的缓冲液中,以保持蛋白质的稳定性和活性。
3. 细胞核和细胞膜的去除:通过离心等方法去除细胞碎片、细胞核和细胞膜等非蛋白质杂质。
4. 蛋白质的分离和富集:借助各种技术,如电泳、层析、过滤等,将目标蛋白质与其他蛋白质分离。
5. 蛋白质的纯化:采用离子交换、亲和层析、凝胶过滤等技术,进一步净化和纯化蛋白质。
6. 蛋白质的检测和定量:利用光谱法、酶联免疫吸附测定等方法,确定蛋白质的含量和质量。
蛋白提取技术在生物医学研究、药物开发、基因工程、食品科学等领域具有广泛的应用。
通过蛋白提取,科研人员可以获得不同细胞或组织中的特定蛋白质样品,从而研究其结构、功能和相互作用,以及开发新的治疗方法和药物。

组织蛋白提取1.取组织:小鼠麻醉,断颈处死,将新鲜脑组织取出于冰上,正形,将组织取下置于事先标记并称重的1.5ml EP 管内,称重记录,后置于冰上,移至-80℃冰箱内。
(速度要快)2.蛋白研磨提取:准备研磨棒、冰、电动研磨器、向盛有组织的EP管内按100ul/4mg加入裂解液(lysis : PMSF=99:1),用电动研磨器进行充分的组织研磨,研磨完毕置于冰上裂解30min。
12000rpm、4℃离心20min。
将上清液吸出于标记好的新EP管内。
3、蛋白浓度测定:取96孔板,每孔加220ul体系(19ul 0.01M PBS+1ul 蛋白样+200ul BCA 工作液)液体添加顺序由少到多。
待测样设置附孔,标准样不需设附孔。
其余未用到的孔每孔加200ul 0.01M PBS 防止液体蒸发,加完液体后盖盖,并用锡箔纸包好(避光),置于37℃温箱内孵育半小时。
半小时后取出96孔板至503测定浓度。
4、软件操作:开机→打开软件→将96孔板放入机器内→震荡(防止有气泡,影响测定结果)→“setting”→“wavelength”562→”read”→选中结果并复制→在电脑桌面新建Excel表格,粘贴测定结果→将表格保存至E盘并拷贝至U盘。
5、数据分析:选中标准品数值,插入标准曲线,显示公式及R^2值。
将样孔吸光度值(y)代入公式计算出浓度(x),检查浓度均一情况,选取除极值外的较低浓度值标红,作为参考。
20ng/c得出原液单次上样体积v1,以最大值(极值除外)为基准,计算得出配平蛋白浓度需加入的稀释液体积v2。
根据需要的上样次数n,计算各样本需吸取的体积V1=n*v1;根据需要的上样次数n,计算稀释液体积V2=n*v2。
6、蛋白浓度配平新标记一套EP 管,每管吸取相应的原液和稀释液。
按V(稀释后蛋白液):V loading=4:1加入5× loading液并混匀。
将混匀后的蛋白样按顺序放入EP管盒内,冻存至 -80℃冰箱内备用。

提取细胞核蛋白的步骤:1.向培养细胞的平皿中加入少量(保证在1.5ml TUBE内能放下)冷PBS(或1*D-Hanks)2.,用细胞刮刀尽可能多的刮下细胞,收集到1.5ml的离心管中。
在预冷的离心机中,4度,1000rcf,1-3分钟,沉降细胞。
为尽可能多的获得细胞,可将一次离心后的上清再重复刮细胞一次;2. 将细胞重悬于cell lysis buffer中(加入体积106细胞/200uL,体积估计方法还是没确定,should be sufficient; 一般就是一个10cm平皿加1ml cell lysis buffer),添加蛋白酶抑制剂;先破细胞膜,得到细胞核(没有用B DOUNCE);冰上放置(不震荡,可偶尔用枪轻吹)30分钟至1小时(此时核膜没有破,有核染色为证),充分裂解;cell lysis buffer:5mM PIPES pH 8.0 85mM KCL, 0.5% NP40, 1% protein inhibitor;3. 4度,1000rcf,20分钟,上清为胞质蛋白(蛋白浓度比较低,如需要检测,建议先浓缩一下),沉淀为细胞核;此时可以将沉淀冻存于-70℃;4. 将沉淀重悬于100-200 ul nucleai lysis buffer(体积视目的蛋白表达丰度而定,一般50-100ul)中,添加蛋白酶抑制剂,冰上放置30分钟至1小时(每5分钟震荡一次),充分裂解;可以观察到沉淀慢慢消失,溶液变澄清;nucleai lysis buffer:成分同SDS lysis buffer;50mM Tris-Cl pH 8.1, 10mM EDTA, 1% SDS, 1% protein inhibitor;5. 四度,最大转速离心,10分钟以上(尽可能沉淀完全),上清即为细胞核蛋白;。

不同组织的蛋白提取方法•相关推荐不同组织的蛋白提取方法不同组织的蛋白提取方法一、植物组织蛋白质提取方法1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。
2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。
3、用离心机离心8000rpm40min4℃或11100rpm20min4℃4、提取上清夜,样品制备完成。
蛋白质提取液:300ml1、1Mtris-HCl(PH8)45ml2、甘油(Glycerol)75ml3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone6g这种方法针对SDS-PAGE,垂直板电泳!或者用三氯醋酸—丙酮沉淀法,离子浓度小的1、在液氮中研磨叶片2、加入样品体积3-204℃8000rpm以上13、的β-巯基乙醇),摇匀后离心(4℃8000rpm以上14、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000r pm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。
5、用Brandford法定量蛋白,然后可分装放入-80℃备用。
药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。
二、组织:肠黏膜应用TRIPURE提取蛋白质步骤:含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量)倒转混匀,置室温10min离心:12000g,10min,4度,弃上清加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量)振荡,置室温20min离心:7500g,5min,4度,弃上清重复0.3M盐酸胍/95%乙醇步2次沉淀中加入100%乙醇2ml充分振荡混匀,置室温20min离心:7500g,5min,4度,弃上清吹干沉淀1%SDS溶解沉淀离心:10000g,10min,4度取上清-20度保存(或可直接用于BLOT存在的问题:加入1%SDS4度离心后又多了白色沉定,SDS左右。

Thermo-Scientific-NE-PER核蛋白-胞浆蛋白抽提试剂盒描述Thermo Scientific NE-PER核蛋白-胞浆蛋白抽提试剂盒提供了高效的细胞裂解和抽提方法,可在两个小时之内完成胞浆蛋白与核蛋白的分离操作。
NE-PER核蛋白-胞浆蛋白抽提试剂盒的特性:• 快速—在两个小时之内获得胞核与胞浆内的可溶性蛋白组分• 可靠—NE-PER试剂盒已经被950篇以上的发表文献引用• 通用–适用于培养细胞或组织(仅适用于新鲜样本)的核蛋白抽提• 可扩展—两种规格试剂盒,满足从细胞和组织中抽提样本的应用需求• 方便—操作简单,无需超速梯度离心• 兼容性好—获得样本适合于多种下游应用,包括免疫印迹、凝胶迁移分析、蛋白分析、报告基因分析以及酶活性分析NE-PER试剂盒为用户提供了高效的核蛋白抽提方法,用户只需拥有台式微量离心机、离心管和移液器,进行简单的分步式细胞裂解及核蛋白与胞浆蛋白离心分离即可。
NE-PER试剂盒能够高效地将胞浆蛋白与核蛋白溶解和分离为不同组分,交叉污染以及基因组DNA/mRNA 的干扰均降到了最低。
一旦经过脱盐或稀释,分离后的蛋白即可用于免疫分析和蛋白相互作用实验,如迁移率分析(EMSA)、免疫共沉淀(Co-IP)和拉下实验。
分离胞核和制备核蛋白抽提物的方法很多,但大多数制备核蛋白抽提物的制备方法都很耗时,并需要机械匀浆、冻融循环、反复离心或透析,而这些都可能影响核蛋白的完整性。
NE-PER 核蛋白-胞浆蛋白抽提试剂盒使用了基于试剂的分离方案,能够分步裂解细胞并从胞浆中分离出完整的细胞核,然后再从基因组DNA与mRNA中抽提核蛋白。
这一温和的过程可在两小时之内完成,且使用培养细胞时仅需标准的桌台式离心机即可。
此外,用户还可以从细胞培养物或组织样本中分离得到具有活性的核蛋白与胞浆蛋白。
本试剂盒能够从两百万个细胞中提出200至500µg胞浆蛋白和100至200µg的核蛋白(浓度为1mg/mL)。

核蛋白co-ip实验步骤核蛋白共免疫沉淀(co-immunoprecipitation,简称Co-IP)是一种常用的生物化学实验技术,用于研究蛋白质相互作用和复合物的组成。
这篇文章将详细介绍核蛋白Co-IP实验的步骤,并一步一步回答。
第一步:制备样品和抗体在进行核蛋白Co-IP实验之前,首先需准备样品和相应的抗体。
样品可以是细胞提取物或组织提取物。
制备提取物的方法取决于研究对象和研究目的。
1. 细胞提取:培养细胞并使用细胞裂解缓冲液(通常包含盐、洗涤剂和其他增效剂)裂解细胞膜并释放细胞质和核质提取物。
2. 组织提取:将组织样品切碎,然后使用相同的细胞裂解缓冲液使组织细胞释放其细胞质和核质提取物。
抗体的选择很重要,应使用特异性高的抗体,以确保Co-IP的特异性和准确性。
第二步:预清洗蛋白质A/G琼脂糖磁珠蛋白质A/G琼脂糖磁珠是一种常用于Co-IP实验的材料,能够特异地结合免疫球蛋白G(IgG)和免疫球蛋白A(IgA)。
在开始Co-IP实验前,需要预清洗蛋白质A/G琼脂糖磁珠。
1. 将蛋白质A/G琼脂糖磁珠分配到各个离心管中,每个离心管中加入适量的洗涤缓冲液(通常为PBS或TBST)。
2. 用转磁器将蛋白质A/G琼脂糖磁珠与洗涤缓冲液充分混合,然后将管离心。
3. 弃去上清液,再次加入洗涤缓冲液,重复该步骤至少三次,以确保蛋白质A/G琼脂糖磁珠彻底清洗。
第三步:共免疫沉淀共免疫沉淀实验重点在于使用抗体结合目标蛋白质,然后将这些复合物沉淀下来。
以下是核蛋白Co-IP的步骤:1. 将预清洗的蛋白质A/G琼脂糖磁珠分配到离心管中,再加入适量的洗涤缓冲液,离心去除上清液。
2. 使用适量的抗体将其与蛋白质A/G琼脂糖磁珠结合,在室温下轻轻摇晃,使抗体充分结合到磁珠上。
3. 将待测样品加入配有抗体的蛋白质A/G琼脂糖磁珠并在常温下摇晃,使目标蛋白质结合到抗体上。
这个步骤可以持续数小时至一夜,以确保适当的结合。
4. 使用磁力架,将含有抗体-样品复合物的磁珠沉淀到管底。

核蛋白检测方法嘿,咱今儿就来聊聊核蛋白检测方法这档子事儿。
你说核蛋白检测,这可不是啥小事儿啊!先说说免疫沉淀法吧,这就好比是在一个大部队里精准找出你要的那几个特定的“士兵”。
通过特定的抗体,把核蛋白从那一堆复杂的混合物里给拽出来,是不是挺神奇的?这方法就像个神奇的“抓手”,一抓一个准儿。
还有凝胶电泳法呢,就好像是让核蛋白们来一场赛跑,不同的核蛋白跑起来速度不一样,咱就能根据它们跑的位置和样子来识别它们啦。
这就像是在运动会上,通过选手们跑步的表现来区分他们一样。
再讲讲免疫印迹法呀,它就像是给核蛋白拍个特写照片,然后对照着“照片库”去确认身份。
是不是很形象呢?通过这种方式,能清楚地看到核蛋白的特征,然后准确判断。
那 Western blot 呢,这可是个厉害的角色。
它能把核蛋白从一堆里面挑出来,然后给它染上颜色,让它在那里闪闪发光,一眼就能瞧见。
就像在黑夜里,有个明亮的信号灯,一下子就找到了目标。
荧光显微镜检测呢,就如同给核蛋白装上了小彩灯,让它们在显微镜下变得格外显眼。
你能清楚地看到它们在哪里发光,在干什么。
每种检测方法都有它的独特之处啊,就像每个人都有自己的性格一样。
有的方法精准,有的方法快速,有的方法能提供更详细的信息。
那咱在选择的时候可得好好琢磨琢磨,到底哪种方法适合咱要研究的那个核蛋白呢?咱得像个聪明的猎手,选择最合适的武器去捕捉我们想要的猎物呀!这些检测方法不就是我们探索核蛋白世界的钥匙吗?它们打开了那扇神秘的大门,让我们能更深入地了解核蛋白的奥秘。
没有它们,我们怎么能知道核蛋白在细胞里都干了些啥,怎么发挥作用的呢?咱可不能小瞧了这些检测方法啊,它们可是科学家们的得力助手呢!它们帮助我们解开一个又一个关于核蛋白的谜团,让我们对生命的奥秘有了更深的认识。
所以啊,咱得好好重视这些检测方法,把它们用好了,那可真是能发现好多神奇的东西呢!你说是不是呢?这核蛋白检测方法,真的是太重要啦!。

介绍核蛋白抽提试剂可以从哺乳动物培养的细胞或组织中逐步分离和制备细胞质和细胞核提取物。
不变性的活性蛋白在不到两小时内纯化。
在细胞颗粒中加入前两种试剂会导致细胞膜破裂和细胞质内容的释放。
用离心法从细胞质提取液中提取完整细胞核后,用第三试剂从细胞核中提取蛋白质。
用这种产品提取的核和细胞质组分提取物一般污染率不到10%,这对于大多数涉及核提取物的实验来说是足够的纯度核抽提物比起全细胞裂解物通常更适合于进行基因调控研究。
全细胞裂解液中的细胞成分对核蛋白的相互作用和稳定性有不利影响,核蛋白更集中于核提取物,而非全细胞裂解物。
核提取物/试剂与多种下游应用兼容(包括Western blotting,BCA蛋白定量分析(产品编号23225),凝胶移位(产品编号20148),报告基因和酶活性的测定)重要产品信息●此试剂盒适用于新鲜(未冷冻)的细胞或组织样品。
使用蛋白酶抑制剂维持提取物的完整性和功能。
使用前,将蛋白酶抑制剂加入CRE I和NER浓缩物中以减少试剂稀释(浓缩蛋白酶抑制剂eg.100x)。
不需要添加蛋白酶抑制剂到CER II。
●如果在随后应用中需要大量的核提取物或出现问题,透析前用核提取物清除多余的盐。
试剂盒中的洗涤剂是不可透析的,但它主要是在细胞质中。
使用Thermo Scientific™Slide-A-Lyzer™小型透析装置进行透析。
另外,无回收蛋白或条块分割的不利影响下,NER 用于提取液的体积可以减小2倍可以得到更集中的核提取物。
●在4°C条件下执行所有离心步骤,保持细胞样本和提取物在冰上。
额外所需材料●蛋白酶抑制剂●磷酸盐缓冲盐水(PBS)细胞培养制备●贴壁细胞,用胰蛋白酶-EDTA消化,然后在500g离心5分钟。
对于悬浮细胞,通过离心在500G 5分钟收获。
●用PBS重悬细胞颗粒冲洗细胞●1-10×106细胞转移至1.5ml离心管,并在500G 离心2-3分钟●使用吸管小心地去除和丢弃上清液,使细胞颗粒尽可能干燥。

细胞核蛋白分离提取方法
1.将培养皿内的培养基倒去,用预冷的1xPBS洗两遍后,每盘加入
2.5ml1xPBS,放在冰上;
2.用细胞刮讲细胞刮下,移至15ml离心管,再用2.5ml1xPBS清洗培养皿一次,共5ml;
3.1500g离心5min,倒去上清,移入1.5ml离心管中,再每管加入800ul1xPBS清洗一次;
4.每管加入低渗bufferA(1M HEPES,1M KCL,100mMEDTA,100mM EGTA)(buffer:蛋白酶抑制剂:1M DTT=1000:10:1)200ul(原500ul),冰上静置15min裂解;
5.每管加入25ul 10%NP-40,涡旋10s;
6.1500g4℃离心10min,上清为细胞质蛋白,收集至新的离心管中;
7.每管加入500ul bufferA清洗沉淀,离心速度约2000g;
8.每管加入RIPA buffer(buffer:蛋白酶抑制剂:1M DTT=1000:10:1)50ul,吹散沉淀颗粒,4℃震荡15min,其间每隔5min重新吹散一次,使其充分裂解;
9.14000rpm4℃离心15min,上清为细胞核蛋白,收集至新离心管中。
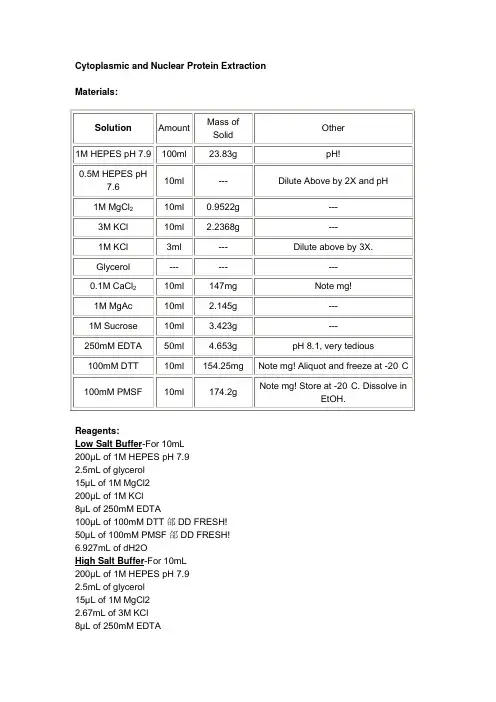
Cytoplasmic and Nuclear Protein Extraction Materials:Reagents:Low Salt Buffer-For 10mL200µL of 1M HEPES pH 7.92.5mL of glycerol15µL of 1M MgCl2200µL of 1M KCl8µL of 250mM EDTA100µL of 100mM DTT郃DD FRESH!50µL of 100mM PMSF郃DD FRESH!6.927mL of dH2OHigh Salt Buffer-For 10mL200µL of 1M HEPES pH 7.92.5mL of glycerol15µL of 1M MgCl22.67mL of 3M KCl8µL of 250mM EDTA100µL of NP-40100µL of 100mM DTT郃DD FRESH!50µL of 100mM PMSF郃DD FRESH!4.357mL of dH2OSucrose Buffer w/o NP-40-For 10mL3.2mL of 1M Sucrose300µL of 0.1M CaCl220µL of 1M MgAc4µL of 250mM EDTA100µL of 100mM DTT郃DD FRESH!50µL of 100mM PMSF郃DD FRESH!6.326mL of dH2OSucrose Buffer w/ NP-40-For 1mL1mL of Sucrose Buffer w/o NP-405µL of NP-40Procedure:PERFORM ALL STEPS ON ICE!1. Collect cells from 1 confluent T75 (scraping or trypsinizing, doesn抰matter).2. Wash cells once with ice-cold PBS and repellet.3. Resuspend cells in 1mL ice-cold PBS and transfer to an eppendorf tube.4. Pellet cells at 200xg for 5 minutes.5. Resuspend cells in 200mL Sucrose buffer with NP-40 by gently pipetting with a 1000mL tip, and incubate on ice for 5 minutes to lyse.6. Pellet nuclei by centrifugation at 1500xg for 5 minutes and transfer the supernatant (cytoplasmic fraction) to a new tube. (NOTE: It抯best to leave the last 50mL at the bottom of the tube out of your cytoplasmic fraction, this reduces the likelihood of contaminating the cytoplasmic fraction with nuclear protein.)7. Gently resuspend the nuclei in 1mL Sucrose buffer without NP-40.8. Pellet the nuclei at 1500xg for 5 minutes. Discard supernatant. This and the above step removes leftover cytoplasmic contaminants using a sucrose cushion.9. Gently resuspend nuclei in 50mL LOW salt buffer (nuclei should be semi-granular, and intact).10. Add 0.2X volume HIGH salt buffer and gently flick tube.11. Continue adding 0.2X HIGH salt buffer and gently flicking until 1X volume has been added OR the nuclei begin to shrink and viscosity increases (it generally takes me about 0.4X volume with HeLa cells).12. Incubate tubes on the rotary platform in the cold room for 20 minutes13. Centrifuge at 13000xg for 15 minutes.14. Retain supernatant (nuclear fraction).QC Controls: β-Tubulin and PARP Western Blots on both nuclear and cytosolic samplesNOTE: This method is low-salt, so it does not disrupt cytoskeletal interactions, which means you WILL pellet most if not all of any cytoskeletal proteins. This includes nuclear cytoskeletal proteins.HELA CELL NUCLEI PREPI. Solutions:a. Chelsky Buffer (200ml)0.01M Tris-HCl0.01M NaCl0.003M MgCl20.03M Sucrose (mw. 342.3 g/mole)pH to 7.0 and bring up to 200ml.b. NP-40 Buffer100ml of Chelsky Buffer500ul of NP-40 detergentc. Cacl2 Buffer100ml of Chelsky Buffer1.0ml 100x stock CaCl2 sol'n (10mM)d. Buffer C20mM Tris-HCl pH 7.920% glycerol0.1M KCl0.2mM EDTApH to 7.9II. Procedure:a. Cell collection:Plate Helas on 150mm plates on day 1. (1 x107 cells yields about 1 mg of total cellular protein) Approximately 32-150mm plates.Trypsinize every plate on day 2-3 (am).Bring each plate up in 5ml of media, and count the total number of cells\ml. Record the volume of cell suspension.b. Cell treatment:Note: Everything (buffers, cells, centrifuge) must be kept on ice (4oC) throughout this entire procedure, to reduce protein degradation.Note: Save the supernatant from each wash to keep track of protein if lost.Wash the Hela cells 2x with 25 ml of cold PBS per tube in clinical centrifuge setting #3 in cold room(4oC).Resuspend cell pellets in 2.0 ml of NP-40 Buffer, spin in HB-40 rotor at 3000rpm (1500xg) for 10mins,remove supernatant and resuspend as above.Repeat NP-40 wash step above.Remove supernatant and resuspend pellet into 2.0ml of CaCl2 Buffer. Spin in HB-40 rotor at 3000 rpm (1500xg) for 10mins, remove supernanat and resuspend as above. Repeat CaCl2 wash step.Resuspend pellet from second CaCl2 wash step into 2.0 ml of Buffer C, depending on how much protein was collected (use 1ml/number of cells) Spin balanced tubes in SS34 rotor at 14,500 rpm(25,000xg) for 30mins.Collect supernatant (nucleoplasm), resuspend pellet (nuclear envelope) in Buffer C and homogenize to get into solution.Aliquot into cryovials and freeze at -70oC.Preparation of Nuclear Extracts for Gel Shifts and Westerns BlotsThe following protocol is optimized for about 107cells (near confluent 10 cm plate). NOTE: ALL COMPONENTS (BUFFERS, PROTEASE INHIBITORS, ETC) MUST BE KEPT ON ICE DURING THE ENTIRE PROCEDURE.1. 1. Wash plates with PBS two times.2. 2. Prepare 5 ml of Buffer A in a 15 ml conical c’fuge tube, and add the fol lowing:-5 ul of each protease inhibitor (leupeptin, PMSF, aprotinin, pepstatin, and DTT)-200 ul of 10% IGEPAL.Add 0.5 ml of this preparation directly to each plate, and wait 10 min. at room temp.3. 3. Scrape cells with NEW sterile scraper, then pipet up and down with P1000 severaltimes to disrupt cell clumps. NOTE: you will have nearly 1 ml of lysate at this point.4. 4. Transfer this lysate to a 1.5 microcentrifuge tube, place on ice.5. 5. Centrifuge at 4 C at top speed (15000 x g) for 3 min.6. 6. Place tubes on ice.7.7. Save supernatant (cytosolic fraction) for luciferase/ß-gal assay, if desired. Otherwise,discard the supernatant.8.8. Prepare 1 ml of Buffer B in a 1.5 ml eppendorf, and add 1 ul of each protease inhibitoras above, but this time DO NOT add IGEPAL. Add 150 ml of this buffer to each tube, and resuspend pellet by pipeting up and down with a P200. Place on ice.9.9. Shake vigorously at 4 C for 2h.10.10. Centrifuge at 4 C, top speed for 5 min. Measure Bradford (protein) concentration using5 ul of each sample, then aliquot 15 ul aliquots into prechilled 0.5 ml prelabeledmicrocentrifuge tubes, freeze in liquid nitrogen, and store in –80 C freezer.Buffer A:10 mM HEPES, pH 7.910 mM KCl0.10.1 mM EDTAAdd just before use: 1mM DTT, 0.5 mM PMSF, 5 ul of 10 ug/ul of aprotinin, leupeptin, and pepstatin A to 5 ml of buffer.Buffer B:20 mM HEPES, pH 7.90.4 M NaCl1 mM EDTA10% GlycerolAdd just before use: DTT, PMSF, aprotinin, leupeptin, pepstatin A as above.Nuclear and Cytoplasmic ExtractsMaterials:• Endonuclease (Sigma E8263)• 10% Triton X or IGEPAL 630• Phosphatase inhibitor Solution• Phosphate buffered Saline (PBS), pH 7.4• Solution A (see recipe at the end of prot ocol)• Solution B (see recipe at the end of protocol)• Solution C (see recipe at the end of protocol)• DeStreak Rehydration Solution (Amersham-Biosciences)Method:1. Wash cell plate with ice-cold PBS. Add 1ml ice-cold PBS with Phosphatase inhibitor solution per 10cm plate and scrape cells. Transfer to an ice-cold Eppendorf tube.2. Pellet cells at 1000 X g for 2 minutes. Remove supernatant.3. Add Solution A without resuspending the pellet at a 1:1 (v/v) ratio to that of the cellular pellet. Centrifuge as in step 2. Remove supernatant.4. Add Solution A at a 1.5:1 volume of Solution A per volume of cell pellet. Briefly vortexor resuspend pellet, incubate on ice for 10 minutes. Add 1/20th volume [cell pellet + Solution A] of 10% Triton X (or IGEPAL 630) to a final concentration of 0.5% and mix. Centrifuge 6000 rpm @ 4 ºC for 30 seconds.5. Collect supernatant (cytoplasmic extract). Determine concentration, aliquot into 200 μg samples and store immediately at –80 ºC.6. Add Solution B in a 1:1 volume relative to nuclear pellet and gently resuspend. Centrifuge 12,000 rpm @ 4 ºC for 10 minutes. Discard supernatant.7. Add DeStreak Rehydration solution in a 2:1 ratio to the pellet. Vortex for 5minutes at room temperature.8. Add endonuclease (Sigma, E8263) to a final concentration of 300 units/ml and incubate at room temperature for 30 minutes.9. Sonicate the sample for 10 seconds. Centrifuge 13k rpm @ 4 ºC for 30 minutes. Collect supernatant (nuclear extract). Determine protein concentration.10. Aliquot into 200 μg samples and store immediately at –80 ºC.Reagents and Solutions:*DTT and PMSF should be added immediately prior to use1. Add M.Q. H2O to a final volume of 20 ml.2. First add DTT then PMSF and quickly vortex vigorously3. Keep the solution on ice and store at 4°CNote:*DTT and PMSF should be added immediately prior to use1. Add 6.8 grams sucrose (final concentration 1.0 M)2. Add M.Q. H2O to a final volume of 20 ml.3. First add DTT then PMSF and quickly vortex vigorously4. Keep the solution on ice and store at 4°CC. Solution C (High salt buffer)*DTT and PMSF should be added immediately prior to use1. Add M.Q. H2O to a final volume of 2 0ml2. Add DTT first then PMSF and quickly vortex vigorously3. Keep the solution on ice and store buffer at 4°CD. Phosphatase Inhibitor Salt Solution。
鼠脑组织总蛋白提取一:蛋白提取1.脑组织称重,按照1:8(1g脑组织加8ml)的比例计算蛋白酶抑制剂的量(Aprotinin 、Pepstatin、NaF、Na3VO4、Leupeptin ,PMSF不稳定最后取出来加,都是1:100的稀释)和TNE的量,先在每个EP管中加入计算好的TNE再加蛋白酶抑制剂,每个EP管中加入3颗珠子,用匀浆器匀浆或用研磨棒研磨。
(蛋白酶抑制剂五种从-20拿到4度冰箱中溶解.各取100微升加入10毫升的TNE中(13层析柜中),TNE缓冲液(1.21g Tris,5.84g NaCl,0.37g EDTA/升),2.匀浆完毕后用枪头将混合好的溶液吸入EP管,一般大块组织加600微,小块加300微,4°离心14000转/min,20min。
3.取上清移入新EP管(最好离两次) ,溴酚蓝·甘油·SDS·巯基乙醇等组成samplebuffer(4X),Sample Buffer与蛋白比为3:1,在97度煮5分钟。
防止盖子开,最好用东西盖住。
始终在冰盒中操作,最后蛋白放入-80。
二:测蛋白浓度计算所需BCA的量,按MA:MB:MC=25:24:1的比例配好,每个孔总量为300ul,BSA:A-I各加150ul,Mix加150ul因BSA是溶解在NaCl,故加样时蛋白溶液和0.9%NaCl共加150ul(蛋白3ul,NaCl 147ul)注意加样时要加复孔。
酶标仪震荡5s37°孵育2小时Western Blot的有效检测下限为0.1-1ng蛋白提取可以分为三个步骤:第一步获取材料。
第二步分离目的细胞或组织成份并破碎。
细胞破碎的方法分为机械法和非机械法,机械法可以是振动、搅拌、研磨、压滤、超声、匀浆,非机械法可以是干燥、改变渗透压、冻融、酶解(纤维素酶、溶菌菌、蜗牛酶)等,不同来源的材料对于不同的处理方法耐受程度是不一样的,例如超声波可以很容易破碎动物细胞,但是破碎酵母细胞就困难许多。
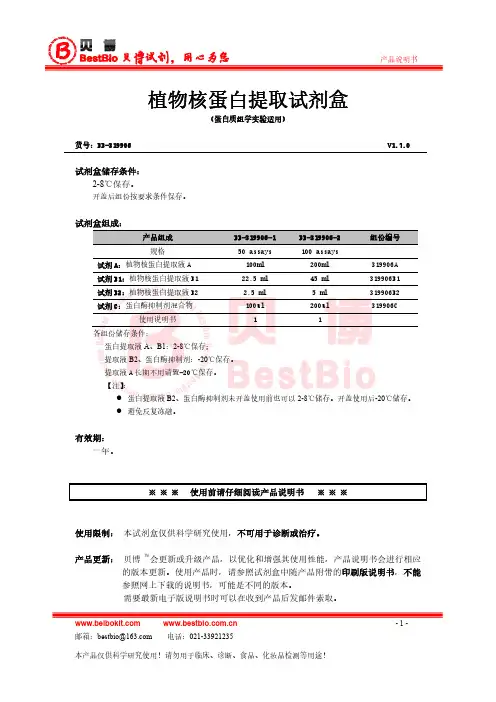
植物核蛋白提取方法植物核蛋白提取方法植物核蛋白提取试剂盒产品组成:产品组成规格植物核提取液A 植物核提取液B 蛋白酶抑制剂混合物说明书BB-3154-1 50 assays 25ml 10ml 250ul 一份BB-3154-2 100 assays50ml 20ml 500ul 一份储存条件:蛋白提取液,磷酸酶抑制剂2-8℃保存;蛋白酶抑制剂-20℃保存。
有效期:一年。
产品简介:贝博植物核蛋白提取试剂盒提供配套试剂,适用于从各种植物细胞和各种实体植物组织,如叶片、根、种子等植物组织中提取核蛋白。
提取过程简单方便,可在1小时内完成。
制备的核蛋白不仅纯度高,保持天然活性,而且绝少交叉污染。
提取的蛋白可用于Western Blotting、转录活性分析、Gel shift凝胶阻滞实验、免疫共沉淀、酶活性测定等蛋白研究。
使用方法:1. 提取液制备:每500ul预冷的.核蛋白提取液A和200ul提取液B中分别加入2ul蛋白酶抑制剂混合物,混匀后置冰上备用。
2. 取洗净擦干后并去除叶梗和粗脉的200mg植物组织样本剪碎,采用以下一种方法处理:i. 加入500ul提取液A后用匀浆机/匀浆器匀浆。
ii. 置于研钵中用液氮研磨,研磨后加入500μl冷的提取液 A。
iii. 加入500ul提取液A直接置冰上研磨。
3. 高速涡旋振荡5秒,然后在4℃,100×g力条件下离心1分钟。
4. 收集上清,弃沉淀。
5. 将上清在4℃,800×g力条件下离心1分钟。
6. 弃上清,收集沉淀。
7. 在沉淀中加入200μl冷的提取液B,高速涡旋振荡15秒。
8. 置冰上40分钟,每隔10分钟高速涡旋振荡15秒。
9. 在4℃,16000×g条件下离心10分钟。
10. 快速将上清吸入另一预冷的干净离心管,即可得到核蛋白。
①②11. 将上述蛋白提取物定量后分装于-80℃冰箱保存备用或直接用于下游实验。
相关产品:产品产品号产品产品号总蛋白提取试剂盒核蛋白提取试剂盒Bradford蛋白定量试剂盒ECL化学发光检测试剂盒细胞蛋白提取试剂盒组织蛋白提取试剂盒细菌蛋白提取试剂盒酵母蛋白提取试剂盒磷酸化蛋白提取试剂盒SDS-PAGE凝胶配制试剂盒BB-3101 BB-3102 BB-3411 BB-3501 BB-3121 BB-3122 BB-3123 BB-3125 BB-3105 BB-3702磷酸化蛋白富集试剂盒膜蛋白提取试剂盒BCA蛋白定量试剂盒蛋白Marker细菌膜蛋白提取试剂盒植物总蛋白提取试剂盒植物膜蛋白提取试剂盒蛋白酶抑制剂混合物磷酸酶抑制剂混合物 SDS-PAGE上样Buffer BB-3108 BB-3103 BB-3401 BB-3721 BB-3151 BB-3124 BB-3152 BB-3301 BB-3311 BB-3703。