肾上腺素说明书
- 格式:docx
- 大小:16.90 KB
- 文档页数:6

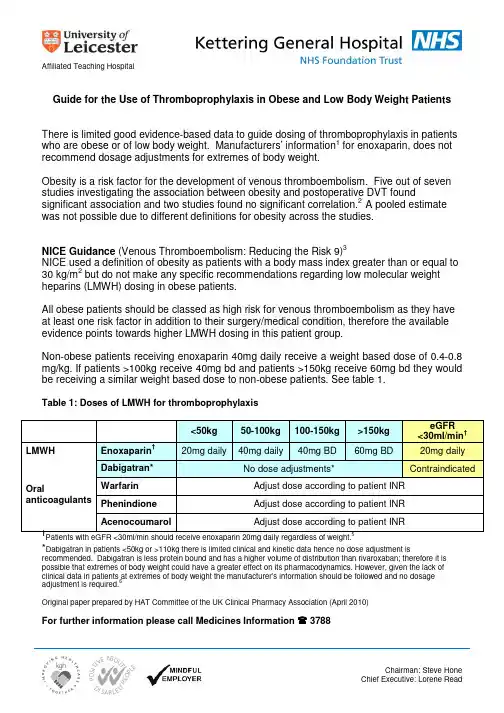
Affiliated Teaching HospitalChairman: Steve HoneChief Executive: Lorene Read Guide for the Use of Thromboprophylaxis in Obese and Low Body Weight PatientsThere is limited good evidence-based data to guide dosing of thromboprophylaxis in patients who are obese or of low body weight. Manufacturers’ information1 for enoxaparin, does not recommend dosage adjustments for extremes of body weight.Obesity is a risk factor for the development of venous thromboembolism. Five out of seven studies investigating the association between obesity and postoperative DVT foundsignificant association and two studies found no significant correlation.2 A pooled estimate was not possible due to different definitions for obesity across the studies.NICE Guidance (Venous Thromboembolism: Reducing the Risk 9)3NICE used a definition of obesity as patients with a body mass index greater than or equal to30 kg/m2 but do not make any specific recommendations regarding low molecular weightheparins (LMWH) dosing in obese patients.All obese patients should be classed as high risk for venous thromboembolism as they have at least one risk factor in addition to their surgery/medical condition, therefore the available evidence points towards higher LMWH dosing in this patient group.Non-obese patients receiving enoxaparin 40mg daily receive a weight based dose of 0.4-0.8 mg/kg. If patients >100kg receive 40mg bd and patients >150kg receive 60mg bd they would be receiving a similar weight based dose to non-obese patients. See table 1.Table 1: Doses of LMWH for thromboprophylaxis<50kg 50-100kg 100-150kg >150kgeGFR<30ml/min†LMWH Enoxaparin†20mg daily 40mg daily 40mg BD 60mg BD 20mg daily Dabigatran* No dose adjustments* ContraindicatedWarfarin Adjust dose according to patient INRPhenindione Adjust dose according to patient INROralanticoagulantsAcenocoumarol Adjust dose according to patient INR†Patients with eGFR <30ml/min should receive enoxaparin 20mg daily regardless of weight.5*Dabigatran in patients <50kg or >110kg there is limited clinical and kinetic data hence no dose adjustment isrecommended. Dabigatran is less protein bound and has a higher volume of distribution than rivaroxaban; therefore it is possible that extremes of body weight could have a greater effect on its pharmacodynamics. However, given the lack ofclinical data in patients at extremes of body weight the manufacturer’s information should be followed and no dosageadjustment is required.6Original paper prepared by HAT Committee of the UK Clinical Pharmacy Association (April 2010)For further information please call Medicines Information 3788References(1) Summary of product characteristics Clexane December 2011 (2) Edmonds MJR, Critchon TJH, Runciman WB, Pradham M. Evidence-based risk factors for post-operative DVT ANZjournal of surgery 2004 (12): 1082-97(3) National Institute of Health and Clinical Excellence. Venous Thromboembolism: Reducing the Risk (NICE clinicalguideline 92). January 2010.(4) Marilyn J. Borkgren-Okonek ET AL. Enoxaparin thromboprophylaxis in gastric bypass patients: extended duration, dosestratification, and anti Xa activity. Surgery for obesity and related diseases 2008; 4: 625-631(5) The Renal Handbook. 3rd Ed. 2009; 264-265(6) Summary of product characteristics Pradaxa February 2012 Page 2 of 2Chairman: Steve HoneChief Executive: Lorene Read。

肾上腺素用药注意事项1、严格掌握剂量从肾上腺素药品说明书上,我们就可看出:肾上腺素 1 mg 皮下注射,是极量(护士头脑中要有这个极量的概念)。
且【不良反应】里:心悸、头痛、激动不安、震颤、血压升高等,有诱发脑溢血、心律失常,甚至发展为心室纤颤的危险。
抢救车配备盐酸肾上腺素的规格是1mg/1ml,可直接用于肌注。
2、静脉注射要稀释肾上腺素静脉注射用法:抢救过敏性休克、心跳骤停时0.1 ~ 0.5 mg 缓慢静注(以 0.9% 氯化钠注射液稀释到 10 ml,即1:10000缓慢静脉注射。
如疗效不好,可改用 4 ~ 8 mg(4 ~ 8 支)静滴(溶于 5% 葡萄糖 500 ~ 1000 ml)。
切记:过敏性休克时肾上腺素切不可直接静脉使用(静脉注射),务必稀释。
若不稀释,则患者很有可能被“秒杀”。
3、输液反应时应用肾上腺素应慎重原因是输液反应不是速发型过敏反应,用肾上腺素违背了输液反应的病理机制,肾上腺素是儿茶酚胺类药物,有快速升压效应,用于速发型过敏反应是正确的;另外,肾上腺素的升压效应会使原有高血压的病人病情恶化。
当然,在一时不能判断出是输液反应还是速发型过敏反应时,小心使用也未尝不可;在输液反应又合并血压急速下降时使用也是对的。
4、局部注射要防组织坏死肾上腺素皮下或肌注,都有可能造成患者注射部位组织坏死。
机理:肾上腺素α受体兴奋的作用让皮肤和皮下的小血管收缩,局部缺血缺氧。
鉴于此,这时的局部处理一定要及时,否则后果肯定是不可逆的。
抢救时,碰到肾上腺素重复给药的问题,注射时每次要轮换部位,以免局部皮肤坏死。
新生儿使用肾上腺素必须是稀释到 1:10000 后才可以使用。
5、局部坏死处理措施立即使用酚妥拉明局部湿敷,效果很好;适当的敷料+ 扩血管药物(酚妥拉明)+ 促进循环。
如果已经发生不可逆坏死的话则应尽量让坏死组织局限,及早采取外科手段介入。

重酒石酸去甲肾上腺素注射液药品名称:通用名称:重酒石酸去甲肾上腺素注射液英文名称:Norepinephrine Bitartrate Injection商品名称:重酒石酸去甲肾上腺素注射液成份:重酒石酸去甲肾上腺素。
辅料为:焦亚硫酸钠、氯化钠、EDTA-Na2、注射用水。
适应症:急性心肌梗死、体外循环等引起的低血压;对血容量不足所致的休克、低血压或嗜铬细胞瘤切除术后的低血压,本品作为急救时补充血容量的辅助治疗,以使血压回升,暂时维持脑与冠状动脉灌注,直到补充血容量治疗发生作用;也可用于椎管内阻滞时的低血压及心跳骤停复苏后血压维持。
规格:1ml:2mg;2ml:10mg用法用量:用5%葡萄糖注射液或葡萄糖氯化钠注射液稀释后静滴。
1.成人常用量:开始以每分钟8-12μg速度滴注,调整滴速以达到血压升到理想水平;维持量为每分钟2-4μg。
在必要时可按医嘱超越上述剂量,但需注意保持或补足血容量。
2.小儿常用量:开始按体重以每分钟0.02-0.1μg/kg速度滴注,按需要调节滴速。
不良反应:1.药液外漏可引起局部组织坏死。
2.本品强烈的血管收缩可以使重要脏器器官血流减少,肾血流锐减后尿量减少,组织供血不足导致缺氧和酸中毒;持久或大量使用时,可使回心血流量减少,外周血管阻力升高,心排血量减少,后果严重。
3.应重视的反应包括静脉输注时沿静脉径路皮肤发白,注射局部皮肤破溃,皮肤紫绀,发红,严重眩晕,上述反应虽属少见,但后果严重。
4.个别病人因过敏而有皮疹、面部水肿。
5.在缺氧、电解质平衡失调、器质性心脏病病人中或逾量时,可出现心律失常;血压升高后可出现反射性心率减慢。
6.以下反应如持续出现应注意:焦虑不安、眩晕、头痛、皮肤苍白、心悸、失眠等。
7.逾量时可出现严重头痛及高血压、心率缓慢、呕吐、抽搐。
禁忌:1.药液外漏可引起局部组织坏死。
2.本品强烈的血管收缩可以使重要脏器器官血流减少,肾血流锐减后尿量减少,组织供血不足导致缺氧和酸中毒;持久或大量使用时,可使回心血流量减少,外周血管阻力升高,心排血量减少,后果严重。

重酒石酸去甲肾上腺素注射液适应症本品用于治疗急性心肌梗死、体外循环等引起的低血压;对血容量不足所致的休克、低血压或嗜铬细胞瘤切除术后的低血压,本品作为急救时补充血容量的辅助治疗,以使血压回升,暂时维持脑与冠状动脉灌注,直到补充血容量治疗发生作用;也可用于椎管内阻滞时的低血压及心跳骤停复苏后血压维持。
规格1ml:2mg。
用法用量用5%葡萄糖注射液或葡萄糖氯化钠注射液稀释后静滴。
1. 成人常用量:开始以每分钟8~12μg速度滴注,调整滴速以达到血压升到理想水平;维持量为每分钟2~4μg。
在必要时可按医嘱超越上述剂量,但需注意保持或补足血容量。
2. 小儿常用量:开始按体重以每分钟0.02~0.1μg/kg速度滴注,按需要调节滴速。
药理毒理本品为肾上腺素受体激动药。
是强烈的α受体激动药,同时也激动β受体。
通过α受体激动,可引起血管极度收缩,使血压升高,冠状动脉血流增加;通过β受体的激动,使心肌收缩加强,心排出量增加。
用量按每分钟0.4μg/kg时,β受体激动为主;用较大剂量时,以α受体激动为主。
不良反应1. 药液外漏可引起局部组织坏死。
2. 本品强烈的血管收缩可以使重要脏器器官血流减少,肾血流锐减后尿量减少,组织供血不足导致缺氧和酸中毒;持久或大量使用时,可使回心血流量减少,外周血管阻力升高,心排血量减少,后果严重。
3. 应重视的反应包括静脉输注时沿静脉径路皮肤发白,注射局部皮肤破溃,皮肤紫绀,发红,严重眩晕,上述反应虽属少见,但后果严重。
4. 个别病人因过敏而有皮疹、面部水肿。
5. 在缺氧、电解质平衡失调、器质性心脏病病人中或逾量时,可出现心律失常;血压升高后可出现反射性心率减慢。
6. 以下反应如持续出现应注意:焦虑不安、眩晕、头痛、皮肤苍白、心悸、失眠等。
7. 逾量时可出现严重头痛及高血压、心率缓慢、呕吐、抽搐。
禁忌禁止与含卤素的麻醉剂和其他儿茶酚胺类药合并使用,可卡因中毒及心动过速患者禁用。
注意事项缺氧、高血压、动脉硬化、甲状腺功能亢进症、糖尿病、闭塞性血管炎、血栓病患者慎用。

临床常用药物说明1.【名称】肾上腺素Epinephrine(副肾素)【规格】1mg【药理作用】抗休克药,为直接作用于α、β受体的拟交感胺类药,主要作用为兴奋心脏,加强心肌收缩力,加快心率,增加心排出量;扩张冠状动脉,改善心肌的血液供应;收缩皮肤、黏膜和内脏血管,使血压升高;阻止组胺的释放;松驰支气管平滑肌,解除支气管痉挛;减轻支气管黏膜水肿;促进糖原和脂肪分解;松弛子宫平滑肌,抑制子宫收缩;降低眼压和有短暂的散瞳作用。
【临床应用】用于心脏停搏、过敏性休克的抢救及其他严重过敏性疾病,如荨麻疹、血管神经性水肿、支气管哮喘、皮肤瘙痒等的治疗;可与局麻药合用,减缓局麻药吸收而延长药效,并有利于止血;亦用于治疗胰岛素作用过度所致低血糖症;局部给药,收缩血管以减轻结合膜充血,以及控制皮肤黏膜的表面出血。
【用法用量】(1)皮下或肌内注射:1次0.25~1mg。
小儿,1次0.01mg/kg。
必要时,可每隔10~15min重复给药。
(2)心内或静脉注射:1次0.1~1mg。
小儿,1次0.005~0.01mg/kg。
(3)局麻辅助用药:于局麻药100ml中加入0.1%肾上腺素注射溶液0.2~0.4 ml。
(4)局部止血:用1:20000~1:1000的溶液湿敷或填塞。
【不良反应】(1)全身反应:可出现头痛、焦虑、不安、失眠、恐惧、寒颤、眩晕、面色苍白、多汗、呼吸困难、胸痛、心悸、心律失常、心跳异常增快或沉重感。
(2)剂量过大或皮下注射误入血管或静注速度过快,引起血压骤升,诱发脑出血危险,能引起心律失常,甚至发展为室颤。
(3)过量的征象为焦虑不安、皮肤潮红、胸痛、寒战、发热、抽搐、血压变化,心律失常、恶心、呕吐、皮肤苍白寒冷、呼吸急促。
(4)滴眼时:眼部有短暂的刺痛或烧灼痛、流泪、眉弓痛、头痛、变态反应、虹膜炎;长期应用可致眼睑、结合膜及角膜黑色素沉积、角膜水肿等。
【注意事项】(1)禁用于对其他拟交感胺类药过敏者及指、趾、耳、鼻、生殖器作局麻时。

王树平(湖北省黄冈市中心医院药学部主任药师)
3.兴奋β2受体可松弛支气
管平滑肌,扩张支气管,解除
支气管痉挛。
4.使α受体兴奋,可使皮肤、
黏膜血管及内脏小血管收缩。
临床应用
心脏骤停 肾上腺素对停搏的心脏有起搏作用,是抢救心脏停搏时的首选药物。
通过作用于窦房结β1受体,促使心脏恢复
态反应性疾病用于治疗过敏性
室颤动/
心动
静止或无脉性电
活动。
克抢救:
所有出现系统性反应的患者,特别是有低血压、气道肿胀或明确呼吸困难的,都应早期肌肉注射肾上腺素。
在急性过敏反应期间,越早给药效果越好。
给药途径
肾上腺素注射液说明书上的给药途。

盐酸异丙肾上腺素注射液以下内容仅供参考,请以药品包装盒中的说明书为准。
妊娠:C哺乳:L3盐酸异丙肾上腺素注射液说明书【说明书修订日期】核准日期:2007年1月12日修改日期:2010年10月1日【药品名称】盐酸异丙肾上腺素注射液【英文名】Isoprenaline Hydrochloride Injection【汉语拼音】Yansuan Yibing Shenshangxiansu Zhusheye【成份】本品主要成份为盐酸异丙肾上腺素,化学名称为4-[(2-异丙氨基-1-羟基)乙基]-1,2-苯二酚盐酸盐。
辅料焦亚硫酸钠、氯化钠、依地酸二钠、盐酸。
【性状】本品为无色的澄明液体。
【适应症】(1)治疗心源性或感染性休克。
(2)治疗完全性房室传导阻滞、心搏骤停。
【规格】2ml:1mg【用法用量】1.救治心脏骤停,心腔内注射0.5-1mg。
2.三度房室传导阻滞,心率每分钟不及40次时,可以本品0.5-1mg加在5%葡萄糖注射液200-300ml内缓慢静滴。
【不良反应】常见的不良反应有:口咽发干、心悸不安;少见的不良反应有:头晕、目眩、面潮红、恶心、心率增速、震颤、多汗、乏力等。
【禁忌】心绞痛、心肌梗死、甲状腺功能亢进及嗜铬细胞瘤患者禁用。
【注意事项】1.心律失常并伴有心动过速;心血管疾患,包括心绞痛、冠状动脉供血不足;糖尿病;高血压;甲状腺功能亢进;洋地黄中毒所致的心动过速慎用。
2.遇有胸痛及心律失常应及早重视。
3.交叉过敏,病人对其他肾上腺能激动药过敏者,对本品也常过敏。
【孕妇及哺乳期妇女用药】未进行该项实验且无可靠参考文献,故尚不明确。
【儿童用药】未进行该项实验且无可靠参考文献,故尚不明确。
【老年用药】未进行该项实验且无可靠参考文献,故尚不明确。
【药物相互作用】1.与其他拟肾上腺素药物合用可增效,但不良反应也增多。
2.并用普萘洛尔时本品的作用受到拮抗。
【药物过量】未进行该项实验且无可靠参考文献,故尚不明确。

异丙肾上腺素说明书关于《异丙肾上腺素说明书》,是我们特意为大家整理的,希望对大家有所帮助。
支气管哮喘是一种较为难攻破的病症,另外存有一定的风险性,支气管哮喘病人需要常常常备紧急药品。
异丙肾上腺激素能够用以医治支气管哮喘,另外异丙肾上腺激素针对心脏房室传导阻滞也是有一定的作用。
今日就来主要和大伙儿一起谈一谈异丙肾上腺激素这款药品,详尽內容见异丙肾上腺激素使用说明。
主冶作用用以支气管哮喘及心脏房室传导阻滞。
药品相互影响1.与别的拟肾上腺激素药品共用可提质增效,但副作用也增加。
2.并且用普萘洛尔时本产品的功效遭受拮抗。
3.与拟肾上腺激素药品、氨茶碱、甲状腺囊肿中药制剂另外运用,将提升此药的毒副作用功效副作用1.普遍的副作用有:口咽发涩、心悸躁动不安。
2.罕见的副作用有:头昏、眼花、面通红、恶心想吐、心跳增长速度、震颠、容易出汗、困乏等。
3.有心律失常,心肌损害,心悸,引起心绞痛,头痛,震颠,头昏,体力透支,某些病案支气管炎收拢(筋挛),舌底给药可造成口腔溃疡,牙毁坏.4.此药用价值于医治呼吸道病症时,其副作用有心跳过速、心律失常、心悸、通红及引起心绞痛。
运用此药有需慢慢提升使用量的趋向,进而提升对心脏的毒副作用功效。
此药能致心电图检查出現心肌梗塞波型,或如静脉键入此药一不小心,可造成心室颤动或乃至心脏坏死。
5.它松驰支气管炎平滑肌使气管摩擦阻力降低,但使换气注浆占比紊乱并加剧低氧血症,病人觉得转好而病况在恶变。
除此之外,它有时候可引起怪异的气管痉挛。
普遍有头痛、震颠、焦虑、头昏及体力透支。
6.舌底含化此药时也可造成全身反映,另外经常出现口腔溃疡。
忌讳 1.对别的肾上腺激素类药过敏症状对本产品也是有交叉式皮肤过敏。
2.高血压、甲状腺囊肿功能较为亢奋、心绞痛、冠脉血供不够、糖尿病等病人谨慎使用。
常见问题1.对别的肾上腺激素类药过敏症状对本产品也是有交叉式皮肤过敏。
2.病人服药后若有心律失常或胸口痛,应咨询医师。

SYNCHRON ®System(s)ALTChemistry Information Sheet©Copyright 2010Beckman Coulter,Inc.A l a n i n e A m i n o t r a n s f e r a s eREF 442620(200tests/cartridge)REF 476826(400tests/cartridge)For In Vitro Diagnostic UseANNUAL REVIEW Reviewed by:DateReviewed by:DatePRINCIPLEINTENDED USEALT reagent,when used in conjunction with SYNCHRON LX ®System(s),UniCel ®DxC 600/800System(s),is intended for the quantitative determination of alanine aminotransferase activity in human serum or plasma.CLINICAL SIGNIFICANCEAlanine aminotransferase measurements are used in the diagnosis and treatment of certain liver diseases (e.g.,viral hepatitis and cirrhosis)and heart diseases.METHODOLOGYALT reagent is used to measure analyte activity by a kinetic rate method.1,2In the reaction,alanine aminotransferase catalyzes the reversible transamination of L-alanine and alpha-ketoglutarate to pyruvate and L-glutamate.The pyruvate is then reduced to lactate in the presence of lactate dehydrogenase (LDH)with the concurrent oxidation of reduced β-nicotinamide adenine dinucleotide (NADH)to β-nicotinamide adenine dinucleotide (NAD).The SYNCHRON ®System(s)automatically proportions the appropriate sample and reagent volumes into the cuvette.The ratio used is one part sample to 11parts reagent.The system monitors the change in absorbance at 340nanometers.This change in absorbance is directly proportional to the activity of ALT in the sample and is used by the System to calculate and express the ALT activity.CHEMICAL REACTION SCHEMESPECIMENTYPE OF SPECIMENBiological fluid samples should be collected in the same manner routinely used for any laboratory test.3Freshly drawn serum or plasma are the specimens of choice.Acceptable anticoagulants are listed in PROCEDURAL NOTES section of this chemistry information sheet.Whole blood is not recommended for use as a sample.SPECIMEN STORAGE AND STABILITY1.Tubes of blood are to be kept closed at all times and in a vertical position.It is recommended that the serum orplasma be physically separated from contact with cells within two hours from the time of collection.42.Separated serum or plasma should not remain at room temperature longer than8hours.If assays are notcompleted within8hours,serum or plasma should be stored at+2°C to+8°C.If assays are not completed within 48hours,or the separated sample is to be stored beyond48hours,samples should be frozen at-15°C to-20°C.Frozen samples should be thawed only once.Analyte deterioration may occur in samples that are repeatedly frozen and thawed.43.Refer to references(4,5)for additional information on the effects of preanalytical variables on sample storage andstability.Each laboratory should determine if the recommended requirements are appropriate.Additional specimen storage and stability conditions as designated by this laboratory:SAMPLE VOLUMEThe optimum volume,when using a0.5mL sample cup,is0.3mL of sample.For optimum primary sample tube volumes and minimum volumes,refer to the Primary Tube Sample Template for your system.CRITERIA FOR UNACCEPTABLE SPECIMENSRefer to the PROCEDURAL NOTES section of this chemistry information sheet for information on unacceptable specimens.Criteria for sample rejection as designated by this laboratory:PATIENT PREPARATIONSpecial instructions for patient preparation as designated by this laboratory:SPECIMEN HANDLINGSpecial instructions for specimen handling as designated by this laboratory:REAGENTSCONTENTSEach kit contains the following items:Two Alanine Aminotransferase Reagent Cartridges(2x200tests)or(2x400tests and2bottles of ALT[A-reagent]) VOLUMES PER TESTSample Volume23µLORDAC Sample Volume3µLTotal Reagent Volume250µLCartridge VolumesA242µLB8µLC––REACTIVE INGREDIENTSREAGENT CONSTITUENTSα-Ketoglutarate16mmol/LLactate dehydrogenase(LD)>2300IU/LL-Alanine500mmol/LTris buffer97mmol/LNADH0.18mmol/LAlso non-reactive chemicals necessary for optimal system performance.Avoid skin contact with e water to wash reagent from skin.EUROPEAN HAZARD CLASSIFICATIONXn;R22Harmful if swallowed.Alanine Aminotransferase Reagent(Compartment B)S37/39Wear suitable gloves and eye/face protection. MATERIALS NEEDED BUT NOT SUPPLIED WITH REAGENT KITAt least two levels of control materialSalineREAGENT PREPARATIONFor P/N442620(200tests):Transfer all the contents of the smallest reagent compartment(C)into the largest reagent compartment(A).For P/N476826(2x400tests):Transfer all the contents of one ALT(A-reagent)bottle into the largest reagent compartment(A).Replace cartridge caps and gently invert the cartridge several times to ensure adequate mixing.ACCEPTABLE REAGENT PERFORMANCEThe acceptability of a reagent is determined by ensuring that quality control results are within your facility’s acceptance criteria.REAGENT STORAGE AND STABILITYALT reagent when stored unopened at+2°C to+8°C will obtain the shelf-life indicated on the cartridge label.Once prepared,the reagent is stable for30days at+2°C to+8°C unless the expiration date is exceeded.DO NOT FREEZE. Reagent storage location:CALIBRATIONCALIBRATOR REQUIREDCalibration is not required.TRACEABILITYThis measurand(analyte)is traceable to the manufacturer’s selected Measurement Procedure as described in the Methodology section.QUALITY CONTROLAt least two levels of control material,normal and abnormal,should be analyzed daily.In addition,these controls should be run with each new reagent cartridge and after specific maintenance or troubleshooting procedures as detailed in the appropriate system manual.More frequent use of controls or the use of additional controls is left to the discretion of the user based on good laboratory practices or laboratory accreditation requirements and applicable laws.The following controls should be prepared and used in accordance with the package inserts.Discrepant quality control results should be evaluated by your facility.Table1.0Quality Control MaterialCONTROL NAME SAMPLE TYPE STORAGETESTING PROCEDURE(S)1.If necessary prepare reagent as defined in the Reagent Preparation section of this chemistry information sheet andload the reagent onto the system.2.Program samples and controls for analysis.3.After loading samples and controls onto the system,follow the protocols for system operations.For detailed testing procedures,refer to the SYNCHRON LX Operations Manual,or the UniCel DxC600/800System Instructions For Use(IFU)manual.CALCULATIONSThe SYNCHRON®System(s)performs all calculations internally to produce the final reported result.The system will calculate the final result for sample dilutions made by the operator when the dilution factor is entered into the system during sample programming.REPORTING RESULTSEquivalency between the SYNCHRON LX and UniCel DxC600/800Systems has been established.Chemistry results between these systems are in agreement and data from representative systems may be shown.REFERENCE INTERVALSEach laboratory should establish its own reference intervals based upon its patient population.The following reference intervals were taken from literature and a study performed on SYNCHRON Systems.6Table2.0Reference intervalsINTERVALS SAMPLE TYPE CONVENTIONAL UNITS S.I.UNITSSerum or Plasma(Male)10–40IU/L0.17–0.68µkat/L LiteratureSerum or Plasma(Female)7–35IU/L0.12–0.60µkat/LSerum or Plasma(Male)17–63IU/L0.29–1.07µkat/L SYNCHRONSerum or Plasma(Female)14–54IU/L0.24–0.92µkat/L INTERVALS SAMPLE TYPE CONVENTIONAL UNITS S.I.UNITS LaboratoryRefer to References(7,8,9)for guidelines on establishing laboratory-specific reference intervals.Additional reporting information as designated by this laboratory:PROCEDURAL NOTESANTICOAGULANT TEST RESULTS1.If plasma is the sample of choice,the following anticoagulants were found to be compatible with this method basedon a study of20healthy volunteers:Table3.0Compatible AnticoagulantsANTICOAGULANT LEVEL TESTED FOR IN VITROINTERFERENCEAVERAGE PLASMA-SERUMBIAS(IU/L)Ammonium Heparin14Units/mL NSI a Lithium Heparin14Units/mL NSI Sodium Heparin14Units/mL NSIa NSI=No Significant Interference(within±6.0IU/L or7%).2.The following anticoagulant was found to be incompatible with this method:Table4.0Incompatible AnticoagulantsANTICOAGULANT LEVEL TESTED FOR IN VITROINTERFERENCE PLASMA-SERUM BIAS(IU/L)aPotassium Oxalate/SodiumFluoride2.0/2.5mg/mL-15a Bias is based on worst case instead of average.Plus(+)or minus(-)signs in this column signify positive or negative bias.LIMITATIONSSamples with extremely high enzyme activity(>12,000IU/L or>200.04µkat/L)may consume all of the NADH substrate before the first absorbance measurement is taken after sample addition.These samples can report either very low enzyme activities or suppress the result as"OIR LO".These samples should be diluted1:20with saline and rerun.INTERFERENCES1.The following substances were tested for interference with this methodology:Table5.0InterferencesSUBSTANCE SOURCE LEVEL TESTED OBSERVED EFFECT Bilirubin Bovine30mg/dL NSI aLipemia Intralipid b300mg/dL NSIa NSI=No Significant Interference(within±6.0IU/L or7%).b Intralipid is a registered trademark of KabiVitrum,Inc.,Clayton,NC27250.2.Samples showing evidence of hemolysis should not be used.Hemolysis may cause falsely elevated results.3.Refer to References(10,11,5)for other interferences caused by drugs,disease and preanalytical variables. PERFORMANCE CHARACTERISTICSANALYTIC RANGEThe SYNCHRON®System(s)method for the determination of alanine aminotransferase provides the following analytical range:Table6.0Analytical RangeSAMPLE TYPE CONVENTIONAL UNITS S.I.UNITSSerum or Plasma5–400IU/L0.09–6.80µkat/LSerum or Plasma(ORDAC)a350–2600IU/L 5.8–43.0µkat/La Overrange Detection and Correction.Refer to the SYNCHRON LX Operations Manual,or the UniCel DxC600/800System Instructions For Use(IFU)manual for more details on this function.Samples with activities exceeding the high end of the analytical range should be rerun with ORDAC enabled or diluted with saline and reanalyzed.REPORTABLE RANGE(AS DETERMINED ON SITE):Table7.0Reportable RangeSAMPLE TYPE CONVENTIONAL UNITS S.I.UNITSSENSITIVITYSensitivity is defined as the lowest measurable concentration which can be distinguished from zero with95%confidence. Sensitivity for ALT determination is5IU/L(0.08µkat/L).EQUIVALENCYEquivalency was assessed by Deming regression analysis of patient samples to accepted clinical methods.Serum or Plasma (in the range of 5.0to 389.1IU/L):Y (SYNCHRON LX Systems)=0.994X +5.02N=74MEAN (SYNCHRON LX Systems)=86.9MEAN (SYNCHRON CX7DELTA)=82.3CORRELATION COEFFICIENT (r)=0.9965Refer to References (12)for guidelines on performing equivalency testing.PRECISIONA properly operating SYNCHRON ®System(s)should exhibit precision values less than or equal to the following:Table 8.0Precision Values 1SDCHANGEOVER VALUE aTYPE OF PRECISION SAMPLE TYPE IU/L µkat/L IU/L µkat/L %CV Serum/Plasma 3.00.0585.7 1.43 3.5Within-run Serum/Plasma (ORDAC)NA b NA NA NA 10.0Serum/Plasma 4.50.0885.7 1.43 5.3TotalSerum/Plasma (ORDAC)NANANANA15.0aWhen the mean of the test precision data is less than or equal to the changeover value,compare the test SD to the SD guideline given above to determine the acceptability of the precision testing.When the mean of the test precision data is greater than the changeover value,compare the test %CV to the guideline given above to determine acceptability.Changeover value =(SD guideline/CV guideline)x 100.bNA =Not applicable.Comparative performance data for a SYNCHRON LX ®System evaluated using the NCCLS Proposed Guideline EP5-T2appears in the table below.13Each laboratory should characterize their own instrument performance for comparison purposes.Table 9.0NCCLS EP5-T2Precision Estimate MethodEP5-T2Calculated Point Estimates TYPE OF IMPRECISION SAMPLE TYPE No.SystemsNo.Data Points aTest Mean Value (IU/L)SD %CV Serum Control 118020.30.88 4.34Serum Control 2180178.90.870.48Within-runSerumControl 3180334.3 1.860.56Serum Control 118020.30.94 4.61Serum Control 2180178.9 1.250.70Total SerumControl 3180334.32.840.85aThe point estimate is based on the data from one system,run for twenty days,two runs per day,two observations per run on an instrument operated and maintained according to the manufacturer‘s instructions.NOTICEThese degrees of precision and equivalency were obtained in typical testing procedureson a SYNCHRON LX®System and are not intended to represent the performancespecifications for this reagent.ADDITIONAL INFORMATIONFor more detailed information on SYNCHRON LX Systems or UniCel DxC Systems,refer to the appropriate system manual.SHIPPING DAMAGEIf damaged product is received,notify your Beckman Coulter Clinical Support Center.REFERENCES1.Kamen,A.,Wroblewski,F.,LaDue,J.E.,J.Clin.Inv.,34:126133(1955).2.Henry,R.J.,et al.,Amer.J.Clin.Path.,34:381(1960).3.Tietz,N.W.,"Specimen Collection and Processing;Sources of Biological Variation",Textbook of ClinicalChemistry,2nd Edition,W.B.Saunders,Philadelphia,PA(1994).4.National Committee for Clinical Laboratory Standards,Procedures for the Handling and Processing of BloodSpecimens,Approved Guideline,NCCLS publication H18-A,Villanova,PA(1995).5.Young, D.S.,Effects of Preanalytical Variables on Clinical Laboratory Tests,2nd Edition,AACC Press,Washington,D.C.(1997).6.Tietz,N.W.,Clinical Guide to Laboratory Tests,3rd Edition,W.B.Saunders,Philadelphia,PA(1995).7.National Committee for Clinical Laboratory Standards,How to Define,Determine,and Utilize Reference Intervalsin the Clinical Laboratory,Approved Guideline,NCCLS publication C28-A,Villanova,PA(1995).8.Tietz,N.W.,ed.,Fundamentals of Clinical Chemistry,3rd Edition,W.B.Saunders,Philadelphia,PA(1987).9.Henry,J.B.,Clinical Diagnosis and Management by Laboratory Methods,18th Edition,W.B.Saunders Company,Philadelphia,PA(1991).10.Young,D.S.,Effects of Drugs on Clinical Laboratory Tests,4th Edition,AACC Press,Washington,D.C.(1995).11.Friedman,R.B.,Young, D.S.,Effects of Disease on Clinical Laboratory Tests,3rd Edition,AACC Press,Washington,D.C.(1997).12.National Committee for Clinical Laboratory Standards,Method Comparison and Bias Estimation Using PatientSamples,Approved Guideline,NCCLS publication EP9-A,Villanova,PA(1995).13.National Committee for Clinical Laboratory Standards,Precision Performance of Clinical Chemistry Devices,Tentative Guideline,2nd Edition,NCCLS publication EP5-T2,Villanova,PA(1992).Beckman Coulter Ireland,Inc.,Mervue Business Park,Mervue,Galway,Ireland35391774068Beckman Coulter,Inc.,250S.Kraemer Blvd.,Brea,CA92821。

临床常用急救药品说明书临床常用贿临床常用急救药品说明书**盐酸肾上腺素(规格:1.0mg/支)[适应症]主要用于因支气管痉挛所致严重呼吸困难,可迅速缓解药物等引起的过敏性休克。
是各种原因引起的心脏骤停进行心肺复苏的主要抢救药物。
[用法用量]常用量皮下或肌注0.25mg-1.0mg/次;极量1.0mg/次。
本品肌注较皮下注射作用快。
1、抢救过敏性休克。
由于本品具有兴奋心肌、升高血压、松弛支气管等作用,故可缓解过敏性休克的心跳微弱、血压下降、呼吸困难等症状。
(1)皮下或肌注0.5-1.0mg/次;极量1.0mg/次;(2)静推:0.1mg---0.5mg用0.9%氯化钠液10ml缓慢静推;(3)如果疗效不佳可用4--8mg与500--1000ml葡萄糖静滴。
2、抢救心脏骤停。
可用于麻醉和手术中的意外、药物中毒或心脏传导阻滞等引起的心脏骤停。
以0.25--0. 5mg本品加10ml生理盐水稀释后静注,同时进行心脏按压、人工呼吸、纠正酸中毒。
(3)治疗支气管哮喘:效果迅速但不持久。
皮下注射0.25--0.5mg,3-5分钟见效,但仅能维持一小时。
必要时可每4--6小时重复一次。
(4)其他[不良反应]1、心悸、头痛、血压升高、震颤、无力、眩晕、呕吐、四肢发凉;2、有时可有心律失常,严重者可因心室颤动致死;3、用药局部可有水肿、充血、炎症;[禁忌]1、下列情况应慎用:器质性脑病、心血管病、青光眼、帕金森氏病、噻嗪类引起的循环虚脱及低血压、精神、神经疾病。
2、用量过大或皮下注射误入血管时可引起血压突然升高而致脑溢血。
3、抗过敏性休克时,需补充血容量。
4、其他[注意事项]1、高血压、器质性心脏病、冠状动脉疾病、糖尿病、甲亢、洋地黄中毒、外伤性及出血性休克、心源性哮喘禁用。
2、儿童及老年人应用时要慎重。
**喘定注射液(二羟丙茶碱)(规格:2ml:0.25g)[药理作用]本品平喘作用与茶碱相似,尤适用于伴心动过速的哮喘患者。
盐酸异丙肾上腺素注射液【药品名称】通用名:盐酸异丙肾上腺素注射液本品主要成分及其化学名称为:本品主要成分为盐酸异丙肾上腺素,化学名称为4--1,2-苯二酚盐酸盐。
分子式:C11H17NO3·HCl分子量:【性状】本品为无色的澄明液体。
【药理作用】本品为β受体冲动剂,对β1和β2受体均有强大的冲动作用,对α受体几无作用。
主要作用:①作用于心脏β1受体,使心收缩力增强,心率加快,传导加速,心输出量和心肌耗氧量增加。
②作用于血管平滑肌β2受体,使骨骼肌血管明显舒张,肾、肠系膜血管及冠脉亦不同程度舒张,血管总外周阻力降低。
其心血管作用导致收缩压升高,舒张压降低,脉压差变大。
③作用于于支气管平滑肌β2受体,使支气管平滑肌松弛。
④促进糖原和脂肪分解,增加组织耗氧量。
【药代动力学】静注后,作用维持不到1小时。
T1/2根据注射的快慢为1分钟至数分钟。
静注后约40%~50%以原形排出。
【适应症】⑴治疗心源性或感染性休克。
⑵治疗完全性房室传导阻滞、心搏骤停。
【用法用量】1、救治心脏骤停,心腔内注射~1mg。
2、三度房室传导阻滞,心率每分钟不及40次时,可以本品~1mg加在5%葡萄糖注射液2021300ml内缓慢静滴。
【不良反响】常见的不良反响有:口咽发干、心悸不安;少见的不良反响有:头晕、目眩、面潮红、恶心、心率增速、震颤、多汗、乏力等。
【禁忌症】心绞痛、心肌梗死、甲状腺功能亢进及嗜铬细胞瘤患者禁用。
【考前须知】1、心律失常并伴有心动过速;心血管疾患,包括心绞痛、冠状动脉供血缺乏;糖尿病;高血压;甲状腺功能亢进;洋地黄中毒所致的心动过速慎用。
2、遇有胸痛及心律失常应及早重视。
3、交叉过敏,病人对其他肾上腺能冲动药过敏者,对本品也常过敏。
【药物相互作用】1、与其他拟肾上腺素药物合用可增效,但不良反响也增多。
2、并用普萘洛尔时本品的作用受到拮抗。
【规格】2ml:1mg【贮藏】遮光,密闭,在凉处保存。
[药品名称:间羟胺中文别名:g以间羟胺计,以下同,由于最大效应不是立即显现,在重复用药前对初量效应至少要观察10分钟;②静脉注射,初量用—5mg,继而静滴,用于重症休克;③静脉滴注,将间羟胺15—100mg参加l内,调节滴速以维持理想的血压。
肾上腺素使用方法肾上腺素,又称肾上腺素、肾上腺素、肾上腺素,是一种重要的激素和神经递质,对心血管系统、代谢和免疫系统都具有重要的影响。
它主要由肾上腺髓质细胞合成,对心脏、血管和支气管等器官具有强烈的兴奋作用。
肾上腺素在医学上有着广泛的应用,尤其在心脏骤停、心肌梗死、严重过敏反应等急救情况下,肾上腺素更是救命药物。
肾上腺素的使用方法包括静脉注射、肌肉注射和皮下注射。
在急救情况下,肾上腺素通常通过静脉注射给药,以迅速发挥作用。
在进行静脉注射时,需要将肾上腺素与生理盐水等溶剂稀释后缓慢注入静脉内,以避免发生过快的心血管反应。
肌肉注射和皮下注射则常用于对过敏反应的治疗,这种情况下需要将肾上腺素溶液注射到患者的肌肉或皮下组织中。
在使用肾上腺素时,需要严格按照医嘱和药品说明书的指示进行用药。
剂量的确定应根据患者的具体情况和病情来确定,一般情况下,成人的推荐剂量为0.1-0.5mg,儿童的推荐剂量为0.01mg/kg。
在使用肾上腺素时,需要特别注意药物的保存和稀释方法,以及注射的速度和途径,避免因错误的使用方法而导致不良反应或药物失效。
此外,肾上腺素在使用过程中可能会出现一些不良反应,如心悸、高血压、头痛、颤抖等,因此在使用过程中需要密切观察患者的反应,并及时处理可能出现的不良反应。
对于存在心血管疾病、高血压、甲亢、糖尿病等疾病的患者,在使用肾上腺素前需要谨慎评估患者的病情和风险,避免因使用肾上腺素而加重患者的病情。
总之,肾上腺素作为一种重要的急救药物,在医疗中有着广泛的应用。
正确的使用方法和注意事项对于保证药物的疗效和安全性至关重要。
因此,在使用肾上腺素时,医护人员需要严格按照规范操作,并密切观察患者的反应,以确保药物的有效使用和患者的安全。
合理用药知识宣传之肾上腺素静脉注射时为何要稀释?一、肾上腺素简介:肾上腺素作为血管收缩药已有100年的历史,作为CPR(心肺复苏术)基本用药已有40多年的历史。
本药兼有α、β-肾上腺素受体激动作用,激动α-肾上腺素受体可引起皮肤、黏膜、内脏血管收缩,激动β-肾上腺素受体可引起心肌兴奋、心率加快、冠状血管扩张及骨骼肌、支气管平滑肌、胃肠道平滑肌松弛。
本药对血压的影响与剂量有关,常用剂量使收缩压升高而舒张压不变或略降,大剂量使收缩压、舒张压均升高。
本药升高血压有三重机制:(1)直接刺激心肌,增强心室收缩能力(正性肌力作用)。
(2)增加心率(正性变时作用)。
(3)收缩末梢血管。
本药用于PCR主要利用其可增强心肌收缩力;增加冠脉及脑血流量;增加心肌自律性和使VF(心室纤颤)易被电复律等。
肾上腺素仍被认为是复苏的一线选择用药,可用于电击无效的VF/无脉性VT、心脏静止或PEA(无脉性电活动)。
二、肾上腺素静脉注射时必须稀释依据1.《2016中国心肺复苏专家共识》用于心脏骤停时,肾上腺素用法:1mg静脉推注,每3~5min重复1次。
每次从周围静脉给药后应该使用20ml生理盐水冲管,以保证药物能够到达心脏。
因心内注射可增加发生冠脉损伤、心包填塞和气胸的危险,同时也会延误胸外按压和肺通气开始的时间,因此,仅在开胸或其他给药方法失败或困难时才考虑应用。
2.《血管加压药物在急诊休克中的应用专家共识》肾上腺素是过敏性休克的首选药物,首选股外侧肌肉注射;对特定患者可静脉注射或持续静脉输注。
(证据水平中,强推荐)专家一致建议,过敏性休克患者首选股外侧肌肉注射肾上腺素0.3~0.5 mg,必要时5~15 min 重复一次。
对意识丧失、即将发生心跳骤停的患者,可静脉注射肾上腺素0.1~0.2 mg,注意要将原液(1 :1 000)稀释10 倍使用;对反复低血压的患者,可以0.1 μg/(kg·min)的速度持续输注。
肾上腺素说明书
盐酸肾上腺素注射液
核准日期:2007年1月26日
修订日期:2010年10月1日
药品名称:
【通用名称】盐酸肾上腺素注射液[药典]
【英文名称】Adre nline Hydrochloride Injection [药典]
【汉语拼音】Yan Sua n She n Sha ng Xia n Su Zhu She Ye
成份:
本品主要成份为盐酸肾上腺素,化学名称为:(R)-4 [2-(甲氨基)-1-羟基乙
基]-1, 2-苯二酚盐酸盐。
化学结构式:
分子式:C9H13NO3 HCl
分子量:219.67
所属类别:
化药及生物制品>> 呼吸系统药物>> 平喘药>> 肾上腺素受体激动
药
化药及生物制品>> 循环系统药物>> 血管活性药>> 血管收缩药
性状:
本品为无色或几乎无色的澄明液体。
受日光照射或与空气接触易变质
适应症: 主要适用于因支气管痉挛所致严重呼吸困难,可迅速缓解药物等引起的过敏性休克,亦可用于延长浸润麻醉用药的作用时间。
各种原因引起的心脏骤停进行心肺复苏的主要抢救用药。
规格:
1ml : 1mg
用法用量:
常用量:皮下注射,1次0.25mg—1mg;极量:皮下注射,1次1mg。
1. 抢救过敏性休克:如青霉素等引起的过敏性休克。
由于本品具有兴奋心肌、升高血压、松弛支气管等作用,故可缓解过敏性休克的心跳微弱、血压下降、呼吸困难等症状。
皮下注射或肌注
0.5—1mg,也可用0.1 —0.5mg缓慢静注(以0.9%氯化钠注射液稀释到10ml),如疗效不好,可改用4—8mg静滴(溶于5%葡萄糖液500—1000ml)。
2•抢救心脏骤停:可用于麻醉和手术中的意外、药物中毒或心脏传导阻滞等原因引起的心脏骤停,以0.25—0.5mg以10ml生理盐水稀释后静脉(或心内注射),同时进行心脏按压、人工呼吸、纠正酸中毒。
对电击引起的心脏骤停,
亦可用本品配合电除颤仪或利多卡因等进行抢救。
3. 治疗支气管哮喘:效果迅速但不持久。
皮下注射0.25—0.5mg, 3—5分钟见效,但仅能维持1小时。
必要时每4小时可重复注射一次。
4. 与局麻药合用:加少量(约1:200000- 500000)于局麻药中(如普鲁卡因),在混合药液中,本品浓度为2 —5 [1 g/m,总量不超过0.3mg,可减少局麻药的吸收而延长其药效,并减少其毒副作用,亦可减少手术部位
的出血。
5. 制止鼻粘膜和齿龈出血:将浸有1: 20000—1: 1000溶液的纱布填塞出血处。
6•治疗荨麻疹、枯草热、血清反应等:皮下注射1:1000溶液0.2—0.5ml,必要时再以上述剂量注射一次。
不良反应:
1. 心悸、头痛、血压升高、震颤、无力、眩晕、呕吐、四肢发凉。
2. 有时可有心律失常,严重者可由于心室颤动而致死。
3. 用药局部可有水肿、充血、炎症。
禁忌.
^禁忌、:
1•下列情况慎用:器质性脑病、心血管病、青光眼、帕金森氏病、噻嗪类引起的循环虚脱及低血压、精神神经疾病。
2•用量过大或皮下注射时误入血管后,可引起血压突然上升而导致脑溢血。
3. 每次局麻使用剂量不可超过300 ^g否则可引起心悸、头痛、血压升高等。
4. 与其他拟交感药有交叉过敏反应。
5•可透过胎盘。
6. 抗过敏休克时,须补充血容量。
注意事项:
高血压、器质性心脏病、冠状动脉疾病、糖尿病、甲状腺功能亢进、洋地黄中毒、外伤性及出血性休克、心源性哮喘等患者禁用
孕妇及哺乳期妇女用药:
必须应用本品时应慎用
儿童用药:
必须应用本品时应慎用。
老年用药:
老年人对拟交感神经药敏感,必须应用本品时宜慎重。
药物相互作用:
1. o受体阻滞剂以及各种血管扩张药可对抗本品的加压作用。
2•与全麻药合用,易产生心律失常,直至室颤。
用于指、趾部局麻时,药
液中不宜加用本品,以免肢端供血不足而坏死。
3•与洋地黄、三环类抗抑郁药合用,可致心律失常。
4•与麦角制剂合用,可致严重高血压和组织缺血。
5. 与利血平、胍乙啶合用,可致高血压和心动过速。
6•与B受体阻滞剂合用,两者的B受体效应互相抵消,可出现血压异常升高、心动过缓和支气管收缩。
7•与其他拟交感胺类药物合用,心血管作用加剧,易出现副作用。
8•与硝酸酯类合用,本品的升压作用被抵消,硝酸酯类的抗心绞痛作用减弱。
药物过量:
未进行该项实验且无可参看文献,故尚不明确。
药理毒理:
兼有o受体和B受体激动作用。
o受体激动引起皮肤、粘膜、内脏血管收缩。
B 受体激动引起冠状血管扩张、骨骼肌、心肌兴奋、心率增快、支气管平滑肌、胃肠道平滑肌松弛。
对血压的影响与剂量有关,常用剂量使收缩压上升而舒张压不升或略降,大剂量使收缩压、舒张压均升高。
药代动力学:
肾上腺素在体内的代谢途径与异丙肾上腺素相同。
口服后有明显的首过
效应,在血中被肾上腺素神经末梢摄取,另一部分迅速在肠粘膜及肝中被儿茶酚—氧位—甲基转移酶(COMT)和单胺氧化酶(MAO)灭活,转化为无效代谢物,不能达到有效血浓度。
皮下注射由于局部血管收缩使
之吸收缓慢,肌内注射吸收较皮下注射为快。
皮下注射约6-15分钟起效,作用维持1—2小时,肌注作用维持80分钟左右。
仅少量原形药物由尿排出。
本药可通过胎盘,不易透过血-脑脊液屏障。
贮藏:
遮光,密闭,在阴凉处保存。
(系指不超过20C)
包装:
玻璃安瓶2支装
有效期:
24个月
执行标准:
《中国药典》2010年版二部
批准文号:
国药准字H31021062
生产企业:
上海禾丰制药有限公司
妊娠分级:
FDA妊娠分级:C
哺乳期分级:
盐酸肾上腺素:肾上腺素L1,半衰期1h (吸入剂)除了新生儿早期或早产儿,本品一般不会被婴儿吸收,但注意观察短暂的兴奋作用。