鲁教版化学九年级下册《物质的溶解性》溶液(第1课时)
- 格式:pptx
- 大小:474.14 KB
- 文档页数:27

第3节物质的溶解性第1课时影响物质溶解性的因素一、基础巩固1.【2023·秦皇岛期末】固体物质的溶解性与下列因素无关的是( )A.温度的高低 B.溶质的性质C.压强的大小 D.溶剂的性质2.为了探究影响物质溶解性的因素,设计了如下表所示的实验方案,该实验无法探究的因素是( )A. 溶质种类B. 溶剂种类C. 溶液温度D. 颗粒粗细3.下表是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:(1)在同一条件下,物质的溶解能力与____________和____________有关。
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件________有关。
4.一定温度下,某物质的饱和溶液一定是( )A.不能继续溶解该物质的溶液B.浓溶液C.不能继续溶解其他任何溶质的溶液D.稀溶液5.【2022·吉林模拟】下列溶液一定是该温度下的饱和溶液的是( )A.①B.②C.③D.④6.【2023·重庆模拟】要使不饱和溶液变成饱和溶液,下面的方法中一定可行的是( ) A.加溶剂 B.加溶质C.升高温度 D.降低温度7.【2023·聊城期末改编】下列关于溶液的叙述正确的是( )A.溶液是均一、稳定的化合物B.浓溶液不一定是饱和溶液C.稀溶液一定是不饱和溶液D.饱和溶液就是不能再继续溶解任何溶质的溶液二、能力提升8.【2023·苏州】向5 mL碘的水溶液(黄色)中加入2 mL汽油(无色),振荡后静置,实验现象如图所示。
由该实验不能得出的结论是( )A.汽油的密度比水小,且难溶于水B.汽油易挥发,沸点比水低C.碘在汽油中的溶解性比在水中强D.碘在不同溶剂中形成的溶液颜色可能不同9.氢氧化钙的溶解能力随温度的升高而减小。
把一瓶接近饱和的石灰水变成饱和溶液的具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水;⑥通入少量CO2气体。
其中正确的是( )A.①②④ B.①③④ C.③⑤⑥ D.①②⑤10.【2023·郴州模拟】室温时,取一定质量的氯化钠固体放入烧杯中,按图所示加水并搅拌,使之充分溶解。
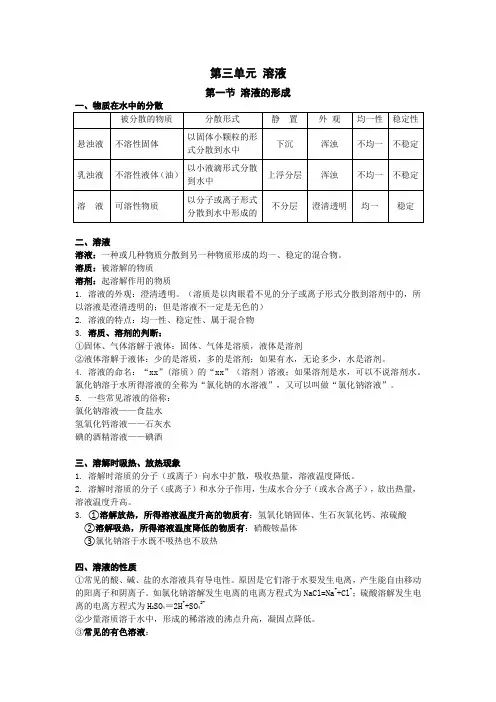
第三单元溶液第一节溶液的形成一、物质在水中的分散二、溶液溶液:一种或几种物质分散到另一种物质形成的均一、稳定的混合物。
溶质:被溶解的物质溶剂:起溶解作用的物质1.溶液的外观:澄清透明。
(溶质是以肉眼看不见的分子或离子形式分散到溶剂中的,所以溶液是澄清透明的;但是溶液不一定是无色的)2.溶液的特点:均一性、稳定性、属于混合物3.溶质、溶剂的判断:①固体、气体溶解于液体:固体、气体是溶质,液体是溶剂②液体溶解于液体:少的是溶质,多的是溶剂;如果有水,无论多少,水是溶剂。
4.溶液的命名:“xx”(溶质)的“xx”(溶剂)溶液;如果溶剂是水,可以不说溶剂水。
氯化钠溶于水所得溶液的全称为“氯化钠的水溶液”,又可以叫做“氯化钠溶液”。
5.一些常见溶液的俗称:氯化钠溶液——食盐水氢氧化钙溶液——石灰水碘的酒精溶液——碘酒三、溶解时吸热、放热现象1.溶解时溶质的分子(或离子)向水中扩散,吸收热量,溶液温度降低。
2.溶解时溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量,溶液温度升高。
3.①溶解放热,所得溶液温度升高的物质有:氢氧化钠固体、生石灰氧化钙、浓硫酸②溶解吸热,所得溶液温度降低的物质有:硝酸铵晶体③氯化钠溶于水既不吸热也不放热四、溶液的性质①常见的酸、碱、盐的水溶液具有导电性。
原因是它们溶于水要发生电离,产生能自由移动的阳离子和阴离子。
如氯化钠溶解发生电离的电离方程式为NaCl=Na++Cl-;硫酸溶解发生电离的电离方程式为H2SO4=2H++SO42-②少量溶质溶于水中,形成的稀溶液的沸点升高,凝固点降低。
③常见的有色溶液:蓝色溶液(含Cu 2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液浅绿色溶液(含Fe 2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液黄色溶液(含Fe 3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液 紫红色溶液:高锰酸钾溶液 紫色溶液:石蕊溶液五、饱和溶液与不饱和溶液1. 定义:在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。

溶液第一节溶液的形成课标要求:认识溶解现象,知道溶液是由溶质和溶剂组成的;知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂;知道水溶液中溶质是以分子或离子存在的;了解饱和溶液的含义;能进行溶质质量分数的简单计算;认识溶质质量分数的含义,能配制一定溶质质量分数的溶液;能说出一些常见的乳化现象;了解溶液在生产、生活中的重要意义。
内容和学情分析:本单元内容主要涉及“什么是溶液?”、“溶液是怎样形成的?”、“溶液组成如何表示?”、“如何配制一定组成的溶液?”等四个问题。
学生对于溶液的知识并不陌生,他们不仅在生活中接触并使用到溶液,在实验室中也用到过溶液,如盐酸、硫酸、氢氧化钠、硫酸铜溶液等。
对溶液有一定的感性认识,从心理上和知识背景上都具备了学习本课题的条件,但他们对溶液的认识仍是感性的、不具体的,甚至还存在着“迷思概念”现象。
对溶液在化学研究中的重要性、溶液在生命活动中、在工农业生产和日常生活中的作用和用途的了解还是远远不够的。
学习建议:根据设置的情境,从自己熟悉的溶液入手,通过实验探究、讨论及观察,借助溶解动画视频,从宏观和微观两个维度认识溶解现象得出溶液的特征及概念,分析溶解过程中通常都伴随能量变化。
联系生活常识,通过实验观察,认识乳化现象。
学习目标:知识与技能:1.认识溶解现象,知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂。
知道水溶液中溶质是以分子或离子存在的。
2.了解饱和溶液的含义,学会饱和和不饱和溶液之间的相互转化。
3.能说出一些常见的乳化现象。
过程与方法:1.能进行溶质质量分数的简单计算。
2.初步学会配制一定溶质质量分数的溶液。
情感态度与价值观:1.了解溶液在生产、生活中的重要意义。
知识点(重点、难点):重点是理解溶液的概念,知道溶液的基本特征;能辨别常见溶液中的溶质、溶剂。
难点是从微观角度解释溶液的形成过程及溶解过程中的能量变化。
实验准备:多媒体;烧杯(50ml)3只,试管2支,玻璃棒、温度计、药匙、胶头滴管;食盐固体、氢氧化钠、硝酸铵、汽油、植物油、洗洁精。


初三化学鲁教版第三单元《溶液》单元教学设计《初三化学鲁教版第三单元《溶液》单元教学设计》这是优秀的教学设计文章,希望可以对您的学习工作中带来帮助!作业内容初三化学鲁教版第三单元《溶液》单元教学设计所需时课内共用6课时,每周三课时;课外共用2课间主题单元学习概述本单元的教学核心内容,隶属于课程标准中第五个“一级主题”------“身边的化学物质”中主要内容之一。
本单元教学意在帮助学生认识一类均匀的混合物——溶液的组成特征及其定量表示方法和配制方法,并同时体会在科学上是按照怎样的思路来认识的。
内容涉及溶液的概念、形成、表示、配制四个方面。
学生通过探究的过程中养成科学的态度、获得科学的方法、提高实验的技能。
本主题单元内容来源于鲁教版教材九年级上册课本第三单元。
该主题单元共分为以下三个专题:专题一:溶液的形成。
学生能初步认识溶液的组成及溶液的重要特征;通过亲历科学探究的过程深化对溶液知识的理解,进一步构建物质之间相互溶解的微观本质;并能初步运用科学探究的的方法解决一些化学问题。
专题二:溶液组成的定量表示。
了解表示溶液组成的几种方法;会进行有关溶液溶质质量分数的基本计算,进一步加深对概念的理解。
专题三:配制一定溶质质量分数的溶液。
学生初步学会配制溶液的实验方法,并且巩固和熟练一些基本实验操作的方法如托盘天平、量筒等使用。
本主题单元的教学重点:溶液、饱和溶液、不饱和溶液的概念理解;饱和溶液与不饱和溶液的转化方法;溶质质量分数的计算;配置一定质量分数的溶液。
主要的学习方式:实验探究、自主学习与合作学习等。
预期教学成果:探究实验报告、思维导图、课堂综合检测、溶液在工农业生产和生活中的应用调查报告、各类洗涤剂及其作用归类。
主题单元规划思维导图主题单元学习目标知识与技能:(1)知道溶质、溶剂的概念,理解溶液的概念;(2)了解物质溶解的微观实质;(3)了解影响溶解的因素;(4)理解饱和、不饱和溶液的概念。
过程与方法:(1)通过丰富的探究实验,培养学生的动手操作、比较推理、表述等能力。



精心整理初中化学九年级鲁教版《物质的溶解性》说课稿开场白:各位评委好,我是XXX 号考生,今天我说课题目是《物质的溶解性》,下面开始我的说课,根据新课标理论我将以教什么,怎样教,为什么这样教为设计思路,从教材分析,学情分析,教学目标,教学重难点等几个方面进行说明,首先说一下我对教材的认识。
一、说教材《物质的溶解性》是鲁教版初中化学九年级全一册第1单元第3节的内容。
本节课主在前两节的基础上,定量研 1. 2.了解溶解度和溶解性的区别和联系。
【过程与方法】进一步练习给试管里的液体加热、向试管里滴加液体和振荡试管的操作;培养学生设计简单实验步骤的能力。
【情感态度与价值观】从影响溶解度的诸因素中,对学生进行内因和外因的辩证唯物主义教育。
过渡:下面我再说一下本节课的教学重难点。
四、说教学重难点【重点】1、理解溶解度的概念及溶解度曲线的作用2、知道影响固体物质溶解度的因素【难点】建立溶解度的概念及溶解度曲线的相关应用。
水)制得了量?(1)液的试管,在酒精灯上先均匀加热,然后加热液体。
观察试管里的固体是否溶解。
如果固体溶解了,就停止加热。
然后按大家提出的实验方法,进行实验。
蒸馏水各5克、硝酸钾、熟石灰各准备了一克完成实验一;实验二中准备了5克蒸馏水,2克硝酸钾。
仪器、药品先检查是否齐全,然后开始实验。
学生观察现象并得出结论:实验一中硝酸钾全部溶解,熟石灰不能完全溶解,说明固体物质的种类不同,他们在水中的溶解限量不同。
实验二中给盛有硝酸钾饱和溶液的试管加热,不久,试管里剩余的固体硝酸钾又溶解了。
说明加热可以使饱和溶液变成不饱和溶液,能增加硝酸钾的溶解限量。
从而得出溶解度的概念,要强调溶剂和温度的影响。
此环节利用学生的好奇心理,灵活拓展教材实验探究2-3,设计为层层递进的探究活动,让学生在不断被追问下不断被调动思维,大胆猜想,小心求证,不断反思改进实验设计,由特殊上升到一般,学会多角度考虑问题。
(2)溶解度曲线的认识和应用学生自行看课本上的溶解度曲线图,然后讨论回答观察到的信息:①能找出同一物质在不同温度下的溶解度;②不同物质在同一温度下的溶解度;③物质的溶解度受温度的影响如何变化;④两物质相交的点表示同一温度下两物质的溶解度相同。

《溶液的形成》教学设计(第一课时)一、教学内容人教版九年级化学下册第九单元《溶液》课题1溶液的形成第一课时二、教学目标1、知识与技能:(1)、掌握溶液、溶质、溶剂等概念,认识溶液的基本特征是均一性和稳定性。
(2)、认识溶解现象,知道水是重要的溶剂,酒精、汽油等也是常见的溶剂。
(3)、能判断溶液中的溶质、溶剂,了解溶液在生产、生活中的意义。
2、过程与方法:通过问题讨论和实验探究,观察、记录和分析实验现象,学会学习科学探究和科学实验的方法。
3、情感态度和价值观:激发学生的学习兴趣和探究的意识,学会辩证地看问题的思维方法,培养学生独立思考和合作学习的能力。
三、教学重点、难点1、重点:建立有关溶液的概念,认识溶液、溶质和溶剂三者的关系。
2、难点:对溶解过程的微观认识。
四、教学流程:1、新课导入【情境创设】展示多媒体“旋转的地球”、“海洋的图片”、“海水为什么是咸的”,激发学生的兴趣和求知欲,带着兴奋的情绪进入本节课的学习。
这样从学生感兴趣的问题和实验入手,有利于迅速集中注意力,激发了学生探究的欲望,也将学生引入到了愉快的学习中去。
【提出问题】:为什么说海洋是一个丰富的资源宝库?海水为什么是咸的?海水里含有80多种元素,你是如何理解的?在学生的讨论中引入溶液的概念。
学生激趣、感知,带着兴奋的情绪进入本节课的学习。
2、引导探究在日常生产和生活中,人们常常要将物质与水混合,来满足生产和生活的需要,例如用氯化钠溶于水配成盐水来选种;将碘分散到酒精中制成碘酒;将农药分散到水中形成喷洒的药液等,除此之外你还知道那些?【活动与探究】实验9-1溶液的形成(在教材提供的演示实验1蔗糖的溶解基础上,再增设学生实验2食盐的溶解进行对比,这样有助于学生对溶液基本特征的理解)将食盐分别放入烧杯中,加适量的水充分搅拌溶解,静置观察现象。
然后,与教师的演示实验现象对比。
【引导】(1)、引导学生观察、记录、分析实验现象。
分析讨论实验1、2中溶液的形成过程,组织学(2)、溶剂、溶液的概念及溶液的基本特征。
鲁教版(五四制)九年级化学1.3 物质的溶解性知识梳理一、溶解度新知学习1.固体溶解度的概念:在_一定温度_下,某固体物质在__100g溶剂(通常为水)__里达到__饱和_状态时所溶解的质量。
(1)通常所说的溶解度是指物质在__水_里的溶解度。
溶解度实质上是溶质的质量。
(2)溶解度四要素:①条件__一定温度__;②标准__100g溶剂__;③状态__饱和___;④单位__克__。
2.固体溶解度的涵义:(1)讨论:在20℃时,氯化钠的溶解度是36g,这句话的涵义。
在20℃时,硝酸钾的溶解度是31.6g。
此时硝酸钾溶液中溶质质量__31.6_g,溶剂质量__100__g,溶液质量__131.6_g,该溶液为___饱和 _(填“饱和”或“不饱和”)溶液。
(2)氯化钾在30℃时的溶解度是37g,则此温度下配制得的饱和溶液中,溶质、溶剂、溶液三者间的质量比为____37:100:137___。
二、溶解度曲线1.阅读课本查找:20℃时,NaCl的溶解度35g;60℃时,KNO3的溶解度110 g。
2.什么叫溶解度曲线?溶解度曲线:用纵坐标表示__溶解度__,横坐标表示_温度__,根据物质在不同温度下的溶解度绘制成不同物质随_温度__变化的曲线。
3.仔细观察课本图片,我们从溶解度曲线中可以得到哪些信息?(1)可以查出某一物质在不同___温度__下的溶解度;(2)比较不同物质在同一__温度__的溶解度;(3)曲线的交点表示该温度下的溶解度___相同___;(4)物质的溶解度受__温度_变化影响的大小。
4.溶解度曲线的涵义:(1)三线:①“陡升型”:大多数固体物的溶解度随温度升高而_增大_。
如KNO3;②“缓升型”:少数固体物质的溶解度受温度的影响很小。
如_NaCl_;③“下降型”:极少数物质溶解度随温度升高而降低。
如_Ca(OH)2_。
(2)四点:①曲线上的点:所示某温度下某物质的溶解度(该温度下_饱和_状态)。
初中鲁教版化学溶液教案
一、教材版本:鲁教版初中化学教材
二、教学内容:溶液的概念和性质
三、教学目标:通过学习,学生能够了解溶液的基本概念、分类以及性质,并能够运用所学知识解决相关问题。
四、教学重点和难点:溶液的概念和性质,了解溶液的分类,掌握不同溶液的性质区别。
五、教学过程:
1.导入:通过展示溶解现象的图片或视频引起学生的兴趣,让学生讨论并总结实验中的观察结果。
2.讲解:介绍溶液的概念和种类,分为饱和溶液、过饱和溶液和稀溶液。
并讲解溶解、溶解度、溶质和溶剂等相关术语。
3.实验:设计一个简单的实验,比如将糖搅拌到水中,观察糖是否完全溶解。
通过实验,学生可以亲自探究溶解的过程。
4.讨论:组织学生讨论不同溶液的特点和性质,比如饱和溶液的饱和度,过饱和溶液的不稳定性等。
5.巩固:布置练习题,让学生运用所学知识解决问题,加深对溶液的理解。
六、教学评价:观察学生在实验和讨论环节的表现,评价学生对溶液概念的理解和掌握情况。
七、课后拓展:提供更多实验和案例,让学生进一步探究溶液的特性和应用。
同时要求学生积极思考和总结,提高对知识的理解和运用能力。
第一课时:物质在水中的溶解一、情境导入:镇上有一家洗衣店,有一天,化工厂的一名工人拿了一批工作服来清洗。
工作服上的污渍主要有氯化钠、蔗糖、润滑油、碘等。
假如你是洗衣店的工作人员,你打算怎样清洗这批工作服呢?学生讨论,交流答案。
教师总结。
衣服上的氯化钠、蔗糖,很容易洗去,但油污和碘却不容易清除,大部分同学都不知道怎么清除这些物质,对这方面的知识还不是很明白。
今天我们就来学习《物质在水中的溶解》,学习了本节课,我们就可以轻而易举的解决这些问题了。
二、明确目标:学优中考网xYzKw]本节课的学习目标:1、知道什么是溶液及溶液的基本特征。
并能够分辨典型溶液中的溶质和溶剂。
2、了解溶质溶解的过程。
了解电离的概念。
3、知道一些常见的乳化现象。
体会化学知识在生活中的应用,增强热爱化学、热爱生活的情感。
三、依标导学:同学们在家里都洗过衣服吧?洗衣服时,你用到的最主要的物质是什么?(水)你认为水起到什么作用呢?(溶解)我们回到故事情境中,进行——→活动探究一。
工作服上的污渍主要有氯化钠、蔗糖、润滑油、碘等。
这批衣服上的污渍都能用水洗去吗?(学生讨论,交流)学生实验一:我们来进行一组小实验,同学们分组合作,共同探究。
分别将食盐、泥沙、植物油、蔗糖和硫酸铜五种物质溶于水中,并认真观察、描述实验现象。
(学生实验)学生交流实验现象:xYzKw食盐、蔗糖和硫酸铜这三种物质可以溶解在水中;植物油浮在水面上,形成上下两层;泥沙不溶于水,沉淀在试管底部,也形成上下两层。
通过刚才的小实验,我们可以了解到工作服上的哪些物质可以用水洗去呢?学优中考网xYzkw](氯化钠和蔗糖能够用水洗去,它们都能溶于水。
)食盐、蔗糖和硫酸铜能够溶解在水中,它们是怎样溶解的呢?我们从微观角度来观察一下。
——→并由此引导出电离的有关知识。
刚才的小实验,我们还可以发现植物油不能溶解在水中。
也就是说工作服上的润滑油和碘不能用水洗去。
用水不能洗去的污渍怎么办呢?我们一起来了解一下。
《物质的溶解性》导学案(第1课时)学习目标:1、通过分析生活中的相关现象和老师的点拨,了解溶解性的概念,感受影响物质溶解性的因素。
2、通过老师的讲解,了解固体的溶解度概念。
3、培养学生积极参与实验探究解决问题的良好习惯。
4、通过练习,巩固溶解性和溶解度两个概念。
学习过程探究影响物质溶解性的因素【活动探究一】活动1:影响溶解性的因素:⑴分组做投影片中的3个活动与探究,后填空:实验1 该实验中所用溶剂(填“相同”“不同”),溶质,根据溶解情况得出的结论是。
实验2该实验中所用溶剂(填“相同”“不同”),溶质,实验现象是食用油溶解于中,不能溶解于中,由此得出的结论是。
实验3 该实验中现象:第一次加的硝酸钾溶解(填“全部”“部分”),第二次加的硝酸钾溶解,两次实验中不同点是,这可以得出的结论是。
⑵应用:从生活中举例说明物质的溶解性与溶质和溶剂的性质有关,同时也受温度的影响。
学生归纳:影响物质溶解性的因素:外因:。
内因:。
4、物质溶解性的应用提出问题:你知道毛料衣物干洗的原理吗?教师简介生活中物质溶解性的应用、简介一些有机溶剂。
【活动探究二】活动1:溶解度的概念⑴阅读P14填空:溶解性只能笼统地表示物质溶解能力的大小,为了定量地描述物质的溶解性的强弱,我们用来表示。
固体物质的溶解度是指,该定义中强调出溶解度的条件,标准,状态,单位。
⑵阅读填空:由表中内容可知,不同物质在同一温度同一溶剂中的溶解度(填“相同”“不同”),溶解度最小的物质是。
“20℃时,氯化钠的溶解度是36克”的含义是,如果该温度下,溶剂量为50克,则最多可溶解氯化钠克,配成饱和溶液克;如果该温度下,某氯化钠饱和溶液272克,则含有溶剂克,氯化钠克。
⑶练习:判断下列说法对错:①硝酸钾的溶解度为31.6克。
②硝酸钾溶液在20℃时的溶解度是31.6克。
③硝酸钾在20℃时的溶解度是31.6。
④硝酸钾在20℃时的溶解度是31.6克。
⑤在20℃时,100克水中溶解了10克氯化钠,则氯化钠的溶解度为10克。