埃索美拉唑市场分析(2012年销售数据)
- 格式:doc
- 大小:149.50 KB
- 文档页数:3

受理号码药品名称药品类型申请类型注册分类CXHL1200180磷酸二甲啡烷颗粒化药新药 3.1CXHL1200178磷酸二甲啡烷化药新药 3.1CXHL1200179磷酸二甲啡烷片化药新药 3.1CXHL1200109盐酸头孢替安酯片化药新药 3.1CXHL1200108盐酸头孢替安酯片化药新药 3.1CXHL1200107盐酸头孢替安酯化药新药 3.1CXHL1200405苯甲酸阿格列汀片化药新药 3.1CXHL1200403苯甲酸阿格列汀化药新药 3.1CXHL1200404苯甲酸阿格列汀片化药新药 3.14CXHS1200143盐酸头孢卡品匹酯片化药新药 3.15CXHS1200121瑞舒伐他汀钙胶囊化药新药 3.1CXHL1200196西他沙星化药新药 3.1CXHL1200197西他沙星片化药新药 3.1CXHL1200176罗氟司特化药新药 3.1CXHL1200177罗氟司特片化药新药 3.1CXHL1100809注射用福沙吡坦二甲葡胺化药新药 3.1CXHL1100808福沙吡坦二甲葡胺化药新药 3.1CXHL1100810注射用福沙吡坦二甲葡胺化药新药 3.1CXHL1100822头孢妥仑匹酯颗粒化药新药 3.1CXHL1100823头孢妥仑匹酯颗粒化药新药 3.1CXHL1100824头孢妥仑匹酯颗粒化药新药 3.1CXHL1100811盐酸头孢卡品匹酯颗粒化药新药 3.1CXHL1100812盐酸头孢卡品匹酯颗粒化药新药 3.1CXHL1100648注射用多尼培南化药新药 3.1CXHL1100649注射用多尼培南化药新药 3.1CXHL1100647多尼培南化药新药 3.1CXHL1100712帕拉米韦化药新药 3.1CXHL1100713帕拉米韦注射液化药新药 3.1CXHL1100408L-α-甘油磷酰胆碱注射液化药新药 3.1CXHL1100407L-α-甘油磷酰胆碱化药新药 3.1受理号码药品名称药品类型申请类型注册分类CXHL1200678琥珀酸索利那新化药新药 3.1CXHL1200679琥珀酸索利那新口腔崩解片化药新药 3.1CXHL1200680琥珀酸索利那新口腔崩解片化药新药 3.1CXHL1200730利马前列素片化药新药 3.1CXHL1200731利马前列素阿法环糊精化药新药 3.1CXHL1200505丁酸氯维地平化药新药 3.1CXHL1200507丁酸氯维地平注射用乳剂化药新药 3.1CXHL1200506丁酸氯维地平注射用乳剂化药新药 3.14CXHS1200216度他雄胺化药新药 3.15CXHS1200191钆特酸葡胺化药新药 3.1CXHS1200233达托霉素化药新药 3.1CXHS1200157达托霉素化药新药 3.17CXHL1200382阿齐沙坦化药新药 3.18CXHS1200155钆布醇化药新药 3.1CXHL1200384阿齐沙坦片化药新药 3.1CXHL1200383阿齐沙坦片化药新药 3.19CXHS1200093碘化油(乙酯)化药新药 3.14山东罗欣药业股份有限公司110111278923671236江苏恒瑞医药股份有限公司从2012年1月至今共20个受理号11个品种,2月至今共17个受理号9个CXHL1100727罗氟司特化药新药 3.1CXHL1100728罗氟司特片化药新药 3.111CXHL1100633普瑞巴林化药新药 3.1受理号码药品名称药品类型申请类型注册分类CXHL1200606琥珀酸普卡必利片化药新药 3.1CXHL1200604琥珀酸普卡必利化药新药 3.1CXHL1200605琥珀酸普卡必利片化药新药 3.1CXHL1200475瑞替加滨化药新药 3.1CXHL1200476瑞替加滨片化药新药 3.1CXHL1200478瑞替加滨片化药新药 3.1CXHL1200477瑞替加滨片化药新药 3.1CXHL1200465阿齐沙坦化药新药 3.1CXHL1200466阿齐沙坦片化药新药 3.1CXHL1200467阿齐沙坦片化药新药 3.1CXHL1200244帕拉米韦三水合物注射液化药新药 3.1CXHL1200243帕拉米韦三水合物化药新药 3.1CXHL1200354替比培南酯颗粒化药新药 3.1CXHL1200353替比培南酯化药新药 3.1CXHL1200313盐酸西那卡塞片化药新药 3.1CXHL1200312盐酸西那卡塞化药新药 3.1CXHL1200314盐酸西那卡塞片化药新药 3.1CXHL1100742群多普利化药新药 3.1CXHL1100744群多普利片化药新药 3.1CXHL1100743群多普利片化药新药 3.1CXHL1100739右旋雷贝拉唑钠化药新药 3.1CXHL1100741右旋雷贝拉唑钠肠溶片化药新药 3.1CXHL1100740右旋雷贝拉唑钠肠溶片化药新药 3.1CXHL1100681盐酸芬戈莫德化药新药 3.1CXHL1100682盐酸芬戈莫德胶囊化药新药 3.1受理号码药品名称药品类型申请类型注册分类1CXHS1200205达沙替尼化药新药 3.12CXHL1200533盐酸鲁拉西酮化药新药 3.13CXHS1200129富马酸替诺福韦二吡呋酯化药新药 3.14CXHS1200122甲磺酸伊马替尼化药新药 3.15CXHS1200074利奈唑胺化药新药 3.16CXHL1200249苯甲酸阿格列汀化药新药 3.17CXHL1200074醋酸阿比特龙化药新药 3.18CXHL1200039罗氟司特化药新药 3.1受理号码药品名称药品类型申请类型注册分类1CXHS1200296盐酸厄洛替尼化药新药 3.12CXHL1200601盐酸维拉佐酮化药新药 3.13CXHL1200704琥珀酸普卡必利化药新药 3.14CXHS1200189依折麦布化药新药 3.15CXHL1200388福沙匹坦二甲葡胺化药新药 3.1江苏豪森医药集团连云港宏创医药有限公司,受理8个,品种8个91234587106南京华威医药科技开发有限公司从2012年1月至今共25个受理号,9个品种连云港润众制药有限公司,受理8个,品种8个6CXHS1200156安立生坦化药新药 3.17CXHS1200047利奈唑胺化药新药 3.18CXHS1100251比伐卢定化药新药 3.1受理号码药品名称药品类型申请类型注册分类CXHL1200499米诺膦酸化药新药 3.1CXHL1200500米诺膦酸片化药新药 3.1CXHL1200515盐酸西那卡塞片化药新药 3.1CXHL1200514盐酸西那卡塞片化药新药 3.1CXHL1200513盐酸西那卡塞化药新药 3.1CXHL1200448咪达那新化药新药 3.1CXHL1200449咪达那新片化药新药 3.14CXHL1200418罗氟司特胶囊化药新药 3.1CXHL1200343非布司他胶囊化药新药 3.1CXHL1200345非布司他胶囊化药新药 3.1CXHL1200344非布司他胶囊化药新药 3.1CXHL1200230罗氟司特片化药新药 3.1CXHL1200229罗氟司特化药新药 3.1CXHL1200153左亚叶酸注射液化药新药 3.1CXHL1100615注射用左亚叶酸化药新药 3.1CXHL1100616注射用左亚叶酸化药新药 3.1CXHL1100613左亚叶酸化药新药 3.1受理号码药品名称药品类型申请类型注册分类1CXHS1200183盐酸莫西沙星化药新药 3.1CXHL1200463二盐酸组胺注射液化药新药 3.1CXHL1200462二盐酸组胺化药新药 3.13CXHL1200399依维莫司片化药新药 3.1CXHL1200398S-泮托拉唑钠肠溶片化药新药 3.1CXHL1200397S-泮托拉唑钠肠溶片化药新药 3.1CXHL1200396S-泮托拉唑钠化药新药 3.13CXHL1200400依维莫司片化药新药 3.1CXHL1200203醋酸阿比特龙片化药新药 3.1CXHL1200202醋酸阿比特龙化药新药 3.1CXHL1200102依维莫司片化药新药 3.1CXHL1200103依维莫司片化药新药 3.1CXHS1100263噻托溴铵化药新药 3.1CXHS1100264噻托溴铵粉雾剂化药新药 3.1CXHL1200416罗氟司特化药新药 3.1CXHL1200417罗氟司特片化药新药 3.1CXHL1200351盐酸决奈达隆片化药新药 3.1CXHL1200350盐酸决奈达隆化药新药 3.13CXHL1100817甲磺酸依普沙坦化药新药 3.1CXHL1200186盐酸鲁拉西酮化药新药 3.1CXHL1200188盐酸鲁拉西酮片化药新药 3.1CXHL1200187盐酸鲁拉西酮片化药新药 3.1CXHL1100558米诺膦酸化药新药 3.11245山东创新药物研发有限公司山东新时代药业有限公司24536南京海纳医药科技有限公司123654CXHL1100559米诺膦酸片化药新药 3.1CXHL1100540盐酸头孢替安酯片化药新药 3.1CXHL1100538盐酸头孢替安酯化药新药3.1CXHL1100539盐酸头孢替安酯片化药新药 3.1CXHS1200212注射用头孢替坦二钠化药新药 3.1CXHS1200211注射用头孢替坦二钠化药新药 3.1CXHS1200210注射用头孢替坦二钠化药新药 3.12CXHS1200104扎鲁司特化药新药 3.1CXHL1200189阿托伐他汀锶化药新药 3.1CXHL1200190阿托伐他汀锶片化药新药 3.1CXHL1100517西他沙星化药新药 3.1CXHL1100518西他沙星片化药新药 3.1CXHS1100174瑞舒伐他汀钙胶囊化药新药 3.1CXHS1100173瑞舒伐他汀钙胶囊化药新药 3.1CXHL1100377头孢拉宗钠化药新药 3.1CXHL1100378注射用头孢拉宗钠化药新药 3.1受理号码药品名称药品类型申请类型注册分类CXHS1200206达沙替尼片化药新药 3.1CXHS1200207达沙替尼片化药新药 3.1CXHS1200208达沙替尼片化药新药 3.12CXHS1200204盐酸帕洛诺司琼胶囊化药新药 3.13CXHL1200534盐酸鲁拉西酮片化药新药 3.1CXHL1200251苯甲酸阿格列汀片化药新药 3.1CXHL1200250苯甲酸阿格列汀片化药新药 3.15CXHL1200075醋酸阿比特龙片化药新药 3.16CXHL1200040罗氟司特片化药新药 3.1受理号码药品名称药品类型申请类型注册分类CXHL1200694米诺膦酸化药新药 3.1CXHL1200696米诺膦酸片化药新药 3.1CXHL1200695米诺膦酸片化药新药 3.1CXHL1200491咪达那新化药新药 3.1CXHL1200492咪达那新片化药新药 3.1CXHL1200283替比培南匹伏酯颗粒化药新药 3.1CXHL1200282替比培南匹伏酯化药新药 3.1CXHL1200281拉科酰胺片化药新药 3.1CXHL1200280拉科酰胺片化药新药 3.1CXHL1200279拉科酰胺化药新药 3.1CXHL1100683西洛多辛化药新药 3.1CXHL1100684西洛多辛片化药新药 3.1受理号码药品名称药品类型申请类型注册分类CXHL1200558埃索美拉唑镁化药新药 3.1CXHL1200437雷美替胺化药新药 3.1134456江苏正大天晴药业股份有限公司156陕西步长制药有限公司天津市汉康医药生物技术有限公司CXHL1200438雷美替胺片化药新药 3.1CXHL1200393醋酸艾司利卡西平化药新药 3.1CXHL1200394醋酸艾司利卡西平片化药新药 3.1CXHL1200125盐酸鲁拉西酮化药新药 3.1CXHL1200126盐酸鲁拉西酮片化药新药 3.1CXHL1200094咪达那新片化药新药 3.1CXHL1200093咪达那新化药新药 3.1CXHL1200027非布司他胶囊化药新药 3.1CXHL1200028非布司他胶囊化药新药 3.1北京阳光诺和药物研究有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200348盐酸鲁拉西酮片化药新药 3.1CXHL1200347盐酸鲁拉西酮化药新药 3.1CXHL1200349盐酸鲁拉西酮片化药新药 3.1CXHL1200029罗氟司特化药新药 3.1CXHL1200030罗氟司特片化药新药 3.1CXHL1200013苹果酸阿莫曲坦化药新药 3.1CXHL1200014苹果酸阿莫曲坦片化药新药 3.1CXHL1100707富马酸替诺福韦二吡呋酯化药新药 3.1CXHL1100440替比培南酯化药新药 3.1CXHL1100441替比培南酯颗粒化药新药 3.1重庆圣华曦药业股份有限公司受理号码药品名称药品类型申请类型注册分类CXHS1200282左乙拉西坦化药新药 3.1CXHS1200179盐酸美利曲辛化药新药 3.1CXHS1200178盐酸氟哌噻吨化药新药 3.1CXHL1200390盐酸头孢替安酯化药新药 3.1CXHL1200391盐酸头孢替安酯片化药新药 3.1CXHL1200143左乙拉西坦注射液化药新药 3.1CXHS1200050甲磺酸依普沙坦化药新药 3.1山东京卫制药有限公司受理号码药品名称药品类型申请类型注册分类CXHS1200130阿戈美拉汀化药新药 3.1CXHL1200336硝酸硫康唑乳膏化药新药 3.1CXHS1100258美他沙酮化药新药 3.1CXHS1100278马来酸氟吡汀化药新药 3.1CXHS1100093法罗培南钠化药新药 3.1合肥信风科技开发有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200439来那度胺化药新药 3.1CXHL1200442来那度胺胶囊化药新药 3.1CXHL1200441来那度胺胶囊化药新药 3.1CXHL1200440来那度胺胶囊化药新药 3.1CXHL1200359布南色林化药新药 3.1CXHL1200362布南色林片化药新药 3.1CXHL1200163罗氟司特化药新药 3.1CXHL1200164罗氟司特片化药新药 3.1CXHL1100778非布司他化药新药 3.1CXHL1100779非布司他片化药新药 3.1CXHL1100780非布司他片化药新药 3.1郑州大明药物科技有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200542醋酸氟卡胺化药新药 3.1CXHL1200540尼替西农化药新药 3.1CXHL1200541尼替西农胶囊化药新药 3.1CXHL1200544醋酸氟卡胺片化药新药 3.1CXHL1200543醋酸氟卡胺片化药新药 3.1CXHL1200171盐酸胍法辛化药新药 3.1CXHL1200173盐酸胍法辛片化药新药 3.1CXHL1200172盐酸胍法辛片化药新药 3.1北京赛科药业有限责任公司受理号码药品名称药品类型申请类型注册分类CXHL1200009苯甲酸阿洛利停化药新药 3.1CXHL1200008罗氟司特片化药新药 3.1CXHL1200007罗氟司特化药新药 3.1CXHL1200012苯甲酸阿洛利停片化药新药 3.1CXHL1200011苯甲酸阿洛利停片化药新药 3.1CXHL1200010苯甲酸阿洛利停片化药新药 3.1CXHL1100787卢非酰胺片化药新药 3.1CXHL1100792卢非酰胺化药新药 3.1北京福瑞康正医药技术研究所受理号码药品名称药品类型申请类型注册分类CXHL1200516盐酸芬戈莫德化药新药 3.1CXHL1200517盐酸芬戈莫德胶囊化药新药 3.1CXHL1200366盐酸决奈达隆片化药新药 3.1CXHL1200365盐酸决奈达隆化药新药 3.1CXHL1200098二盐酸组胺注射液化药新药 3.1CXHL1200097二盐酸组胺化药新药 3.1CXHL1100557醋酸乌利司他化药新药 3.1CXHL1100556醋酸乌利司他片化药新药 3.1江苏豪森药业股份有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200603盐酸维拉佐酮片化药新药 3.1CXHL1200602盐酸维拉佐酮片化药新药 3.1CXHL1200706琥珀酸普卡必利片化药新药 3.1CXHL1200705琥珀酸普卡必利片化药新药 3.1CXHL1200387注射用福沙匹坦二甲葡胺化药新药 3.1CXHL1200389注射用福沙匹坦二甲葡胺化药新药 3.1CXHS1100252注射用比伐卢定化药新药 3.1重庆华邦胜凯制药有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200301罗氟司特化药新药 3.1CXHS1200072卤米松化药新药 3.1CXHS1200006利奈唑胺化药新药 3.1CXHS1100246盐酸帕洛诺司琼化药新药 3.1四川百利药业有限责任公司受理号码药品名称药品类型申请类型注册分类CXHL1200033盐酸马尼地平化药新药 3.1CXHL1200191英加韦林胶囊化药新药 3.1CXHL1100749盐酸地拉普利化药新药 3.1CXHL1100748盐酸地拉普利片化药新药 3.1CXHL1100710英加韦林化药新药 3.1CXHL1100711英加韦林胶囊化药新药 3.1济南百诺医药科技开发有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200518盐酸可乐定缓释片化药新药 3.1CXHL1200409咪达那新片化药新药 3.1CXHL1200408咪达那新化药新药 3.1CXHL1200142拉科酰胺片化药新药 3.1CXHL1200141拉科酰胺化药新药 3.1北京德众万全医药科技有限公司受理号码药品名称药品类型申请类型注册分类CXHL1100721甲磺酸雷沙吉兰片化药新药 3.1CXHL1100650米诺膦酸化药新药 3.1CXHL1100652米诺膦酸片化药新药 3.1CXHL1100546盐酸决奈达隆化药新药 3.1CXHL1100545盐酸决奈达隆片化药新药 3.1亿腾药业(泰州)有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200193醋酸阿比特龙化药新药 3.1CXHL1200194醋酸阿比特龙片化药新药 3.1CXHL1100653福沙匹坦二甲葡胺化药新药 3.1CXHL1100654注射用福沙匹坦二甲葡胺化药新药 3.1CXHL1100655注射用福沙匹坦二甲葡胺化药新药 3.1福建省福抗药业股份有限公司受理号码药品名称药品类型申请类型注册分类CXHS1200025盐酸头孢卡品酯化药新药 3.1CXHS1200026盐酸头孢卡品酯片化药新药 3.1CXHS1200022盐酸莫西沙星化药新药 3.1CXHS1100232盐酸美金刚化药新药 3.1齐鲁安替(临邑)制药有限公司受理号码药品名称药品类型申请类型注册分类CXHL1200563盐酸莫西沙星化药新药 3.1CXHS1200091盐酸厄洛替尼化药新药 3.1CXHS1200084吉非替尼化药新药 3.1江苏恩华药业股份有限公司受理号码药品名称药品类型申请类型注册分类CXHS1200169盐酸美利曲辛化药新药 3.1CXHS1200168盐酸氟哌噻吨化药新药 3.1CXHS1200166阿戈美拉汀化药新药 3.1北京四环科宝制药有限公司受理号码药品名称药品类型申请类型注册分类CXHS1200123氟曲马唑乳膏化药新药 3.1CXHS1100267注射用盐酸奥普力农化药新药 3.1CXHS1100266盐酸奥普力农注射液化药新药 3.1CXHL1200106拉科酰胺片化药新药 3.1承办日期办理状态状态开始时间2012-10-23在审评2012-10-16 2012-10-10在审评2012-10-8 2012-10-10在审评2012-10-8 2012-9-17在审评2012-9-14 2012-9-17在审评2012-9-14 2012-9-17在审评2012-9-14 2012-9-14在审评2012-9-13 2012-9-14在审评2012-9-13 2012-9-14在审评2012-9-13 2012-9-14在审评2012-9-13 2012-9-14在审评2012-9-13 2012-9-14在审评2012-9-13 2012-9-14在审评2012-9-13 2012-7-9在审评2012-7-5 2012-7-9在审评2012-7-5 2012-6-11在审评2012-6-8 2012-6-11在审评2012-6-8 2012-6-11在审评2012-6-8 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-5-24在审评2012-5-22 2012-4-6在审评2012-4-5 2012-4-6在审评2012-4-5 2012-2-23在审评2012-2-22 2012-2-23在审评2012-2-22承办日期办理状态状态开始时间2012-12-18在审评2012-12-17 2012-12-18在审评2012-12-17 2012-12-18在审评2012-12-17 2012-12-13在审评2012-12-12 2012-12-13在审评2012-12-12 2012-11-8在审评2012-11-1 2012-11-8在审评2012-11-1 2012-11-8在审评2012-11-1 2012-10-10在审评2012-9-29 2012-10-10在审评2012-9-29 2012-9-14在审评2012-9-13 2012-8-1在审评2012-7-30 2012-8-1在审评2012-7-30 2012-8-1在审评2012-7-30 2012-8-1在审评2012-7-30 2012-8-1在审评2012-7-30 2012-7-3在审评2012-6-292012-1-13在审评2012-1-11 2012-1-13在审评2012-1-11承办日期办理状态状态开始时间2012-10-23在审评2012-10-18 2012-10-23在审评2012-10-18 2012-10-23在审评2012-10-18 2012-8-22在审评2012-8-21 2012-8-22在审评2012-8-21 2012-8-22在审评2012-8-21 2012-8-22在审评2012-8-21 2012-8-22在审评2012-8-21 2012-8-22在审评2012-8-21 2012-8-22在审评2012-8-21 2012-7-18在审评2012-7-17 2012-7-18在审评2012-7-17 2012-7-11在审评2012-7-9 2012-7-11在审评2012-7-9 2012-7-11在审评2012-7-9 2012-7-11在审评2012-7-9 2012-7-11在审评2012-7-9 2012-3-1在审评2012-2-29 2012-3-1在审评2012-2-29 2012-3-1在审评2012-2-29 2012-2-14在审评2012-2-13 2012-2-14在审评2012-2-13 2012-2-14在审评2012-2-13 2012-1-11在审评2012-1-10 2012-1-11在审评2012-1-10承办日期办理状态状态开始时间2012-9-24在审评2012-9-20 2012-9-17在审评2012-9-13 2012-6-20在审评2012-6-19 2012-6-19在审评2012-6-18 2012-6-19在审评2012-6-18 2012-6-11在审评2012-6-7 2012-3-23在审评2012-3-23 2012-2-13在审评2012-2-82012-11-30在审评2012-11-29 2012-11-29在审评2012-11-27 2012-8-22在审评2012-8-21 2012-8-1在审评2012-7-302012-4-25在审评2012-4-24 2012-3-29在审评2012-3-28承办日期办理状态状态开始时间2012-11-9在审评2012-11-7 2012-11-8在审评2012-11-2 2012-10-23在审评2012-10-16 2012-10-23在审评2012-10-16 2012-10-23在审评2012-10-16 2012-9-20在审评2012-9-18 2012-9-20在审评2012-9-18 2012-8-14在审评2012-8-13 2012-7-18在审评2012-7-17 2012-7-18在审评2012-7-17 2012-7-18在审评2012-7-17 2012-6-19在审评2012-6-18 2012-6-19在审评2012-6-18 2012-5-8在审评2012-5-7 2012-1-4在审评2011-12-30 2012-1-4在审评2011-12-30 2012-1-4在审评2011-12-30承办日期办理状态状态开始时间2012-10-30在审评2012-10-29 2012-10-23在审评2012-10-16 2012-10-23在审评2012-10-16 2012-8-24在审评2012-8-22 2012-8-24在审评2012-8-23 2012-8-24在审评2012-8-23 2012-8-24在审评2012-8-23 2012-8-24在审评2012-8-22 2012-5-14在审评2012-5-8 2012-5-14在审评2012-5-8 2012-4-6在审评2012-4-5 2012-4-6在审评2012-4-5 2012-4-6在审评2012-4-5 2012-4-6在审评2012-4-5 2012-8-24在审评2012-8-22 2012-8-24在审评2012-8-22 2012-7-9在审评2012-7-5 2012-7-9在审评2012-7-5 2012-7-3在审评2012-6-28 2012-5-16在审评2012-5-14 2012-5-16在审评2012-5-14 2012-5-16在审评2012-5-14 2012-2-21在审评2012-2-202012-2-21在审评2012-2-20 2012-2-21在审评2012-2-20 2012-2-21在审评2012-2-202012-11-21在审评2012-11-20 2012-11-21在审评2012-11-20 2012-11-21在审评2012-11-20 2012-11-16在审评2012-11-14 2012-8-27在审评2012-8-24 2012-8-24在审评2012-8-22 2012-4-11在审评2012-4-10 2012-4-11在审评2012-4-10 2012-3-29在审评2012-3-28 2012-3-16在审评2012-3-15 2012-2-22在审评2012-2-21 2012-2-22在审评2012-2-21承办日期办理状态状态开始时间2012-9-24在审评2012-9-20 2012-9-24在审评2012-9-20 2012-9-24在审评2012-9-20 2012-9-24在审评2012-9-20 2012-9-17在审评2012-9-13 2012-6-11在审评2012-6-7 2012-6-11在审评2012-6-7 2012-3-23在审评2012-3-23 2012-2-9在审评2012-2-6承办日期办理状态状态开始时间2012-12-7在审评2012-12-6 2012-12-7在审评2012-12-6 2012-12-7在审评2012-12-6 2012-9-26在审评2012-9-25 2012-9-26在审评2012-9-25 2012-7-6在审评2012-7-4 2012-7-6在审评2012-7-4 2012-7-6在审评2012-7-4 2012-7-6在审评2012-7-4 2012-7-6在审评2012-7-4 2012-2-22在审评2012-2-21 2012-2-22在审评2012-2-21承办日期办理状态状态开始时间2012-12-18在审评2012-12-17 2012-9-14在审评2012-9-132012-9-6在审评2012-8-30 2012-9-6在审评2012-8-30 2012-5-21在审评2012-5-17 2012-5-21在审评2012-5-17 2012-4-24在审评2012-4-23 2012-4-24在审评2012-4-23 2012-4-20在审评2012-4-18 2012-4-20在审评2012-4-18承办日期办理状态状态开始时间2012-9-6在审评2012-8-31 2012-9-6在审评2012-8-31 2012-9-6在审评2012-8-31 2012-4-24在审评2012-4-23 2012-4-24在审评2012-4-23 2012-4-11在审评2012-4-10 2012-4-11在审评2012-4-10 2012-2-14在审评2012-2-13 2012-1-29在审评2012-1-17 2012-1-29在审评2012-1-18承办日期办理状态状态开始时间2012-11-8在审评2012-11-5 2012-8-20在审评2012-8-17 2012-8-20在审评2012-8-17 2012-7-23在审评2012-7-19 2012-7-23在审评2012-7-19 2012-6-19在审评2012-6-18 2012-5-7在审评2012-5-4承办日期办理状态状态开始时间2012-11-12在审评2012-11-8 2012-10-30在审评2012-10-29 2012-9-21在审评2012-12-8 2012-8-24在审评2012-8-23 2012-1-9在审评2012-1-5承办日期办理状态状态开始时间2012-8-17在审评2012-8-15 2012-8-17在审评2012-8-15 2012-8-17在审评2012-8-15 2012-8-17在审评2012-8-15 2012-7-27在审评2012-7-25 2012-7-27在审评2012-7-25 2012-4-26在审评2012-4-242012-2-23在审评2012-2-22 2012-2-23在审评2012-2-22 2012-2-23在审评2012-2-22承办日期办理状态状态开始时间2012-11-14在审评2012-11-12 2012-11-14在审评2012-11-12 2012-11-14在审评2012-11-12 2012-11-14在审评2012-11-12 2012-11-14在审评2012-11-12 2012-8-6在审评2012-8-2 2012-8-6在审评2012-8-2 2012-8-6在审评2012-8-2承办日期办理状态状态开始时间2012-5-8在审评2012-5-7 2012-5-8在审评2012-5-7 2012-5-8在审评2012-5-7 2012-5-8在审评2012-5-7 2012-5-8在审评2012-5-7 2012-5-8在审评2012-5-7 2012-4-5在审评2012-4-1 2012-4-5在审评2012-4-1承办日期办理状态状态开始时间2012-11-15在审评2012-11-13 2012-11-15在审评2012-11-13 2012-9-6在审评2012-8-31 2012-9-6在审评2012-8-31 2012-7-6在审评2012-7-3 2012-7-6在审评2012-7-3 2012-2-9在审评2012-2-6 2012-2-9在审评2012-2-6承办日期办理状态状态开始时间2012-11-30在审评2012-11-29 2012-11-30在审评2012-11-29 2012-11-29在审评2012-11-27 2012-11-29在审评2012-11-27 2012-8-1在审评2012-7-30 2012-8-1在审评2012-7-30 2012-3-29在审评2012-3-28承办日期办理状态状态开始时间2012-6-11在审评2012-6-8 2012-4-12在审评2012-4-16 2012-4-11在审评2012-4-10 2012-3-26在审评2012-3-26承办日期办理状态状态开始时间2012-8-13在审评2012-8-10 2012-6-19在审评2012-6-18 2012-4-11在审评2012-4-10 2012-4-11在审评2012-4-10 2012-1-29在审评2012-1-18 2012-1-29在审评2012-1-17承办日期办理状态状态开始时间2012-10-30在审评2012-10-29 2012-8-27在审评2012-8-24 2012-8-27在审评2012-8-24 2012-5-3在审评2012-5-2 2012-5-3在审评2012-5-2承办日期办理状态状态开始时间2012-5-23在审评2012-5-21 2012-4-5在审评2012-4-1 2012-4-5在审评2012-4-1 2012-1-29在审评2012-1-20 2012-1-29在审评2012-1-20承办日期办理状态状态开始时间2012-6-11在审评2012-6-7 2012-6-11在审评2012-6-7 2012-1-29在审评2012-1-17 2012-1-29在审评2012-1-20 2012-1-29在审评2012-1-17承办日期办理状态状态开始时间2012-9-6在审评2012-8-28 2012-9-6在审评2012-8-28 2012-7-6在审评2012-7-2 2012-3-1在审评2012-2-29承办日期办理状态状态开始时间2012-11-14在审评2012-11-12 2012-5-26在审评2012-5-23 2012-5-14在审评2012-5-8承办日期办理状态状态开始时间2012-9-6在审评2012-12-8 2012-9-6在审评2012-12-8 2012-9-6在审评2012-9-3承办日期办理状态状态开始时间2012-11-16在审评2012-11-14 2012-7-6在审评2012-7-2 2012-7-6在审评2012-7-2 2012-5-23在审评2012-5-21。

埃索美拉唑铝碳酸镁和莫沙比利联合使用在GERDHp相关性胃炎中的应用分析1. 引言1.1 背景介绍GERD和Hp相关性胃炎是常见的消化系统疾病,临床上常见于GERD患者中。
GERD是指胃食管反流病,是由于胃内容物反流至食管引起的疾病,可导致烧心、嗳气、胸痛等症状。
而Hp相关性胃炎是指由幽门螺杆菌(Hp)感染引起的慢性胃炎,常见于胃溃疡、十二指肠溃疡等疾病患者中。
这两种疾病常常同时存在,加重患者症状和病情。
在治疗GERDHp相关性胃炎的过程中,埃索美拉唑铝碳酸镁和莫沙比利被广泛应用。
埃索美拉唑是一种质子泵抑制剂,能够抑制胃酸分泌,减少消化道溃疡的形成。
铝碳酸镁是一种缓解药,具有中和胃酸的作用。
莫沙比利是一种抗生素,对Hp有良好的杀灭作用。
因此,联合应用埃索美拉唑铝碳酸镁和莫沙比利可以起到双重治疗作用,有效缓解GERDHp相关性胃炎患者的症状。
本文旨在探讨埃索美拉唑铝碳酸镁和莫沙比利联合使用在GERDHp相关性胃炎中的应用效果,为临床治疗提供参考。
1.2 研究目的本研究旨在探讨埃索美拉唑铝碳酸镁和莫沙比利联合使用在GERDHp相关性胃炎中的应用效果及安全性。
具体研究目的包括:1. 评估埃索美拉唑铝碳酸镁和莫沙比利联合使用对GERDHp相关性胃炎症状的改善效果;2. 探讨埃索美拉唑铝碳酸镁和莫沙比利联合使用对GERDHp相关性胃炎患者胃部病变的影响;3. 分析埃索美拉唑铝碳酸镁和莫沙比利联合使用在治疗GERDHp 相关性胃炎中的安全性和耐受性;4. 寻找最佳的治疗方案,为临床治疗提供参考依据。
1.3 研究意义GERDHp相关性胃炎是一种常见的胃病,其发病机制复杂,治疗难度较大。
在当前医学领域中,对于这种疾病的治疗方法仍然存在争议。
开展本研究对于探讨埃索美拉唑铝碳酸镁和莫沙比利联合使用在GERDHp相关性胃炎中的应用具有重要的意义。
对于GERDHp相关性胃炎的治疗,传统的单药治疗效果不佳,容易导致疾病反复发作和耐药性的产生。
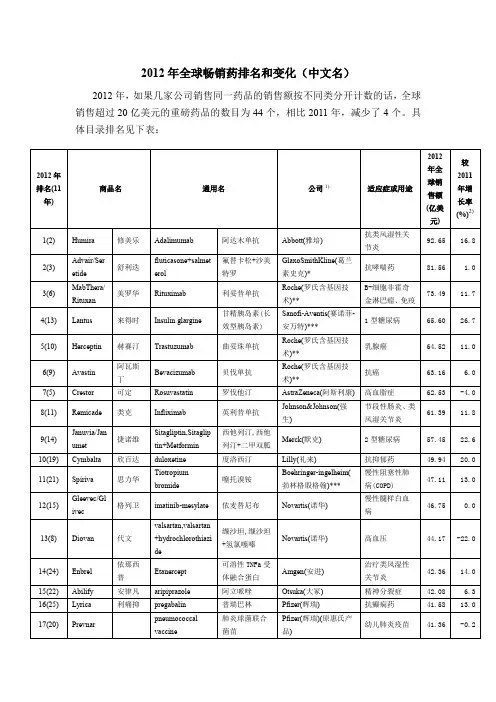
2012年全球畅销药排名和变化(中文名)2012年,如果几家公司销售同一药品的销售额按不同类分开计数的话,全球销售超过20亿美元的重磅药品的数目为44个,相比2011年,减少了4个。
具体目录排名见下表:注:1)*为其他货币单位换算成美元销售额,汇率(以2012年12月31日为基准)为:*1英镑=1.6163美元;**1瑞士法郎=1.0957美元;*** 1欧元=1.3226美元;****1日元=0.01163美元;*****1丹麦克朗=0.1773美元。
2)按公司原货币单位同比,非折算成美元后同比增长。
数据来源:摘自SFDA南方医药经济研究所情报网之国际制药大公司2012年度销售业绩及部分公司2012年年报等,再汇总编排,其中日本企业2012年的计算年度为2012年4月1日至2013年3月31日。
有些销售数据可能因汇率换算后存在一些误差。
2012年最大的惊喜是雅培的修美乐(阿达木单抗)取代了辉瑞立普妥全球畅销药霸主的宝座,成为由一家公司销售的单一品牌畅销药的新状元,而立普妥从2001年(销售额64.48亿美元)取代阿斯利康的洛赛克(奥美拉唑,2001年销售额55.78亿美元)雄踞榜首已经11年,立普妥在2006年销售达到128.86亿美元顶峰后,就逐渐在高位小幅萎缩,2011年跌至95.77亿美元,当年也暂时保住了“王位”,而2012年由于专利到期后受非专利药竞争影响销售大幅下降至39.48亿美元,跌至第20位。
在药品的销售额中,如果同一药品由多家公司销售在此处也分开计算。
如同为英利昔单抗,强生的销售排在第8位、默克的销售排在第41位,若合并销售额,则为82.15亿美元,超过了葛兰素的舒利迭,可排在第2位。
同样还有依那西普,安进(第14位)和辉瑞(第23位)合并销售额再与武田的5.02亿美元合计则为84.75亿美元,甚至超过了英利昔单抗的合并销售额;阿立哌唑,大冢(第15位)和百时美施贵宝(第26位)销售额合并计算为70.35亿美元,可排在第6位;波立维,赛诺菲安万特(第29位)和百时美施贵宝(第33位)销售额合并计算为52.79亿美元;雷珠单抗,诺华(第36位)与罗氏的16.23亿美元合并销售额则为40.21亿美元。

2012年全球制药50强企业近日,美国《制药经理人》(《Pharmaceutical Executive》)杂志公布了其评选出的2012年度全球制药公司50强,这是按公司全球处方药销售额排出的50强制药公司。
与2011年相比,2012年10强公司的排名没有变动。
辉瑞由于其重磅产品立普妥销售额59%的下降出现了2位数的跌幅。
阿斯利康由于其重磅产品埃索美拉唑、富马酸喹硫平销售额10%和51%的下降出现了2位数的跌幅,10强公司多数通过减少研发费用的支出来抵御衰退。
由于受益于仿制药市场需求的增加和创新投资组合的多样化,以色列梯瓦公司紧跟礼来名列第11位,与前十仅有一步之遥。
百时美-施贵宝更是由于其重磅产品氯吡格雷硫酸氢盐专利到期后销售额64%下降等因素出现了超过30%的跌幅,从去年的第11位下降至第17位。
印度的兰伯西第一次进入50强榜单,这也是印度制药企业第一次进入50强榜单。
2012年,50强门槛有显著提高,第50位制药企业兰伯西销售额为20.49亿美元,比2011年第50位企业南非的Aspen的17亿美元增加了约3.5亿美元。
2012年药品市场集中度反而降低,2007年前10强的销售额占全球市场份额的43%,2012年则为42%,是降低的。
大型制药企业前10强销售额的比重占50强的56%,与2007年的水平相同。
与往年一样,《制药管理者》所述销售数据反映的是人用药品制剂和疫苗的全球销售,没有将许可收入计算在内,也没有把兽药和消费者保健产品的收入计算在内,OTC药品的销售收入也尽可能地被剔除在外。
由于上述原因,报告中的数据在统计口径和结果上,与这50家企业的报告会有些差异。
除以上变化外,2012年的排名还有以下的特点:一、世界药品市场分区域有增有减:药品市场按区域分最引人注目的是美国药品市场50多年来第一次缩减,主要因为几个几十亿美元重磅产品波立维、思瑞康、立普妥和再普乐专利到期后仿制药的竞争,以及更为严格的医保支付的监管和审批。


埃索美拉唑镁立项调研报告一、药物基本信息【通用名】埃索美拉唑镁【英文名】esomeprazole magnesium【商品名】耐信化学名:双-S-5-甲氧基-2-4-甲氧基-35-二甲基-2-吡啶基甲基亚磺酰基-1H-苯并咪唑镁三水合物分子式:C34H36MgN6O6S23H2O分子量:767.17结构式:CAS:161973‐10‐0剂型:片剂、胶囊、规格:20mg/片,40mg/片,14000 片/包(40mg)包装规格:7 片/盒,14 片/盒,20000 片/包(20mg)。
适应症:胃食管反流性疾病GERD ;糜烂性反流性食管炎的治疗;已经治愈的食管炎患者防止复发的长期维持治疗;胃食管反流性疾病GERD 的症状控制与适当的抗菌疗法联合用药根除幽门螺杆菌;愈合与幽门螺杆菌感染相关的十二指肠溃疡;防止与幽门螺杆菌相关的消化性溃疡复发。
二、市场背景现代生活节奏的加快,人们饮食规律不能保证,胃病发生率越来越高,人的一生中几乎都会不同程度地发生急性或慢性胃病。
胃肠病是常见病多发病,总发病率约占人口的20%左右。
年龄越大,发病率越高,特别是50 岁以上的中老年入更为多见,男性高于女性,如不及时治疗,长期反复发作,极易转化为癌肿。
胃肠病历来被医家视为疑难之证,一旦得病,应及时治疗、长期服药,才能控制或治愈。
随着健康意识的不断普及,胃病用药市场需求将会越来越大。
胃管反流病(GERD)是指胃内容物(包括十二指肠液)反流入食管产生症状或并发症,胃灼热、反酸是胃食管反流的主要症状,胃食管存在生理反流和病例反流。
GERD 在欧美国家比较常见,人群中7-15的人有胃管反流症状,男女比例接近。
我国北京、上海的一项流行病学研究报道,GERD患病率为 5.77。
近年来,GERD 的患病率有逐渐上升的趋势,引起了人们越来越多的关注。
GERD 包括非糜烂性胃食管反流病(NERD)、RE 和Barrett 食管。
据统计,NERD 是GERD 的主要类型,约占GERD 的70,其发病率、复发率高,长期严重影响患者生活质量,且治疗费用高。




埃索美拉唑镁肠溶片治疗复合性溃疡的疗效观察【中图分类号】r573【文献标识码】a【文章编号】1004-7484(2012)14-0213-01复合性溃疡是指胃和十二指肠同时发生溃疡,是一种特殊类型的消化性溃疡。
复合性溃疡以大、中型溃疡多见,病情易反复,且并发症发生率较高,其治疗较一般溃疡困难。
对复合性溃疡得治疗,强调以内科治疗为首选,特别是强化对幽门螺杆菌的杀菌治疗[1]。
目前以质子泵抑制剂或铋剂为基础的三联疗法业己成为治疗各种消化性溃疡的一线治疗方案。
埃索美拉唑镁是一种新型的质子泵抑制剂,是奥美拉唑的s-异构体。
有研究表明,以埃索美拉唑镁为基础的四联疗法可有效根除hp,促进溃疡愈合,对难治性消化性溃疡有很好疗效[2]。
作者采用埃索美拉唑镁肠溶片治疗50例复合性溃疡患者,并与同期采用奥美拉唑治疗的患者相比较,旨在探讨埃索美拉唑镁肠溶片治疗复合性溃疡的治疗效果。
1 对象与方法1.1研究对象选择2011年8月~2012年8月来我院门诊就诊或住院的复合性溃疡100例,均经胃镜及活检确诊。
排除标准:恶性溃疡;胃泌素瘤;肿瘤;消化性溃疡合并并发症;先前使用非甾体抗炎药;孕期或哺乳期妇女等。
其中男70例,女30例,年龄19~66(38.4±7.5)岁,hp检测阳性74例。
按入院的先后顺序将患者随机分为观察组和对照组,各50例。
两组患者在年龄、性别、吸烟史、饮酒史、hp阳性率和上消化道症状表现等方面差异无统计学意义,均p>0.05,具有可比性。
1.2治疗方法观察组给予埃索美拉唑镁(商品名耐信,阿斯利康制药有限公司生产)40mg,1次/d,连续服用6周。
若患者hp阳性,则加用克拉霉素500mg,阿莫西林1000mg,均为2次/d,连续使用14d。
对照组给予奥美拉唑(商品名洛赛克,阿斯利康制药有限公司生产)40mg,l次/d,连续服用6周。
若患者hp阳性,则加用克拉霉素500mg,阿莫西林1000mg,均为2次/d,连续使用14d。

埃索美拉唑持续泵入治疗急性上消化道大出血疗效观察目的观察埃索美拉唑持续泵入治疗消化性溃疡合并急性上消化道大出血的临床疗效。
方法对我院2012年1月~2014年3月收治的45例消化性溃疡合并上消化道大出血患者,随机分为治疗组(n=23)和对照组(n=22)。
两组均在扩容、口服去甲肾上腺素冰盐水、心电监测、吸氧、留置胃管等常规治疗同时,观察组首次给予埃索美拉唑80mg静滴,然后8mg/h持续泵入,连用72h;对照组首次给予奥美拉唑80mg静滴,然后8mg/h持续泵入,连用72h。
结果观察组有效率为91.3%,对照组有效率为54.5%,两组比较差异有统计学意义有(x2=7.77,P<0.01)。
副反应方面两组均未发现明显副作用。
结论埃索美拉唑持续泵入治疗消化性溃疡合并上消化道大出血疗效肯定,安全可靠,值得临床推广应用。
标签:急性上消化道大出血;埃索美拉唑;持续泵入上消化道大出血是指食管、胃、十二指肠、胆管及胰腺等屈氏韧带以上消化道病变引起的短时间内出血量超过1000mL,或出血量占全身循环血量的20%以上[1]。
消化道大出血病情进展快,患者可很快出现周围循环衰竭而死亡,若短时间内不能有效控制出血,患者将会因失血性休克、多脏器功能衰竭而死亡,及时有效的治疗是抢救成功的关键。
在消化性溃疡合并出血治疗中,国内外指南均推荐大剂量PPI“80mg+8mg/h”,持续72h的治疗方法[2-4]。
我院2012年1月~2014年3月应用埃索美拉唑持续泵入治疗消化性溃疡合并急性上消化道大出血,取得显著的临床疗效,现报道如下。
1 资料与方法1.1 一般资料本研究主要选取2012年1月~2014年3月在我院消化科住院的上消化道大出血患者45例,其中男32例,女13例,年龄35~70岁。
所有患者均经胃镜检查确诊为消化性溃疡合并急性上消化道出血,排除食道胃底静脉曲张、血液系统疾病、胃癌所致出血。
出血量(呕血+便血):>2000mL者7例,1500~2000mL 者20例,1000~1500mL者18例。
埃索美拉唑市场调研报告1. 引言本报告旨在对埃索美拉唑市场进行全面调研和分析,以便了解该药物在医药行业的市场状况和发展趋势。
埃索美拉唑是一种常用的抗酸药物,用于治疗消化性溃疡等胃肠道疾病。
通过对市场规模、竞争格局、产品特点和市场趋势等进行分析,本报告力求为相关企业及投资者提供有价值的市场参考。
2. 市场概况埃索美拉唑市场在过去几年内保持了稳健增长的趋势。
消化系统疾病的发病率上升,加之人们健康意识的提高,导致该药物的需求不断增加。
根据行业研究数据,预计埃索美拉唑市场在未来几年内将继续保持高速增长。
3. 市场规模及竞争格局埃索美拉唑市场涉及多家药企的产品竞争。
其中,市场份额较大的企业包括辉瑞、阿斯利康、拜耳等。
这些企业通过品牌宣传、广告投放和医生推荐等手段,争夺市场份额并保持竞争优势。
根据市场调研数据,2019年埃索美拉唑市场规模达到X亿美元,并以年均X%的增长率递增。
预计到2025年,市场规模将达到X亿美元,年均增长率约为X%。
这一增长趋势主要受到以下因素的影响: - 消化系统疾病的高发率 - 人们对健康的关注度提高 - 埃索美拉唑的治疗效果和口服方便性等优势当然,市场增长也面临一些挑战,例如仿制药和价格竞争增加。
然而,由于埃索美拉唑的疗效已得到充分验证,在品牌认知度和市场竞争等方面,仍具备一定的竞争优势。
4. 市场应用和产品特点埃索美拉唑主要用于治疗胃肠道疾病,如胃溃疡、十二指肠溃疡和胃食管反流病等。
这些疾病常见于成年人和老年人,因此该药物的主要消费者群体为中老年人群。
该药物的特点主要包括: - 抑制胃酸分泌:埃索美拉唑通过抑制胃酸相关的酶活性,有效降低胃酸分泌,减轻胃肠道炎症反应。
- 治疗范围广泛:除了上述常见疾病,埃索美拉唑还可以用于治疗其他胃肠道疾病,如消化性溃疡、胃食道反流病和非甾体抗炎药相关性溃疡等。
- 口服方便:埃索美拉唑以口服药片的形式出售,服用方便,增加了患者的依从性。
- 安全性高:经过大量临床试验验证,埃索美拉唑被证明具有较高的安全性和耐受性。
5、项目产品市场与竞争优势分析项目产品市场与竞争优势分析目录1、市场概述2、竞争优势分析2.1项目产品市场分析2.1.1抗消化性溃疡市场分析2.1.2埃索美拉唑市场分析2.1.3本项目产品特色3、市场策略1、市场概述消化性溃疡药(包括抗酸药)2011年在中国突破200亿元。
总体来说:目前在化学药品市场上,已形成了由质子泵抑制剂类、H2-受体拮抗剂、胃粘膜保护剂三足鼎立的格局。
专家预测在未来几年里,质子泵抑制剂将会占据66%以上的胃肠道药市场。
现就“质子泵抑制剂类”的研发动态和市场分析简述如下:质子泵抑制剂(proton pump inhibitors,PPIs)能阻断H+、胃泌素和胆碱介导的酸的生成,通过抑制H+/K+ ATPase的最后通路来抑制胃酸分泌,用于酸相关性疾病。
与以往临床应用的抑制胃酸药物H 2 受体拮抗剂相比较,作用位点不同且有着不同的特点,即夜间的抑酸作用好、起效快、抑酸作用强且时间长、服用方便。
目前已经上市或正在研发的产品主要有:1)泰妥拉唑tenatoprazole国内研发新宠、按兵未动、整装待发泰妥拉唑能显著抑制胃酸的分泌,同时对幽门螺旋杆菌也有抑制作用。
Tenatoprazole的化学名为5-甲氧基-2-(4-甲氧基-3,5-二甲基吡啶-2-甲基亚磺酰基)-咪唑并(4,5-b)吡啶。
本品的作用机理也是通过特异性作用于胃粘膜壁细胞,降低壁细胞中H+/K+-ATP酶活性,抑制胃酸分泌,并对幽门螺旋杆菌有独特的抗菌活性,批准上市后主要用作治疗胃及十二指肠溃疡的抗溃疡药物。
与同类型的其它品种相比,临床前研究结果表明泰妥拉唑在抑制胃酸分泌的作用比同类产品如奥美拉唑和兰索拉唑等要强,可见,本品在治疗胃溃疡疾病比同类产品中的其他产品有很大的潜在优势。
其抑制H+/K+ATP酶的活性更强,对各种试验溃疡均有效,而且稳定性较其他质子泵抑制剂显著提高。
泰妥拉唑最先由日本三菱公司和日本Abbott制药公司联合研制开发,1986年由在日本申请专利,后在欧美等国申请专利,美国专利号:US4808596,该产品化合物没有在中国申请专利,符合申请行政保护的条件。
注射用埃索美拉唑钠的研制及其稳定性考察作者:徐晓娟唐云来源:《科技创新导报》 2014年第34期徐晓娟1 唐云1,2*(1.江苏正大丰海制药有限公司江苏盐城 224100;2.南京正大丰海医药科技有限公司江苏南京 210000)摘要:目的研究开发注射用埃索美拉唑钠。
筛选制剂处方和工艺,并建立其质量控制方法,考察其稳定性。
方法对络合剂种类及用量、原辅料加入顺序、中间体pH值及稳定性、过滤除菌、灌装量、冻干工艺及成品水分等进行筛选,确定其处方和工艺。
对制剂的性状、鉴别、碱度、有关物质、水分、异构体和含量等项目进行研究,建立质量控制方法,并考察其配伍稳定性及放样稳定性。
结果通过处方工艺筛选以及影响因素试验,确定了最佳处方和制备工艺。
按照优化出来的最佳处方及工艺,制备3批样品,并对其产品质量进行检测,结果均合格。
结论该制剂处方合理,制备工艺可行,质量可控,稳定性良好。
关键词:埃索美拉唑钠处方工艺质量控制稳定性中图分类号:R965 文献标识码:A 文章编号:1674-098X(2014)12(a)-0206-04Preparation and stability of Esomeprazole sodium injectionXu Xiaojuan1 Tang Yun1,2*(1.Jiangsu Chia Tai Fenghai Pharmaceutical Co.,Ltd.Yancheng Jiangsu,224100,China;2.Nanjing Chia Tai Fenghai Pharmaceutical Technology Co.,Ltd.Nanjing Jiangsu,210000,China)Abstract:Objective To develop the Esomeprazole sodium injection to meet the clinical requirements,formulation and the process parameters were screened and the quality control methods were established,then the stability was evaluated.Methods The types and amount of the complexing agents,adding order of raw and supplemental materials,the pH value and stability of intermediates,filtrating and removing bacteria,capacity of perfusion,freeze-drying process and moisture content of products were investigated to determine the formulation and process.The property of preparation,identification,pH value,related materials and content determination were studied to set up the quality control methods.Results Based on the screeningof formulation and process as well as the influence factors,the prescription and preparation process were obtained.The quality of the 3 batches sample was qualified which were prepared according to the optimized formula and preparationprocess.Conclusion The formulation is reasonable and the preparation process is feasible.The quality can be controlled and the products are stabile.Key Words:Esomeprazole sodium Formulation technology Quality control Stability随着社会发展,环境变迁,人口结构以及人们生活方式的改变,吸烟、饮酒、情绪紧张、药物刺激等因素引起的消化性溃疡发病率逐渐增高,给患者带来极大的痛苦,且生活质量下降。
埃索美拉唑与手性药物的研究与应用前景来源:INTERNET整理:王丽萍2005-7-8中华医药杂志2005年第5卷第5期摘要: Omeprazole,即奥美拉唑,化学结构为5-甲氧基-2-[[(4-甲氧基-3,5-二甲基-2-吡啶)甲基]亚砜]-1H-苯骈咪唑,是一类新型的抗消化性溃疡药和质子泵抑制剂,也是世界上第一个应用于临床的质子泵抑制剂(proton pump inhibitor,PPI),目前已在65个国家获准用于治疗各种与胃酸有关的疾病。
由于OPZ抑酸作用强,治愈率高......埃索美拉唑,即esomeprazole,商品名Nexiumò(中文译“耐信”),是由瑞典Astr aZeneca(阿斯特拉)公司分离合成的全球第异构体质子泵抑制剂(I-PPI)由于其疗效显著且用药量低,自2000年问世以来,已创下了全球销售额突破10亿美元的惊人记录。
面对如此骄人的成绩,人们不禁要问:是什么使得es-omeprazole有如此神奇的魔力,一枝独秀地傲然于世界医药市场?究其出身,esomeprazole是从meprazole(OPZ)而来。
Omeprazole,即奥美拉唑,化学结构为5-甲氧基-2-[[(4-甲氧基-3,5-二甲基-2-吡啶)甲基]亚砜]-1H-苯骈咪唑,是一类新型的抗消化性溃疡药和质子泵抑制剂,也是世界上第一个应用于临床的质子泵抑制剂(proton pump inhibitor,PPI),目已在65个国家获准用于治疗各与胃酸有关的疾病。
由于OPZ抑酸作用强,治愈率高、治愈时间短,可以消除难治性溃疡危象,而且安全可靠,已成为胃及十二指肠溃疡及反流性食管炎的重要药物,不仅成为世界最畅销的药品之一,创造了十亿美元的年销售记录,同时也极地推动了胃及十二指肠溃疡病治疗及相关领域的发展。
可是,OPZ分子中具有一个不对称的手性硫原子,存在两个光学异构体,(S)-构型和(R)-构型异构体,两种构型均具有药理活性,在代谢上表现为立体选择性(见图1)。
埃索美拉唑治疗慢性胃炎的临床疗效分析摘要】目的:观察埃索美拉唑治疗慢性胃炎的临床疗效。
方法:选择我院收治的慢性胃炎患者90例,随机分成研究组(n=45)和对照组(n=45),对照组运用洛赛克治疗,研究组采用埃索美拉唑治疗,比较分析两组患者临床疗效。
结果:研究组腹痛消失率为77.8% ,对照组腹痛消失率为51.1%,两组比较差异有统计学意义(P<0.05)。
研究组治疗总有效率为97.8%,对照组的治疗总有效率为71.1%,两组治疗总有效率比较差异有统计学意义(P<0.05)。
结论:与洛赛克比较,埃索美拉唑治疗慢性胃炎效果显著,能明显改善患者腹痛情况,值得应用。
【关键词】埃索美拉唑;洛赛克;慢性胃炎【中图分类号】R453 【文献标识码】A 【文章编号】2095-1752(2015)14-0141-02慢性胃炎是一种慢性疾病,其发病率居胃病之首,上腹疼痛与饱胀是此病的主要临床症状[1]。
药物疗法是治疗慢性胃炎的主要方法,但是不同的药物,临床效果不一样[2-3]。
为比较分析埃索美拉唑与洛赛克治疗慢性胃炎的临床价值,我们选择我院收治的慢性胃炎患者90例进行比较分析,现总结报告如下。
1.资料与方法1.1 一般资料选择我院收治的并符合临床诊断标准的慢性胃炎患者90例,其中,男50例,女40例;患者年龄为26~70岁,平均年龄为(35.8±4.1) 岁;病程为 1~6年,平均病程为(4.4±0.7)年。
入选的研究对象随机分成研究组与对照组,每组各45例,两组患者的性别与年龄等一般资料比较差异无统计学意义 (P> 0.05) ,具有可比性。
1.2 方法两组患者均采用阿莫西林、胶体果胶铋等药物进行常规对症支持治疗。
对照组在常规对症支持治疗的基础上,加用洛赛克(阿斯利康制药有限公司生产,国药准字42001H032)治疗,20 mg / 次,2 次/ d,连续治疗30 d。
研究组在常规对症支持治疗的基础上加用埃索美拉唑(阿斯利康制药有限公司生产,国药准字H20093314)治疗,40 mg/次,1 次/d,连续治疗30 d。
畅销药埃索美拉唑市场的黄金时代
•2013-03-05
•来源:米内网
核心提示:2006年至2011年埃索美拉唑每年销售业绩均在50亿美元左右,自上市以来累计销售几百亿美元。
2012年,我国有多家企业向SFDA提出埃索美拉唑仿制药申请。
米内网专稿(研究员 lily-cha)春节刚过,各大医院的消化道科室的病人急剧增多。
由于连日来的饮食不规律,加上暴饮暴食、贪烟酒,致使胃肠负担过重,造成胃酸过多、胃肠蠕动不顺畅和功能不稳定等,从而诱发急性胃肠道不适或胃肠旧疾复发,甚至导致一些急症的出现。
消化系统疾病是常见的多发病之一,据世界卫生组织公布的统计数据显示,目前全球至少有2.5亿人患有消化道疾病,其中又以溃疡病为主。
所以国际医药市场抗溃疡药物的研发热情一直高涨,上市的品种很容易就成为全球市场的畅销药。
埃索美拉唑就是其中的佼佼者。
据美国医药行业协会数据显示,2011年全球最畅销药品前十位中,耐信(埃索美拉唑的商品名)坐上头把交椅。
米内网跨国公司业绩显示,2006年至2011年耐信每年销售业绩均在50亿美元左右,自上市以来累计销售几百亿美元,成为阿斯利康公司名副其实的印钞机。
埃索美拉唑属于质子泵抑制剂,是奥美拉唑的S-异构体, 也是质子泵抑制剂家族中第1个单一光学异构体,于2000年上市。
由于其生物利用度高而抑制胃酸的作用强烈持久,且毒副作用低而受到市场的追捧。
在印度兰伯西公司向FDA提交了埃索美拉唑胶囊非专利药的简化新药申请后,阿斯利康提起了专利侵权之诉,但是2008年2月5日兰伯西公司还是获得了FDA的临时性批准。
由于耐信最关键的专利94190335. 4即将到期,为避免与诸多仿制药厂家打耗时耗钱的专利侵权官司,阿斯利康2011年10月决定与各国仿制药厂家签订协议,只要与其达成合作意向,并付一定金额的“专利使用费”,即可继续生产埃索美拉唑通用名药物。
目前包括印度Dr Reddy’s大药厂等十几家公司与阿斯利康签订了协议。
虽然仿制药的出现夺走了耐信的部分市场,但与其专利到期后对付蜂拥而至的仿制药队伍,现在收取的专利使用费也可挽回小部分的损失。
在国内埃索美拉唑的专利保护比较到位, 目前市场只有阿斯利康的产品埃索美拉唑镁肠溶片(规格:20mg、40mg)和注射用埃索美拉唑钠(规格:40mg)在售,由于一家独大,市场回报理想。
2008年至今,每年销售上亿元。
在产品的价格方面,埃索美拉唑享有单独定价的优惠。
米内网药品审评数据库显示,国内企业怀揣着对未来市场美好的憧憬,纷纷踏入申报大门,开启了埃索美拉唑市场一个群雄争霸、适者生存的黄金时代倒计时的序幕。
(本文米内网版权所有,侵权必究。
转载请务必注明出处。
)。