HPLC法测定盐酸溴己新葡萄糖注射液中盐酸溴己新的含量
- 格式:pdf
- 大小:518.70 KB
- 文档页数:2



高效液相色谱法测定盐酸氨溴索葡萄糖注射液中5-HMF含量朱万政
【期刊名称】《武警医学院学报》
【年(卷),期】2012(21)5
【摘要】【目的】建立高效液相色谱法测定盐酸氨溴索葡萄糖注射液中5-羟甲基糠醛的含量。
【方法】采用CAPCELL PAK C18色谱柱(250 mm×4.6
mm,5μm),流动相:甲醇-0.05%磷酸溶液(10:100),流速1.0 ml/min,检测波长284 nm。
【结果】5-HMF在0.295~3.54μg/ml浓度范围内线性较好
(r=0.9998),平均加样回收率为99.65%(n=6),RSD为0.46%。
【结论】本方法准确,重复性好,可用于盐酸氨溴索葡萄糖注射液中的5-HMF的含量控制。
【总页数】2页(P336-337)
【关键词】5-HMF;盐酸氨溴索葡萄糖注射液;高效液相色谱法
【作者】朱万政
【作者单位】武警甘肃总队医院药剂科
【正文语种】中文
【中图分类】R91
【相关文献】
1.高效液相色谱法测定复方乳酸钠葡萄糖注射液中乳酸钠的含量 [J], 张志英;
2.高效液相色谱法测定莪术油葡萄糖注射液中5-羟甲基糠醛含量 [J], 陈勇;蒋慧莲;唐登峰;陈碧莲;郑成
3.高效液相色谱法测定替硝唑葡萄糖注射液中5-羟甲基糠醛含量 [J], 曾令高
4.高效液相色谱法测定莪术油葡萄糖注射液中莪术醇的含量 [J], 田兰;王丽萍;刘红莉
5.高效液相色谱法测定注射用奥沙利铂5%葡萄糖注射液中5-羟甲基糠醛的含量[J], 陈学文; 王宁; 徐立伽
因版权原因,仅展示原文概要,查看原文内容请购买。

HPLC法测定盐酸氨溴索注射液的含量和有关物质付建;苏贵勇;赵海桥【摘要】目的建立高效液相色谱法测定盐酸氨溴索注射液的含量和有关物质的方法.方法采用Welchrom-C18(4.6 mm×200 mm,5 μm)色谱柱,流动相为0.01 mol·L-1磷酸氢二铵溶液(用磷酸调pH值至7.0)-乙腈(50∶ 50),流速为1.0 mL·min-1,检测波长为248 nm.结果盐酸氨溴索在0.091~0.212 mg·mL-1范围内线性关系良好,相关系数r=0.999 9,平均回收率为99.60%(n=9).结论采用高效液相色谱法测定盐酸氨溴索注射液的含量和有关物质,方法简便,结果准确可靠.【期刊名称】《药学研究》【年(卷),期】2012(031)002【总页数】4页(P84-87)【关键词】盐酸氨溴索注射液;含量测定;有关物质;高效液相色谱法【作者】付建;苏贵勇;赵海桥【作者单位】山东方明药业集团股份有限公司,山东,菏泽,274500;中国药科大学,江苏,南京,210009;山东方明药业集团股份有限公司,山东,菏泽,274500;山东大学药学院,山东,济南,250012;山东方明药业集团股份有限公司,山东,菏泽,274500;山东大学药学院,山东,济南,250012【正文语种】中文【中图分类】R927.2盐酸氨溴索(Ambroxol hydrochloride)为溴己新的体内活性代谢物,适用于伴有痰液分泌不正常及排痰功能不良的急性、慢性肺部疾病的治疗;手术后肺部并发症的预防性治疗;早产儿及新生儿的婴儿呼吸窘迫症(IRDS)的治疗。
《中国药典》2010年版[1]仅收载了原料药及口服制剂的含量和有关物质测定方法,对注射液并未收载,进口药品注册标准(标准号:JX20030067)及文献[2]虽采用高效液相色谱法测定其含量和有关物质,但对盐酸氨溴索中可能存在的杂质没有控制,流动相组成及方法各不相同,本文建立了新的高效液相色谱法测定盐酸氨溴索注射液的含量和有关物质,该方法快速、准确、重现性好、灵敏度高,可用于盐酸氨溴索注射液的质量控制。

HPLC法测定盐酸莫西沙星葡萄糖注射液中有关物质的含量目的建立高效液相法测定盐酸葡萄糖注射液中有关物质。
方法采用高效液相色谱法测定已知杂质A,B,C,D,E和未知单杂。
使用BDS HYPERSIL C18色谱柱(4.6mm×250mm,5μm),以甲醇(0.50g/L四丁基硫酸氢铵,1.0g/L磷酸二氢钾和3.4g/L磷酸混合溶液;28∶72)为流动相。
流速:1.5mL/min,检测波长:293nm。
结果盐酸莫西沙星进样质量在0.1259~5.036μg/mL(r=0.9992),浓度范围内,供试品溶液的浓度与峰面积线性良好。
精密度:RSD为0.78%;最小检出限为0.74ng。
定量限:供试品溶液峰面积的RSD%为4.24,最小定量限为2.53ng。
溶液稳定性:供试品溶液及其对照溶液在8h内稳定。
结论该方法简便、专属性好、灵敏度高,可用于盐酸莫西沙星葡萄糖注射液中有关物质的检测。
标签:盐酸莫西沙星;葡萄糖注射液;HPLC法莫西沙星作为超广谱氟喹诺酮类抗菌药物,作用于细菌的两个靶位即拓扑异构化酶Ⅱ和Ⅳ,所以本品不仅对敏感的细菌有效,而且对耐药菌株也有高度活性。
临床上对多种感染显示优良的治疗效果[1]。
近几年,由于空气污染等多种原因,我国呼吸系统感染发病率直线上升,本品在此领域内有显著优势,需求量稳步攀升。
本品已逐渐成为治疗呼吸道感染的重要药物。
盐酸莫西沙星的进口产品为拜复乐注射液,中文名称为“盐酸莫西沙星氯化钠注射液”[2]由于德国拜耳的专利限制,目前国内尚无原料药及制剂生产,国内上市品种为拜耳医药的盐酸莫西沙星片及盐酸莫西沙星氯化钠注射液[3-4],尚无盐酸莫西沙星葡萄糖注射液生产,更无关于其有关物质的测定的文献报道。
本文采用公司研制的盐酸莫西沙星葡萄糖注射液,用反相高效液相色谱法测定盐酸莫西沙星的有关物质,结果证明该法专属性强,重现性好,为制剂的质量控制提供了方法学依据。
1 仪器与试药1.1 仪器戴安U3000高效液相色谱仪,检测器:VWD检测器,工作站:变色龙软件;LC-10AT 电子天平。

一种盐酸溴己新片溶出度的检测方法在制药工业中,溶出度(dissolution)是一种重要的参数,用来评估固体药物在溶液中的释放速度。
而对于盐酸溴己新片这种常用的药物成分,其溶出度的检测更是至关重要。
为了确保盐酸溴己新片的治疗效果,制药公司需要对其溶出度进行精确测定。
然而,由于盐酸溴己新片的特性,传统的溶出度检测方法往往存在一些局限性。
研究人员不断探索新的检测方法,以更准确、高效地评估盐酸溴己新片的溶出度。
一种最新的盐酸溴己新片溶出度检测方法基于高效液相色谱-质谱联用技术(HPLC-MS),该方法在传统的溶出度检测方法的基础上进行了革新和优化。
通过这种方法,不仅可以准确地分析盐酸溴己新片在不同时间点的溶出度曲线,还可以同时检测其代谢产物和降解物,从而更全面地了解盐酸溴己新片在溶液中的行为。
该方法利用高效液相色谱技术,可以将盐酸溴己新片及其代谢产物和降解物进行有效分离,从而确保溶出度检测的准确性。
随后,利用质谱技术对分离得到的化合物进行准确的定性和定量分析,进一步提高了检测结果的可信度。
值得一提的是,该方法还可以与自动取样系统结合,实现对多个样品的快速、连续检测,大大提高了检测效率,降低了人工操作的影响。
该方法还可以在一定程度上降低了溶出度检测的成本,适用于大规模的生产和质量控制过程。
通过对盐酸溴己新片溶出度的全面监测,制药公司可以更好地了解药物在不同条件下的释放情况,优化配方和工艺参数,从而提高产品的稳定性和疗效一致性。
这种高效的检测方法也为新药物的研发和监管提供了可靠的技术支持。
盐酸溴己新片溶出度的检测方法是制药工业中至关重要的一环。
高效液相色谱-质谱联用技术作为一种创新的检测方法,为盐酸溴己新片的溶出度检测提供了全新的思路和解决方案。
相信随着科学技术的不断进步,我们会看到更多更先进的方法应用于药物溶出度的监测,为制药行业的发展注入新的活力。
以上是个人对盐酸溴己新片溶出度检测方法的一些观点和理解,希望对你有所帮助。

HPLC测定祛痰类儿童中成药非法添加物盐酸溴己新和盐酸氨溴索谭莉萍;谭小勇【期刊名称】《海峡药学》【年(卷),期】2017(029)001【摘要】目的建立祛痰类儿童中成药非法添加物盐酸溴己新、盐酸氨溴索检测方法 .方法采用反相高效液相色谱法,用带有光电二极管阵列检测器的高效液相色谱仪(HPLC-DAD)对盐酸溴己新和盐酸氨溴索进行色谱分离和快速筛查.以Diamonsil C18(250×4.6mm,5μm)为色谱柱,以磷酸盐缓冲液-乙腈(20:80)为流动相,流速1.0mL·min-1,进样体积为20μL,柱温为40℃,检测波长为245nm.结果盐酸溴己新的线性范围为0.1982~2.9730μg(r=0.9995),平均回收率(n=6)为98.9%,RSD为1.1%;盐酸氨溴索的线性范围为0.1976~2.9640μg(r=0.9998),平均回收率(n=6)为99.1%,RSD为1.5%.结论该方法色谱分离较好,分析速度较快,前处理简单,适用于非法添加物盐酸溴己新、盐酸氨溴索的快速检测.【总页数】4页(P42-45)【作者】谭莉萍;谭小勇【作者单位】韶关学院医学院韶关512026;广东省韶关市食品药品检验所韶关512028【正文语种】中文【中图分类】R927【相关文献】1.HPLC-MS-MS法测定降糖类中成药中非法添加物格列波脲 [J], 申国华;董培智;裴社强;郭景文;行江水2.HPLC法同时测定止咳平喘类中成药中非法添加的9种化学成分 [J], 沈于兰;申兰慧;苏嘉焱3.HPLC-DAD超高效液相柱法同时测定抗风湿类中成药中非法添加的10种糖皮质激素 [J], 张月辉;董慧明4.HPLC-MS/MS法同时测定止咳平喘类中成药中非法添加化学药物 [J], 孙晓; 李卓; 荀英; 王涛; 朱群英; 张亚锋5.HPLC-CAD法测定中成药中甜味剂及其蜂蜜类辅料的质量评价 [J], 王亚琼;张华锋;周坚因版权原因,仅展示原文概要,查看原文内容请购买。

高效液相色谱法测定茶新那敏片中盐酸溴己新含量
陈乃江
【期刊名称】《中国药业》
【年(卷),期】2009(18)8
【摘 要】目的 建立测定茶新那敏片中盐酸溴己新含量的高效液相色谱(HPLC)法.
方法 色谱柱为Phenomenex C18柱(250 mm×4.6 mm,5 μm),以用三乙胺调节
pH至3.5的甲醇-0.2%磷酸溶液(65:35)为流动相,柱温为室温,流速为1.0 mL/min,
检测波长248 nm.结果 盐酸溴己新进样量在0.604-2.416μg范围内与峰面积线性
关系良好,r=0.999 9(n=5),平均回收率为99.45%,RSD为0.82%(n=6).结论 HPLC
法简便、准确,可作为茶新那敏片质量控制方法.
【总页数】2页(P35-36)
【作 者】陈乃江
【作者单位】江苏省连云港市药品检验所,江苏,连云港,222006
【正文语种】中 文
【中图分类】R927.2;R974
【相关文献】
1.高效液相色谱法测定茶新那敏片含量与含量均匀度 [J], 卓开华;詹彦
2.高效液相色谱法测定复方茶新那敏片中马来酸氯苯那敏含量 [J], 刘杨;赖庆宽
3.反相离子对高效液相色谱法测定盐酸溴己新及其片剂的含量 [J], 郑凯;王玉红;杨
阔
4.高效液相色谱法测定茶新那敏片中无水茶碱含量 [J], 陈燕;孟德钢;陈翠红
5.高效液相色谱法测定盐酸溴己新注射液的含量 [J], 赵连民
因版权原因,仅展示原文概要,查看原文内容请购买

盐酸溴己新葡萄糖注射液与几种弱碱性药物注射液的配伍变化韦曦;欧阳小琳;陈秀强;许盈;何信勇【期刊名称】《儿科药学杂志》【年(卷),期】2014(20)2【摘要】目的:考察盐酸溴己新葡萄糖注射液与几种碱性药物注射液混合后的配伍变化。
方法:选取临床常用几种不同pH值的弱碱性药物注射液,分别与盐酸溴己新葡萄糖注射液(pH 4.2)进行混合实验,观察混合溶液的性状变化,测定其pH值并用高效液相色谱法测定其中盐酸溴己新的含量。
结果:盐酸溴己新在碱性条件下极不稳定,与pH较高的常用药物输液如阿莫西林钠/克拉维酸钾输液、阿莫西林钠/氟氯西林钠输液、地塞米松磷酸钠注射液等混合后可产生白色浑浊,使其含量下降。
结论:盐酸溴己新葡萄糖注射液(pH 4.2)与pH较高的药物输液连续静脉输液时,中间应用5%葡萄糖注射液冲管或分开注射。
【总页数】3页(P39-41)【关键词】盐酸溴己新葡萄糖注射液;PH;含量变化【作者】韦曦;欧阳小琳;陈秀强;许盈;何信勇【作者单位】广西壮族自治区柳州市人民医院;广西科技大学第二附属医院;广西医科大学【正文语种】中文【中图分类】R927.2【相关文献】1.注射用丹参(冻干)注射剂分别与依诺沙星注射液、盐酸溴己新葡萄糖注射液配伍禁忌 [J], 陈迪;赖慧娟;2.注射用丹参(冻干)注射剂分别与依诺沙星注射液、盐酸溴己新葡萄糖注射液配伍禁忌 [J], 陈迪;赖慧娟3.盐酸溴己新葡萄糖注射液与更昔洛韦等几种药物存在配伍禁忌 [J], 张兰;邓兰4.盐酸溴己新葡萄糖注射液与硫辛酸注射液存在配伍禁忌 [J], 邢力丹;郑松;刘丽丽5.盐酸溴己新葡萄糖注射液与碳酸氢钠注射液存在配伍禁忌一例报告 [J], 李庆因版权原因,仅展示原文概要,查看原文内容请购买。
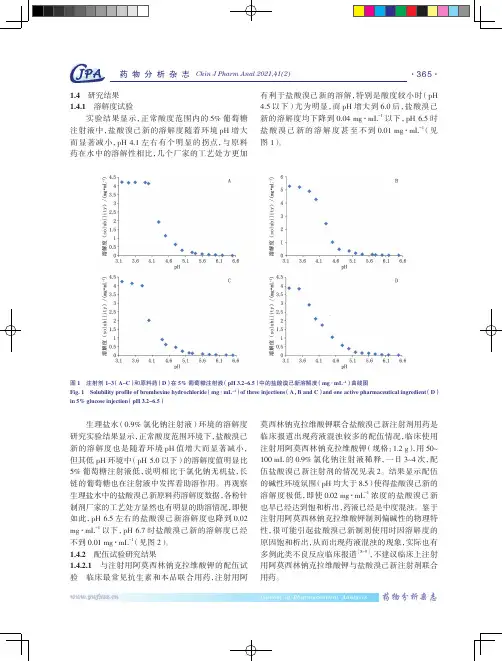
注射剂1~3(A~C)和原料药(D)在5%葡萄糖注射液(pH 3.2~6.5)中的盐酸溴己新溶解度(mg·mL-1)曲线图Solubility profile of bromhexine hydrochloride (mg·mL-1) of three injections (A,B and C) and one active pharmaceutical ingredient in 5% glucose injection (pH 3.2-6.5)生理盐水(0.9%氯化钠注射液)环境的溶解度研究实验结果显示,正常酸度范围环境下,盐酸溴己新的溶解度也是随着环境pH值增大而显著减小,pH环境中(pH 5.0以下)的溶解度值明显比葡萄糖注射液低,说明相比于氯化钠无机盐,长链的葡萄糖也在注射液中发挥着助溶作用。
再观察生理盐水中的盐酸溴己新原料药溶解度数据,各粉针制剂厂家的工艺处方显然也有明显的助溶情况,即便pH 6.5左右的盐酸溴己新溶解度也降到0.02 以下,pH 6.7时盐酸溴己新的溶解度已经0.01 mg·mL-1(见图2)。
配伍试验研究结果 与注射用阿莫西林钠克拉维酸钾的配伍试验 临床最常见抗生素和本品联合用药,注射用阿莫西林钠克拉维酸钾联合盐酸溴己新注射剂用药是临床报道出现药液混浊较多的配伍情况,临床使用注射用阿莫西林钠克拉维酸钾(规格:1.2 g100 mL的0.9%氯化钠注射液稀释,一日3~4伍盐酸溴己新注射剂的情况见表2。
结果显示配伍的碱性环境氛围(pH均大于8.5)使得盐酸溴己新的溶解度极低,即使0.02 mg·mL-1浓度的盐酸溴己新也早已经达到饱和析出,药液已经是中度混浊。
鉴于注射用阿莫西林钠克拉维酸钾制剂偏碱性的物理特性,很可能引起盐酸溴己新制剂使用时因溶解度的原因饱和析出,从而出现药液混浊的现象,实际也有多例此类不良反应临床报道[8-9],不建议临床上注射用阿莫西林钠克拉维酸钾与盐酸溴己新注射剂联合用药。

HPLC法测定盐酸莫西沙星葡萄糖注射液中有关物质的含量莫西沙星作为超广谱氟喹诺酮类抗菌药物,作用于细菌的两个靶位即拓扑异构化酶Ⅱ和Ⅳ,所以本品不仅对敏感的细菌有效,而且对耐药菌株也有高度活性。
临床上对多种感染显示优良的治疗效果[1]。
近几年,由于空气污染等多种原因,我国呼吸系统感染发病率直线上升,本品在此领域内有显著优势,需求量稳步攀升。
本品已逐渐成为治疗呼吸道感染的重要药物。
盐酸莫西沙星的进口产品为拜复乐注射液,中文名称为“盐酸莫西沙星氯化钠注射液”[2]由于德国拜耳的专利限制,目前国内尚无原料药及制剂生产,国内上市品种为拜耳医药的盐酸莫西沙星片及盐酸莫西沙星氯化钠注射液[3-4],尚无盐酸莫西沙星葡萄糖注射液生产,更无关于其有关物质的测定的文献报道。
本文采用公司研制的盐酸莫西沙星葡萄糖注射液,用反相高效液相色谱法测定盐酸莫西沙星的有关物质,结果证明该法专属性强,重现性好,为制剂的质量控制提供了方法学依据。
1 仪器与试药1.1 仪器戴安U3000高效液相色谱仪,检测器:VWD检测器,工作站:变色龙软件;LC-10AT 电子天平。
1.2 试药溶剂:0.50g四丁基硫酸氢铵和1.0g磷酸二氢钾溶于500mL水,加2mL磷酸和0.050g无水亚硫酸钠,加水稀释至1000mL。
杂质对照品:已知杂质A,B,C,D,E样品:自制的盐酸莫西沙星葡萄糖溶液。
2 方法与结果2.1 色谱条件色谱柱:BDS HYPERSIL 4.6mm×250mm,5μm;流动相:甲醇(0.50g/L 四丁基硫酸氢铵,1.0g/L磷酸二氢钾和3.4g/L磷酸混合溶液;28∶72)。
检测波长:293nm;柱温:40℃;流速:1.5mL/min;进样量:20μL;理论板数不低于3500。
2.2 供试品溶液和对照溶液的制备称取供试品3mL,置于10mL棕色容量瓶中,加溶剂稀释至刻度,摇匀,作为供试品溶液;精密量取1mL,置于10mL棕色容量瓶中,加溶剂稀释至刻度,摇匀,精密量取1mL,置于100mL棕色容量瓶中,加溶剂稀释至刻度,摇匀,作为对照溶液。
溴己新致过敏反应1例报告
陈锦霞
【期刊名称】《实用老年医学》
【年(卷),期】2009(23)2
【摘要】1病例资料患者,男,60岁。
主诉因“突发胸闷、气急”来诊。
患者既往反复咳嗽、咳痰十余年,近日加重在我院门诊治疗,予头孢哌酮及左氧氟沙星抗感染治疗,口服溴己新片16mg,3次/d化痰治疗。
无药物明显过敏史,以前曾服用过溴己新。
患者曾于饮酒(20m1左右)后服用溴己新,出现胸闷、气急,面部红,皮肤瘙痒,休息后症状缓解。
当日中午饮酒后又服用溴己新即感胸闷等症状,与前日症状相似且有加重,急来我院。
查体:
【总页数】1页(P128)
【作者】陈锦霞
【作者单位】214155,江苏省无锡市,无锡阳山人民医院内科
【正文语种】中文
【中图分类】R974.1
【相关文献】
1.HPLC法测定盐酸溴己新注射液中盐酸溴己新含量 [J], 吴海林;甄录旭;方宗华;许乐
2.盐酸溴己新葡萄糖注射液配伍禁忌(附一例报告) [J], 王颖;王华
3.溴己新雾化吸入致过敏反应1例 [J], 何瑾;卢珊珊;张峻
4.苯溴马隆(立加利仙)致过敏反应 [J], 谭清武
5.注射平痛新致过敏反应1例报告 [J], 郑云;
因版权原因,仅展示原文概要,查看原文内容请购买。
盐酸溴己新注射剂配伍稳定性考察赵怀碧;李秋月;赵月;许红;李国春【期刊名称】《医药导报》【年(卷),期】2024(43)5【摘要】目的考察注射用盐酸溴己新、盐酸溴己新注射液与不同溶媒配伍后的成品输液稳定性。
方法将注射用盐酸溴己新、盐酸溴己新注射液分别与5%葡萄糖注射液(5%GS)、10%葡萄糖注射液(10%GS)、0.9%氯化钠注射液(NS)及葡萄糖氯化钠注射液(GNS)配伍,考察各成品输液于室温下放置24 h的外观、不溶性微粒、pH值、渗透压、盐酸溴己新含量及有关物质。
结果注射用盐酸溴己新分别与5%GS 50 mL、5%GS 100 mL、5%GS 250 mL及NS 250 mL配伍;盐酸溴己新注射液分别与5%GS 50 mL、5%GS 100 mL、5%GS 250 mL、NS 100 mL、NS 250 mL及GNS 100 mL配伍后,各成品输液外观、不溶性微粒、pH值、渗透压、盐酸溴己新含量及有关物质在24 h内相对稳定。
注射用盐酸溴己新与10%GS 100 mL、GNS 100 mL及NS 100 mL配伍0 h后不溶性微粒数目不符合要求,与NS 100 mL和GNS 100 mL配伍2 h后百分含量分别下降至71.81%和72.32%;盐酸溴己新注射液与10%GS 100 mL配伍在6 h内百分含量下降至94.54%。
结论注射用盐酸溴己新与NS配伍时,成品输液稳定性可能与配伍剂量有关,其适宜配伍剂量为0.016 mg·mL^(-1)。
加强盐酸溴己新注射剂各成品输液配伍稳定性研究,有利于盐酸溴己新及其他静脉输液的临床合理用药。
【总页数】6页(P796-801)【作者】赵怀碧;李秋月;赵月;许红;李国春【作者单位】西南医科大学附属中医医院静脉用药调配中心【正文语种】中文【中图分类】R974.1;R927.11【相关文献】1.参麦、丹参、舒血宁中药注射剂配伍不同溶媒的稳定性考察2.3种常用中药注射剂配伍不同溶媒的稳定性考察3.喜炎平注射液与溶媒及四种注射剂的配伍稳定性考察4.酒石酸布托啡诺、盐酸曲马多及昂丹司琼注射剂体外配伍稳定性考察5.中药注射剂灯盏花素与几种常用溶媒配伍后稳定性考察因版权原因,仅展示原文概要,查看原文内容请购买。
65ChinaPharmaceuticals2020年5月20日第29卷第10期Vol.29牞No.10牞May20牞2020基金项目:江苏省食品药品监督管理局科研项目犤20170230犦。
第一作者:陈乃江,男,大学本科,副主任药师,研究方向为药物分析,(电子信箱)459213946@qq.com。
doi:10.3969/j.issn.1006-4931.2020.10.019盐酸溴己新葡萄糖注射液临床主要用于治疗慢性支气管炎及其他呼吸道疾病,如哮喘、支气管扩张、硅肺等有黏痰而不易咳出的病症。
目前仅有江西科伦药业有限公司和石家庄四药有限公司生产,分别执行局颁标准YBH10902004-2016Z犤1犦牗以下简称“标准1”牘和YBH04412004-2016Z犤2犦牗以下简称“标准2”牘。
两种标准项下均收载了性状、鉴别、pH、有关物质、5-羟甲基糠醛、含量测定等项目。
检验工作中发现,有些鉴别项无法执行,有些项目方法的设置和色谱条件选择有待商榷。
本研究中通过对盐酸溴己新葡萄糖注射液2种质量标准进行比较分析,对试验方法进行探讨,拟对盐酸溴己新葡萄糖注射液的质量标准提出修订建议,为该制剂标准的提高提供参考。
现报道如下。
1质量标准比较现行盐酸溴己新葡萄糖注射液2种质量标准中控制限度基本一致,标准1在鉴别项下增加了盐酸溴己新芳香第一胺反应,在检查项中增加了重金属检测;2种标准的含量测定项下均采用高效液相色谱(HPLC)法,仅流动相体系存在差异;葡萄糖含量测定均采用旋光度测定法。
2种标准比较见表1。
盐酸溴己新葡萄糖注射液质量标准改进建议陈乃江,李玲,王婷婷(江苏省连云港市食品药品检验检测中心,江苏连云港222006)摘要:目的改进现行盐酸溴己新葡萄糖注射液的质量标准。
方法按现行局颁标准YBH10902004-2016Z,YBH04412004-2016Z及《中国药典》牗2010年版或2015年版牘标准,考察盐酸溴己新葡萄糖注射液可改进的鉴别项、有关物质项、5-羟甲基糠醛(5-HMF)项目检查影响因素及改进方法。
HPLC
法测定盐酸溴己新葡萄糖注射液中盐酸溴己新的含量
发表时间:
2015-11-13T14:17:38.437Z 来源:《健康世界》2015年13期供稿 作者: 郑凯 张莹莹
[导读] 朝阳市药品检验检测所 盐酸溴己新葡萄糖注射液用于慢性支气管炎及其他呼吸道疾病如哮喘、支气管扩张。
郑凯
张莹莹
朝阳市药品检验检测所 辽宁朝阳 122000
摘要:目的 建立高效液相色谱法测定盐酸溴己新葡萄糖注射液中盐酸溴己新的含量。方法 采用Agilent C18色谱柱
(
4.6mm×250mm,5μm),流动相为0.1%磷酸二氢钾溶液(用2.0mol/L氢氧化钠溶液调节pH值至7.0)-乙腈(20:80),柱温:
40
℃,检测波长250nm,流速为1.0ml/min。结果 盐酸溴己新进样量在10.024~100.24μg/ml范围内与峰面积有良好的线性关系,平均回收
率为
99.1%(RSD=0.3%,n=6)。结论 该法简便、结果准确、可靠,可用于盐酸溴己新葡萄糖注射液的质量控制。
关键词:高效液相色谱法;盐酸溴己新葡萄糖注射液;含量测定
[Abstract]Objective To establish HPLC method for the determination of Bromhexine Hydrochloride in Bromhexine Hydrochloride and
Glucose Injection by HPLC
.Methods The Agilent C18 column(4.6mm×250mm,5μm)was used with 0.1% potassium dihydrogen
phosphate solution
(adjusted to pH7.0 with 2.0mol/L sodium hydroxide solution)-Acetonitrile(20∶80)as the mobile phase.The
detective
wavelength was 250nm.The flow rate was 1.0ml/min. Results The linear range was 10.024~100.24μg/ml,The average
recovery was 99.1% and RSD was 0.3%
(n=6).Conclusion This method is simple,accurate,and reliable.It can be used in the
quality control of Bromhexine Hydrochloride and Glucose Injection.
[Key words]HPLC;Bromhexine Hydrochloride and Glucose Injection;content determination
盐酸溴己新葡萄糖注射液用于慢性支气管炎及其他呼吸道疾病如哮喘、支气管扩张,矽肺等有粘痰而不易咳出的患者[1],现行质量
标准为单行页标准[
2],其中盐酸溴己新的含量测定方法存在色谱系统适应性差的弊端[3],表现在色谱峰拖尾(拖尾因子不符合要
求),故本文改变色谱条件,采用新的流动相组分,做以下实验,取得了满意的结果:此条件系统适用性符合要求。现报道如下。
1 仪器与试药
美国沃特世e2695-2489型高效液相色谱仪,盐酸溴己新对照品(批号100427-200301,中国药品生物制品检定所);盐酸溴己新葡萄
糖注射液(江西科伦药业有限公司,批号
20130508,20130412,20130625);乙腈(色谱纯);氢氧化钠、磷酸二氢钾(分析纯);水
(重蒸馏水)。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent C18(4.6mm×250mm,5μm);流动相:0.1%磷酸二氢钾溶液(用2.0mol/L氢氧化钠溶液调节pH值至7.0)-乙腈
(
20:80);流速:1.0ml/min;柱温:40℃;检测波长:250nm;进样体积为10μl。
2.2 溶液制备
精密称取对照品25.06mg,置100ml容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为贮备液;精密量取储备溶液5ml,置50ml容量瓶
中,加甲醇稀释至刻度,摇匀,作为对照品溶液;取样品作为供试品溶液;称取处方量的空白辅料,制备阴性对照溶液。
2.3 方法学考察
2.3.1专属性试验:取阴性对照溶液10μl,进样,在该法色谱条件下,在盐酸溴己新相应的位置上无干扰峰,且系统适用性符合要求
(图
1)。
3 讨论
3.1 将供试品溶液在UV-2450型紫外分光光度计进行扫描,以流动相为溶剂,盐酸溴己新的紫外光谱在250nm波长处有最大吸收峰,
故选定此波长处测定含量。
3.2 《中国药典》附录中规定,高效液相色谱图中色谱峰的拖尾因子应在0.95~1.05之间,现行质量标准得出的色谱峰,系统适用性
差,拖尾因子为
1.17,影响峰面积积分的准确性,而本法为0.99,峰型对称且尖锐,峰面积的精密度良好。
参考文献:
[1]陈睿,田兰,刘惠军等.高效液相色谱法测定盐酸溴己新及其片剂的含量和有关物质.药物分析杂志,2007,27(1):132
[2]国家食品药品监督管理局标准(试行)YBH10902004
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2010:799-800;29-31.