第2章官能团化和官能团转换的基本反应.
- 格式:ppt
- 大小:2.44 MB
- 文档页数:72

重要官能团化合物的典型反应及相互转换的常用方法重要官能团化合物的典型反应及相互转换的常用方法官能团是指分子中具有一定功能性质的特定基团。
在化学中,官能团化合物可以通过化学反应进行自由基聚合、化学加成、脱水、缩合等反应,从而发生相互转化。
以下是重要官能团化合物的典型反应及相互转换的常用方法:1. 羰基化合物的反应及转化羰基化合物是指分子中带有羰基(C=O)的有机化合物。
羰基化合物常见的反应有酸、碱和还原反应。
酸性条件下,羰基化合物可形成酸性羟酮等化合物。
碱性条件下,则会发生羰基的亲核加成反应,生成醇、醛、羧酸等化合物。
还原反应则是将羰基还原成相应的醇。
2. 烯烃化合物的反应及转化烯烃化合物是指分子中具有双键结构的有机化合物。
烯烃化合物可进行加成反应、氧化反应和还原反应等转化。
加成反应是烯烃和亲电试剂发生反应,形成醇、醛、酮、胺等化合物。
氧化反应是将烯烃转化成醛、酮和羧酸等氧化产物。
还原反应是将烯烃还原成相应的饱和烃。
3. 烷基化合物的反应及转化烷基化合物是指分子中只有碳-碳单键的有机化合物。
烷基化合物的反应主要包括取代反应、环化反应、消除反应等。
取代反应是一种置换反应,可以将烷基化合物中的氢原子替换成其他官能团。
环化反应则是通过内部反应,将烷基化合物转化成环化化合物。
消除反应则是通过消除分子中的小分子(如水、氯气等),进行分子结构的改变。
4. 芳香烃化合物的反应及转化芳香烃化合物是指分子中含有至少一个苯环的有机化合物。
芳香烃化合物的反应主要包括芳香亲电取代反应、芳香核磁取代反应、芳香取代加成反应等。
芳香亲电取代反应是通过亲电试剂对苯环上的氢原子进行取代反应,形成新的化合物。
芳香核磁取代反应则是通过用核磁试剂取代苯环上的氢原子,形成新的化合物。
芳香取代加成反应则是将亲电试剂加到苯环中的烯丙基位或芳香环上的碳-碳双键上。
总之,重要官能团化合物的典型反应及相互转换的常用方法是化学中的重要内容。
初学者可以通过学习和掌握这些基本反应类型和相关实验技术,不断提高自己的化学实验技能和知识水平。

有机官能团与官能团反应机理有机官能团与官能团的反应机理是有机化学中非常重要的一部分,它涉及到了有机化合物的合成、转化和反应机制等方面。
本文将探讨有机官能团与官能团的反应机理,并从醇、酮、羧酸等常见官能团出发,介绍相应的反应机制。
I. 醇的反应机理醇是有机化合物中的一种常见官能团,其反应机理多种多样。
下面以醇的酸催化酯化反应为例,介绍醇的反应机理。
酯化反应是醇与羧酸反应生成酯的过程,其反应机理可以分为两步:醇的质子化和醇质子化后与羧酸的酰氧根发生亲核进攻反应。
首先,醇在酸性条件下质子化生成醇质子(R-OH2+),醇质子具有更好的亲核性能,使得醇质子更容易与羧酸的酰氧根结合。
随后,醇质子化后的亲核进攻部分(R-OH2+)与羧酸的酰氧根(R-COO-)发生亲核进攻反应,形成酯和质子化后的羧酸。
醇的酸催化酯化反应机理为:R-OH + R'-COOH → R'-COOR + H2OII. 酮的反应机理酮也是有机化合物中常见的官能团,其反应机理也非常重要。
下面以酮的亲核加成反应为例,介绍酮的反应机理。
亲核加成反应是酮与亲核试剂(如醇、胺等)反应生成相应加合物的过程,其反应机理可以分为两步:酮中的羰基碳负电离和亲核试剂的亲核进攻。
首先,酮中的羰基碳通过碱催化负电离,生成羰基碳负离子,羰基碳负离子具有亲电性,容易与亲核试剂发生亲核进攻反应。
随后,亲核试剂的亲核进攻部分与羰基碳负离子结合,形成加合物。
最后,通过质子转移(如酮醇互变异构反应)等步骤,加合物的结构被调整,生成最终产物。
酮的亲核加成反应机理为:R1-CO-R2 + Nu^- → R1-CO-Nu + R2III. 羧酸的反应机理羧酸是有机化合物中含有羧基功能团的一类化合物,其反应机理也非常丰富。
下面以羧酸的酸催化羰基化反应为例,介绍羧酸的反应机理。
酸催化羰基化反应是羧酸与羰基化试剂反应生成酮的过程,其反应机理可以分为两步:羧酸质子化和羧酸质子化后与羰基化试剂的亲核进攻。



第2课时氧化反应与还原反应有机化学反应的应用1.从得氧(失氢)、失氧(加氢)角度认识有机化学中的氧化反应、还原反应. 2。
理解卤代烃的制备方法和卤代烃的性质。
氧化反应与还原反应1.概念有机物分子错误!错误!有机物分子错误!错误!2.常见反应乙醇、乙醛、乙酸的转化关系:CH3CH2OH错误!CH3CHO错误!CH3COOH;化学方程式及反应类型:①2CH3CH2OH+O2错误!2CH3CHO+2H2O,氧化反应;②2CH3CHO+O2错误!2CH3COOH,氧化反应;③CH3CHO+H2错误!C2H5OH,还原反应.3.常见氧化剂和还原剂(1)氧化剂:氧气、KMnO4溶液、臭氧(O3)、银氨溶液和新制的氢氧化铜悬浊液等。
(2)还原剂:氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。
1.判断正误(1)发生消去反应。
( )(2)HCHO―→CH3OH发生还原反应。
()(3)CH3OH错误!错误!中,①②③步反应均为氧化反应。
()(4)CH3CH2OH―→CH2===CH2发生还原反应。
()答案:(1)×(2)√(3)√(4)×2.CH3CHO+H2错误!CH3CH2OH可看做()A.氧化反应、加成反应B.氧化反应、还原反应C.还原反应、加成反应D.还原反应、取代反应解析:选C。
反应物CH3CHO中存在,而生成物中全部为饱和键,故可看做加成反应,而又是与H2加成,故又可看做还原反应.1.有机化学反应中常见的氧化反应(1)醇的氧化-—去氢式2CH3CH2OH+O2错误!2CH3CHO+2H2O反应机理:醇分子脱去羟基上氢原子和连有羟基的碳原子上的氢原子后,原羟基氧原子和连有羟基的碳原子有多余电子而再形成新的共价键。
(2)醛的氧化-—加氧式2CH3CHO+O2错误!2CH3COOH反应机理:醛的氧化是在醛基的C-H键的两个原子间插入O原子.(3)有机化合物的燃烧.(4)烯烃、炔烃、酚、醛等有机化合物使酸性KMnO4溶液退色.(5)含醛基的有机化合物与新制Cu(OH)2悬浊液、银氨溶液的反应。


第2章官能团与有机化学反应-----烃的衍生物第1节有机化学反应类型【教学目标】1掌握加成反应、取代反应、消去反应等几种。
掌握这些反应类型,将有助于学生深入学习研究有机化合物的性质和有机化学反应。
2能分别从加(脱)氧、脱(加)氢和碳原子的氧化数变化的角度来认识氧化反应(还原反应),3引导学生从多种角度来认识和理解有机化学反应,既关注参加反应的有机化合物及其结构特点、试剂的特性、发生反应的条件,还关注它们发生什么类型的反应、生成什么样的产物。
【教学重难点】对主要有机化学类型的特点的认识,根据有机化合物结构特点分析它能与何种试剂发生何种类型的反应【学案导学】1.加成反应是,一般的通式是2.能发生加成反应的有机物,分子中一般含有、、、、等官能团。
3.能与分子中的不饱和键发生加成反应的有、、、、、等。
4.取代反应是一般通式是:5.烷烃及苯环发生取代反应时是被取代,与碳原子相连的、等也能被取代。
6.消去反应是7.发生消去反应时,反应的产物与试剂的类型密切相关,从醇分子中脱水制烯烃时,常选用、等条件,从卤代烃中脱去卤化氢时,通常选用、等条件。
从邻二卤代烃中脱去卤素单质时,通常选用等试剂。
8.有机化学中,氧化反应是指;还原反应是指9.碳元素的氧化数一般在和之间。
如果碳原子的氧化数为-4时,只能被;如果碳原子的氧化数为4时,只能被;如果碳原子的氧化数为—4~ +4之间,既能又能。
10.在常见的氧化反应和还原反应中,常见的氧化剂有、、、、等;常见的还原剂有、、等。
11.加成反应:(1)加氢①CH2=CH2 + H2——②CH≡CH + H2 ——③+ H2 ——④CH3CHO + H2 ——(2)加卤素①CH2=CH2CH3+ Br2——②CH≡CH + Br2——(3)加卤化氢①CH2=CH2 + HCl ——②CH≡CH + HCl ——(4)加水①CH2=CH2 + H2O ——②CH≡CH + H2O ——(5)其它①CH≡CH + HCN ——②CH3CHO + HCN ——方法引导page47用式子表示加成反应的一般结果12.取代反应(1)卤代①CH4+ Cl2——②+ Br2——③+ Br2 ——(2)硝化:①+ HONO2——②+ HONO2 ——(3)磺化:①+ HOSO3H ——(4)其它:①R—X + H2O ——③RCOOH + R`OH ——方法引导page48用式子表示取代反应的一般结果知识支持page49a 和b的含义CH3—CH2=CH2 + Cl2——完成page49迁移应用的方程式13.消去反应①CH3CH2OH ——反应注意事项:②CH3—CH—CH3 + NaOH ——Br完成page51迁移应用的方程式小结:什么样的醇和卤代烃能够发生消去反应14.氧化反应(1)完全氧化①C n H2n+2 + O2——②C n H2n+ O2——④C x H y+ O2——⑤C x H y O2 + O2——(2)不完全氧化①CH3CH2OH + O2——条件:规律:小结:什么样的醇可以被氧化为醛②CH2=CH2 + O2——③CH3CH2CH2CH3 + O2—5.还原反应①CH3CHO + H2——方法引导page49如何规定有机物中各原子的氧化数课堂检测1.关于加成反应,下列说法不正确的是A.不但碳碳双键可发生加成反应,碳氧双键也可以发生加成反应B.加成反应后反应物原有的官能团发生了置换而生成另一种的化合物C.不同类型的不饱和键通常能与不同的试剂发生加成反应D.通常是带负荷部分的原子或原子团加在带同性电荷的原子上2.含有一个叁键的炔烃,氢化后的产物结构简式为:CH3CH2CH(CH3CH2)CH2CH(CH3) CH2 CH3,此炔烃可能有的结构简式有A.1种B.2种C.3种D.4种3.下列变化属于加成反应的是()A.乙烯通过浓硫酸B.乙烯使高锰酸钾溶液褪色C.乙烯使溴水褪色D.乙烯在磷酸做催化剂条件下与水反应4.将1mol CH4与Cl2发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的Cl2为()A.0.5mol B.2mol C.2.5mol D.4mol5.已知卤代烃在一定条件下既可发生水解,又可发生消去反应,现由2-溴丙烷为主要原料,制取1,2-丙二醇时,需要经过的反应是( )A.加成-消去-取代B.消去―加成―取代C.取代―消去―加成D.取代―加成―消去6.下列说法正确的是( )A.能使溴水褪色的物质一定能和溴水发生加成反应B.醇和酸作用,生成酯和水的反应叫酯化反应C.乙醇脱水成醚、酯的水解、苯的硝化、皂化反应的实质都是取代反应D.所有的醇都能被去氢氧化生成相应的醛或酮7.有机化合物分子中能引入卤原子的反应是()A.消去反应B.取代反应C.加成反应D.加聚反应8.下列反应属于取代反应的是( )A.甲醛→甲醇B.乙醛→乙酸C.乙醇→乙酸乙酯D.乙醇→乙烯9.某有机物的结构简式:CH2 = CHCH—CHO,下列对其化学性质的判断中,不正确的是:A.能被银氨溶液氧化B.能使KMnO4酸性溶液褪色C.1mol该有机物只能与1molBr2发生加成反应D.1mol该有机物只能与1molH2发生加成反应10.进行一氯取代反应后,只能生成3种沸点不同的产物的烷烃是()A.(CH3)2CHCH2CH2CH3B.(CH3CH2)2CHCH3C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH311.某烃的一种同分异构体只能生成一种一氯代物,该烃的化学式可能是()A.C H38B.C H410C.C H512D.C H614课后习题1.分子式为C5H12O的醇中,不能发生催化氧化反应的结构简式为________;不能发生消去反应的结构简式为________________2.与CH2=CH2→CH2Br—CH2Br的变化属于同一反应类型的是( )A.CH3CHO→C2H5OH B.C2H5Cl→CH2=CH2D.CH3COOH→CH3COOC2H53.根据甘油(丙三醇)的结构,它不可能发生的反应是( )A.消去反应B.取代反应C.氧化反应D.加成反应4.1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2L氢气(标准状况),则A分子中必有一个_________基,若此基团在碳链的一端,则A的结构简式为______________,A与浓硫酸共热,分子内脱去1分子水,生成B,B的结构简式为____。

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去1通过加成反应消除不饱和键;2通过消去反应、氧化反应或酯化反应消除羟基—OH;3通过加成反应或氧化反应消除醛基—CHO;4通过消去反应或水解反应消除卤素原子;3.官能团的转化1利用衍变关系引入官能团,如卤代烃错误!伯醇RCH2OH错误!醛错误!羧酸;2通过不同的反应途径增加官能团的个数,如3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的;如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环;2成环反应生成的五元环或六元环比较稳定;2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示;1与HCN的加成反应2加聚或缩聚反应,如n CH23酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O;3.碳链的减短1脱羧反应:R—COONa+NaOH错误!R—H+Na2CO3;3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解;4烃的裂化或裂解反应:C16H34错误!C8H18+C8H16;C8H18错误!C4H10+C4H8;合成路线的选择1.中学常见的有机合成路线2一元合成路线R—CH=CH2错误!卤代烃错误!一元醇错误!一元醛错误!一元羧酸―→酯3二元合成路线CH2=CH2错误!CH2X-CH2X错误!二元醇错误!二元醛错误!二元羧酸→错误!3芳香化合物合成路线:2.有机合成中常见官能团的保护1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH变为—ONa或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH;2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键;3氨基—NH2的保护:如在对硝基甲苯错误!对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2;防止当KMnO4氧化—CH3时,—NH2具有还原性也被氧化;有机合成中有机物官能团的引入、消除和转化方法练习例1工业上用甲苯生产对羟基苯甲酸乙酯,其过程如下:据合成路线填写下列空白:1有机物A的结构简式:____________________________________________________,B的结构简式:_____________________________________________________________;2反应④属于__________反应,反应⑤属于____________反应;3③和⑥的目的是__________________________________________________________;4写出反应⑥的化学方程式:_________________________________________________;例2由环己烷可制备1,4-环己醇二醋酸酯;下面是有关的8步反应其中所有无机产物都已略去;1在上述8步反应中,属于取代反应的有________,属于加成反应的有________,反应④属于________反应;2写出下列化合物的结构简式;B:__________________,C:________________;3写出反应④、⑤、⑥的化学方程式;④____________________________________________________________ ____________,⑤____________________________________________________________ ____________,⑥____________________________________________________________ ____________;4写出在NaOH溶液中水解的化学方程式:______________________;例3乙醇在与浓硫酸混合共热的反应过程中,受反应条件的影响,可发生两类不同的反应类型:1,4-二氧六环是一种常见的溶剂;它可以通过下列合成路线制得:错误!错误!错误!错误!错误!错误!其中的A可能是A.乙烯B.乙醇C.乙二醇D.乙酸例4肉桂酸甲酯M,常用作调制具有草莓、葡萄、樱桃等香味的食用香精;M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应;测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1;1肉桂酸甲酯的结构简式是;2G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示图中球与球之间连线表示单链或双键;G的结构简式为;3以芳香烃A为原料合成G的路线如下:①化合物E中的含氧官能团有________填名称;②E―→F的反应类型是__________,F―→G的化学方程式为_______________________;③写出符合下列条件的F的同分异构体的结构简式只写一种:____________________;ⅰ.分子内含苯环,且苯环上只有一个支链;ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;ⅲ.它不能发生水解反应;例5 食品添加剂必须严格按照食品安全国家标准GB2760-2011的规定使用;作为食品添加剂中的防腐剂G和W,可经下列反应路线得到部分反应条件略;1G的制备①A与苯酚在分子组成上相差一个CH2原子团,它们互称为__________;常温下A在水中的溶解度比苯酚的______填“大”或“小”;②经反应A→B和D→E保护的官能团是__________;③E→G的化学方程式为_____________________________________________________;2W的制备①J→L为加成反应,J的结构简式为__________________________________________;②M→Q的反应中,Q分子中形成了新的____________填“C—C键”或“C—H键”;③用Q的同分异构体Z制备,为避免R—OH+HO—R错误!R—O—R+H2O发生,则合理的制备途径为酯化、______、________填反应类型;④应用M→Q→T的原理,由T制备W的反应步骤为第1步_________________________________________________________________ ____;第2步:消去反应;第3步:_____________________________________________________________第1、3步用化学方程式表示例6 利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品的合成路线如下:提示:根据上述信息回答:1D不与NaHCO3溶液反应,D中官能团的名称是________,B→C的反应类型是________;2写出A生成B和E的化学反应方程式:______________________________________;3A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下,I和J分别生成和,鉴别I和J的试剂为________;500 ℃4A 的另一种同分异构体K 用于合成高分子材料,K 可由 制得,写出K 在浓硫酸作用下生成的聚合物的结构简式:________________________________;例7 狄尔斯-阿德耳Diels-Alder 反应也称双烯合成反应;试回答下列问题:1Diels-Alder 反应属于______反应填有机反应类型;2某实验室以 和 合成 ,请用合成反应的流程图,表示出最合理的合成方案注明反应条件;提示:①RCH 2CH====CH 2+Cl 2――――→RCHClCH====CH 2+HCl②合成过程中无机试剂任选;③合成反应流程图可表示为A 错误!B 错误!C ―→……―→H例8 据中国制药报道,化合物C 是用于合成抗“非典”药品盐酸袪炎痛的中间体,其合成路线为已知:1写出下列物质的结构简式B :__________________,C :__________________反应②产物HCl 中的H元素来自于氨基;2A →D 的转化中涉及的反应类型有________填字母序号;A .加成B .取代C .聚合D .氧化E .还原3反应①②中属于取代反应的是______填数字序号;4请你设计由甲苯→…→D 的反应流程图有机物用结构简式表示,必须注明反应条件;提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:甲苯错误!……错误!D有机合成中有机物官能团的引入、消除和转化方法练习答案例12氧化酯化或取代3保护酚羟基,防止被氧化例21①⑥⑦③⑤⑧消去例3A例4例5 1①同系物小②—OH或酚羟基例6 1醛基取代反应例7 1加成2如图所示:例8。
5-fH 3O +Hg 2+ / CH 3CN (aq)C=C-OR C=C-SROCH 3OH 3O+SCH 3OHg 2+3OH 3O Hg 2+3H 3O +OO O SSS SSRSR O O OR OR 5-gHg 2+ / H 3O +H 3O + / solv (aq)H 3O + / solv (aq)Hg 2+ / H 3O +OR OROH OHH 3O + / solv (aq)a very common protecting group, deprotect back to ketoneHC OEt OEt OEtRMgX / H 3O +HC OEt OEt OEtRMgXRCHON H+2Cr 2O 7-2N HCl.CrO 3Ag 2O:1. a mild oxidizing agent2. must be freshly prepared: NaOH into AgNO 3 (aq)3. may involve surface change, react with CO 2, lightSwern oxidation: (DMSO, oxalyl chloride, Et 3N)drawback: react at low T Collins reagent: (CrO 3 - 2 Py)1. drawback: use 6 equivalent, a messy reaction 2. must be very dry, fire easily; purify by CaH 23. an old oxidizing material, isolated by Collin.i. PCCii. PDCix. K 2R C OHO aldehyde1st alcohol2nd alcohol1st alcoholR C OHOR C ROR C HO 5-h i. PCC ii. PDCJOC, 1985, 50, 1332.N OCH 3OHPDC (pyridinium dichormate)(H 2Cr 2O 7 + 2 Py)PCC (pyridinium chlorochromate) (Py-HCl-CrO 3)most widely used use 1 - 1.2 eq.Pfitzner-Moffatt oxidationOO BrDMSOO OOH360 %Synth. Commun., 1986, 16, 1343.JOC, 1977, 42, 1991.Synthesis, 1981, 165.O I OOAcAcOpH 6: weak acid buffer, avoid interfere with ketal groupMcMurray reactioni. Corey approach: subtituted-quinone // H 3O +ii. Watt approacha. PhCHO // MCPBA // H 3O +b. ArPhO // MCPBA // H 3O +c. NBS // KOH // H 3O +PhOPh PhOPhNH 2Ph PhNH 2NC O H // H 3O +O O5-i.15-i.2i. Et 3N // H 3O +Nef reactionii. TiCl 3 / pH 1 or 6iii. SiO 2 / NaOH // H 3O +JACS, 1977, 99, 3861.iv. LDA / MoO 5-Py -v. NaOH // CH 3O OH 3O +vi. KMnO 4 / KOHChem. Rev. 1955, 55, 137.5-k IOOOH O(3 eq.)JACS, 2001, 123, 3183.CH 3CHO2. DDQ / TFA.Synthesis, 1979, 537.JCS, 1932, 1875.Ph-F / DMSO 3.1. SeO 2a select oxidantindrect: change to RC-OH followed by oxidation direct:1. DMAPO / DBU / CH 3CN i. DMSO / AgBF 4RBr DMSO / AgBF 4- Me 2SBull Soc. Jpn., 1981, 54, 2221.THL, 1974, 917.2. NaIO 4 / DMFO Br84 %oNaIO 4 / DMF a new method 3. DMSO reagents:ii. DMSO / ZnSRCHBrMeRC(O)MeDMSO BrOH OOH JACS, 2003, 68, 2480.ROAgBFTHL, 1975, 4467.C C R CHOHRR C C HC C R R'R C C HR C C ArR C C HC C R PhR C C Hsteric base, prevent Nu attack n -BuLi: not MeLi, or t -BuLi, fire easily RX: R-Br, R-TOS, RCHO, RC(O)Rn -BuLi / R'CHO // Ac 2O // KO t BuClOMeN Liiii.ii. (Ph 3P)2PdCl 2, CuI, Et 2NH / PhIi. n-BuLi / RX6-b6-a b c d e g 6-aC CC CC Csulfonic acid: PhSO 3H; sulfinic acid: PhSO 2H; sulfenic acid: PhSOHiv. CuI, NaI, Na 2CO 3, RC C CH 2ClR C C HCl CH 2CC R'RCCCH 2CCR'Synthesis, 2000, 691.RCH 2-SO 2Ph RC CHh f iRCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXin fact: convert to C=C firstlyii. protect - deprotecti. move to terminal 6-cNH 2NHKuse: KAPAuse: Co (CO)8 // Fe(NO 3)3, EtOHJACS, 1975, 97, 891.6-duse: i. Br 2 / CCl 4 // KO t Bu6-euse: Pb(OAc)4, LiCl // KO t Bu // Br 2/CCl 4 // KO t Fe(NO 3)3: weak oxidizing agentii. Br 2 // KOHJA CS, 1941, 63, 1180.PhPhPhPh6-fi. NaBH 4, H 3O +, Br 2, KOtBuii. NH 2OH, NaNO 2 / H 2SO 4 // Ac 2O / DMAPiii. LDA, ClPO(OEt)2ON NODMAP:4-N,N-D i m ethyl a minop y ridinemixture ofAc 2O / DMAP:N NC CH 3O6-guse: TsNHNH 2 / EtOH, heatTHL, 1967, 3943.OHO3(l)O(MVK)CH 3CH CH 2Robinson Annulation German invention, as acylating agentLDA: Li N(iPr)2, ignored a long time, re-introduced by Michigan State U. became famous, appeared every weekHORLiNH 2 / NH 3 (l)RXuse: LiNH 2 / NH 3 (l) / R-XO Cl6-h6-i.JA CS, 1958, 80, 4599.JA CS, 1955, 77, 3293.Me PhHOSO 2CF 3Me C C Phvia:Me CPhJOC, 1978, 43, 364.ArAr'H Br Ar C C Ar'NaOEtvia:Ar Ar'Br i. NaOEt (when X = Br)ii. BuLi (when X = -OSO 2CF 3)?heatRCH=CH 2:PBu RCH 2CH 2-O-PBu 3RCH 2CH 2-OHPh-Se-PBu 3Ph-Se-CNmechanism:MCPBA OAc CO 2MeOAcMeO MeO 2CNO 2SeNOAcCO 2MeOAc MeOMeO 2Cminorapplied for reactions: without rearrangement;no regiosiomerCC (CO 2H)2 / benzeneOH PhPhOO Cl ClClClOCl Cl NC NCO iii. Pd-C; or Ni; Pt, Rhii. chloronaili. DDQ use base: DBNi. CH 3I / Ag 2ii. HCHO / HCO 222use: heatuse: heatb 7-i. p-TSOH.H 2O or CSA ii. weak acid: HOAc; HCO 2H; H 2C 2O 4use:C C HIC C H NH 2C C H OC(S)SMe C C H OAc C C H OMs C C H OH a7-i h gCCX C C C CC CHC O C Cf e dc b a 7--C(O)-CH 3CH-CH CH-CX C-OHjCX-CYNaI / Zn (Cu)i. Zn / acetonei. CSCl 2/C COMs OMs C C BrBrCCOH OHc7-CCOH Iii. CSCl 2 / P(OMe)3P NNPhPOCl 3 / py // Snvia:C C IIapplication: i. protect alkene: via Br 2 // ZnCCCCC 36 o C CCCC=C 31 o C CCCC C Cl Cl148 o CS OR ORC C BrOAcZn / HOAcOAcO AcOAcOBrOAcZn OOAc OAcOAcJOC, 1978, 43, 364.HOAc, 1998, 2113.ii. In / MeOH ii. purify compoundd7-e7-i. WCl 6 / RLi ii. LiPPh 2 / CH 3I product retention product inversionNa R C HC HCH 2CH 2CH 2OH OClRiii. Na(special structure):7-d.7-d.S R 1R 2R 1R 2(EtO)3Puse: (EtO)3PSynthesis , 1977, 1134.via : betaine, oxaphosphetane (NMR)Onot good for Ph 3P=CH 2function as base:expensivedifficult to prepareOEtCNPPh 3CNPPh 3H OPPh 3O CO 2Me+notPh 3P CH EtH C OCO 2Me notPh 3P CH CO 2MeEtH O++++stable ylid gives trans (E)unstable ylid gives cis (Z)water soluble, removed by extraction(comparison: O=PPh 3 highly soluble in organic solvent)use:LiPh SON MeCH 2// Al (Hg)Me 3SiCHR -Li +Ph 3SiCH 2-Li + === Ph 3SiCH 2Br + n-BuLi (exchange)Me 3SiC -H-MgBr === Me 3SiCH 2Cl + Mg (metal reduction)Ph 3SiC -HCH 2Ph === Ph 3SiCH=CH 2 + PhLi (addition to vinylsilane)Me 3SiC -HCO 2Et === Me 3SiCH 2CO 2Et + Li (metalation)Me 3SiCH=PPh 3 === Me 3SiCH 2PPh 3+ X - + KHRO = MeO-, EtO-use: (RO)2PO-CHR'use: Ph 3P-CHR'vi. Sulfoximide (Johnson C.)iii. Silyl Wittig Reaction (Peterson Reaction)ii. Phosphonate Wittig Reaction (Horner-Emmons Modification)i. Wittig Reaction 7-f7-f.Synthesis, 1984, 384.THL, 1981, 2751.JOC, 1968, 33, 780.iv. CH 2(ZnI)2Chem. Lett, 1995, 259.Synlett, 1988, 12, 1369.2CH 2(ZnI)2v. CH 2CHBr 2, Sm, SnI 2 / CrCl 3, THFRO Rvii. Grignard reagent:1. TMSCH MgCluse: TMSCH 2MgClTHL, 1973, 3497.THL, 1988, 4339. 2. NaOAc, AcOHmethylenationOC RR'3H advantages over the Wittig:1. by-products are more easily removed,2. reaction suffers less from steric effects.via:(olefination reaction)1953 discover7-f.2not for Wittig, ylid unstableJOC, 1978, 43, 3253.JACS, 1974, 96, 4706.Chem. Lett, 1973, 1041.TiCl 3-LiAlH 4 / THF TiCl 3 / Mg TiCl 4 / Zn TiCl 4 / K ii. McMurry Couplingi. use: N 2H 4 / H 2S / Pb(OAc)4BASF, 1973, 2147.via:Zn-CuP(OEt)1. H 2S2. Pb(OAc)431. H 2S2. Pb(OAc)4OON SN N N OSN NSON ON NNSN NON NO OSO ON NOO OO OTiCl 3N 2H 4g7-form trans alkene:form cis alkene:i. Li / NH 3; or other IA metals ii. Li / EtNH 2iii. LiAlH 4 / THFi. H 2 / Ni 2B (P-2 catalyst)ii. H 2 / Pd-CaCO 3 (Lindlar catalyst)iii. H 2 / Pd-BaSO 4iv. B 2H 6 / HOAc (Diborane)v. N 2H 2vi. HCHO / Pd-C / Et 3Nnot use H 2 / Pt: might convert to alkaneh7-all form trans alkene:i. R 2BH / Br-CN (hydroboration)C CHR HHii. DIBAL / n-BuLi / CH 3I (hydroalumination)iii. Cp 2ZrClH / RX (hydrozirconation)application: protecting groupvia dihalidevia halohydrinvia epoxidevia diene-olefin additionC=C C CX XC CH XC=CC COC=CC=CC=C C=CC=CC CC Cnot for double bond might moveMnO2 / Ph3P CH3 Br- / MTBDNNNCH3MTBD via diradicalJA CS, 1998, 100, 877.Ph Ph7-i7-j8-a 8-a.28-a.38-a.41. HI 3. TsCl / C 62. PI 3JCS, 1905, 87, 1592.CH OH CH I PI 38-a.12. F 3S-NEt 21.(DAST)SN SF O OOO Chem. Rev., 1996, 96, 1737.2FCH 3SO O OH ONCHCl 2CH 3 1. CF 3CHFCF 2NEt 22. HOAc / i PrOH$ 65 / 500 g $ 80 / 50 gPBr 3PI 3$ 35 / 1000 g PBr 3$ 500 / 125 gJOC, 1993, 58, 3800.8-C-XC-OH C(O)Z d c b a C-NH 2C=O 2. PPh 3 / I 2e C-H8-d8-d.RC O OH1. AgNO 3/KOH 2R Br Ber. 1942, 75, 296.8-d.2ClOClRhCl(PPh 3)38-b NaNO 2 / HCl / HBF 4 /Chem Rev., 1956, 56, 219.8-c CF 2Br 2 / ZnFF JCS.PT I, 1993, 335.8-e8-e.1I86 %I 2 / HNO 3JACS, 1917, 39, 437.8-e.3I / HNO PhCH 2C(O)CH 3PhCHC(O)CH 3FN SFO OF +Chem. Rev., 1996, 96, 1737.F-TEDA-BF 4, 1994, 149.F 2-N 2 / CFCl 3-CHCl 3JOC, 1988, 53, 2803.90 %1. regioselective fluorination at the more substituted positions2. electrophilic in natureF -N 33ONXR 1R 3OOR 2HMg(ClO 4)2R 1R 3O OR 2XNBX / Mg(ClO 4)2JOC, 2002, 67, 7429.8-e.2X = Cl, Br, IX = Cl, Br, INBXNBX:i.ii.iii.iv.RRFR = CH 3CO, COCF 3, CCl 3, NO 2 HF / electrolysis1.4-1.6 Valready industrilized NF 3O / TBAH / CH 3CNv.TBHA: TetrabutylammoniumhydroxideTHL, 2003, 44, 2799.9-a9-C-CH 3C-X a (CH 3)3AlMe 3Al98 %Organomet. Chem. Rev., 1996, 4, 47.CH 2Cl 2bridgehead methylationB 2H 6 / H 2NOSO 3HB 2H 6 / H 2NO CH 3CN / H 3O +B 2H 6 / NH 2Cl C-C-NHCOCH 3C=CC-C-NH 24-freductive amination!Leuckart reactionmost generalvia: hydrazone4. PhNHNH 2 // Al (Hg)2. Me 3SiN 3 // LiAlH 43. NH 3 (excess) // RaNi / H 21. RNH 2 // NaBH 3CN5. NH 4+HCO 2-4-e6. RNH 2 / n -Bu 2SnClH / HMPASynthesis, 2000, 789.5. P 4S 10 // RaNi4. Et 3O + BF 4- // NaBH 43. B 2H 62. NaBH 3(OCOR)1. LiAlH 46. Lawesson's reagent // RaNi4-h4-g4-g.a 4-g.b R C NH 2R C NH 2R'formform AlH 3 / THF BrC NBr NH 2JOC, 2000, 65, 8152.AlH 3TH, 1989, 30, 5137.JOC, 1987, 52, 3901.R'Li // NaBH 4R'MgX // NaBH 4R'MgX // Li/NH 3(l)R'2CuLi // NaBH 4TH, 1989, 30, 5139.JOC, 1993, 58, 4313.R C NR C NH 2R'4-iNH 2ONHOCH 3O PhI(OAc)23JOC, 1993, 58, 2478.RCO NH 2RCO NIPh OAcRN C OR NH COOCH 3CH 3OHPhI, OAcRPhI(OAc)4-i.2C NH 2RCH 2PhI(OAc)2 // KOH / CH 3OHC(OR)2C(SR)2h C-NH 2C-NO 2C N C C 5-ag f d c b a 5-C=C-OR C=C-SR C-OH C=N-OH C=N-H C=S C=O C=Ov. via: epoxysilaneRCO CRRCO CH 2R42SOCl H 3O +23OO2-CrO 4OONaBH 3H 3O +3ZnTsNHNH 2MeLiTMSCl MCPBA LAH324CH 2CORRCH 2CORRMsClKOtBuHgCl 3SSCH 2CORRPhCHOi. via: α-CO 2Hii. via: α-haloketoneiii. via: aldol processiv. via: thioenol etherRCO CH 2Rdrawback: require simple structure, use many powerful agents: MeLi, LAH, MCPBAe i j C-Br k C-Hii. MCPBAi. hydrolysis5-b5-c C=N-OHC=N-Hi. RaNi ii. TiCl 3iii. KMnO 4 / Al 2O 3H 3O +5-dHg 2+ / H 2O JOC, 1972, 37, 2138.JOC, 1970, 35, 858.HgSO 4 / H 2O / H 2O5-c.15-c.2THL, 2001, 42, 4775.1. DIBAL / H 3O +5-eStenphen reductionmostly for.Syn, 1925, 3, 1874.2. HCl./ SnCl 2 / Et 2O 5-e.1R -CH 2-CN5-e.25-e.3-CH 2-C OHR -CH -C OH R'R -CH -C O R"R'R'X / n -BuLiCH 3I R''MgBr H 3O +3.H 3O +B 2H 6 / H 2NOSO 3HB 2H 6 / H 2NO CH 3CN / H 3O +B 2H 6 / NH 2Cl C-C-NHCOCH 3C=CC-C-NH 24-freductive amination!Leuckart reactionmost generalvia: hydrazone4. PhNHNH 2 // Al (Hg)2. Me 3SiN 3 // LiAlH 43. NH 3 (excess) // RaNi / H 21. RNH 2 // NaBH 3CN5. NH 4+HCO 2-4-e6. RNH 2 / n -Bu 2SnClH / HMPASynthesis, 2000, 789.5. P 4S 10 // RaNi4. Et 3O + BF 4- // NaBH 43. B 2H 62. NaBH 3(OCOR)1. LiAlH 46. Lawesson's reagent // RaNi4-h4-g4-g.a 4-g.b R C NH 2R C NH 2R'formform AlH 3 / THF BrC NBr NH 2JOC, 2000, 65, 8152.AlH 3TH, 1989, 30, 5137.JOC, 1987, 52, 3901.R'Li // NaBH 4R'MgX // NaBH 4R'MgX // Li/NH 3(l)R'2CuLi // NaBH 4TH, 1989, 30, 5139.JOC, 1993, 58, 4313.R C NR C NH 2R'4-iNH 2ONHOCH 3O PhI(OAc)23JOC, 1993, 58, 2478.RCO NH 2RCO NIPh OAcRN C OR NH COOCH 3CH 3OHPhI, OAcRPhI(OAc)4-i.2C NH 2RCH 2PhI(OAc)2 // KOH / CH 3OHC(OR)2C(SR)2h C-NH 2C-NO 2C N C C 5-ag f d c b a 5-C=C-OR C=C-SR C-OH C=N-OH C=N-H C=S C=O C=Ov. via: epoxysilaneRCO CRRCO CH 2R42SOCl H 3O +23OO2-CrO 4OONaBH 3H 3O +3ZnTsNHNH 2MeLiTMSCl MCPBA LAH324CH 2CORRCH 2CORRMsClKOtBuHgCl 3SSCH 2CORRPhCHOi. via: α-CO 2Hii. via: α-haloketoneiii. via: aldol processiv. via: thioenol etherRCO CH 2Rdrawback: require simple structure, use many powerful agents: MeLi, LAH, MCPBAe i j C-Br k C-Hii. MCPBAi. hydrolysis5-b5-c C=N-OHC=N-Hi. RaNi ii. TiCl 3iii. KMnO 4 / Al 2O 3H 3O +5-dHg 2+ / H 2O JOC, 1972, 37, 2138.JOC, 1970, 35, 858.HgSO 4 / H 2O / H 2O5-c.15-c.2THL, 2001, 42, 4775.1. DIBAL / H 3O +5-eStenphen reductionmostly for.Syn, 1925, 3, 1874.2. HCl./ SnCl 2 / Et 2O 5-e.1R -CH 2-CN5-e.25-e.3-CH 2-C OHR -CH -C OH R'R -CH -C O R"R'R'X / n -BuLiCH 3I R''MgBr H 3O +3.H 3O +5-fH 3O +Hg 2+ / CH3CN (aq)C=C-OR C=C-SROCH 3OH 3O+SCH 3OHg 2+3OH 3O Hg 2+3H 3O+OO O SSS SSRSR O O OR OR 5-gHg 2+ / H 3O +H 3O + / solv (aq)H 3O + / solv (aq)Hg 2+ / H 3O +OR OROH OHH 3O + / solv (aq)a very common protecting group, deprotect back to ketoneHC OEt OEt OEtRMgX / H 3O +HC OEt OEt OEtRMgXRCHON H+2Cr 2O 7-2N HCl.CrO 3Ag 2O:1. a mild oxidizing agent2. must be freshly prepared: NaOH into AgNO 3 (aq)3. may involve surface change, react with CO 2, lightSwern oxidation: (DMSO, oxalyl chloride, Et 3N)drawback: react at low T Collins reagent: (CrO 3 - 2 Py)1. drawback: use 6 equivalent, a messy reaction 2. must be very dry, fire easily; purify by CaH 23. an old oxidizing material, isolated by Collin.i. PCCii. PDCix. K 2R C OHO aldehyde1st alcohol2nd alcohol1st alcoholR C OHOR C ROR C HO 5-h i. PCC ii. PDCJOC, 1985, 50, 1332.N OCH 3OHPDC (pyridinium dichormate)(H 2Cr 2O 7 + 2 Py)PCC (pyridinium chlorochromate) (Py-HCl-CrO 3)most widely used use 1 - 1.2 eq.Pfitzner-Moffatt oxidationOO BrDMSOO OOH360 %Synth. Commun., 1986, 16, 1343.JOC, 1977, 42, 1991.Synthesis, 1981, 165.O I OOAcAcOpH 6: weak acid buffer, avoid interfere with ketal groupMcMurray reactioni. Corey approach: subtituted-quinone // H 3O +ii. Watt approacha. PhCHO // MCPBA // H 3O +b. ArPhO // MCPBA // H 3O +c. NBS // KOH // H 3O +PhOPh PhOPhNH 2Ph PhNH 2NC O H // H 3O +O O5-i.15-i.2i. Et 3N // H 3O +Nef reactionii. TiCl 3 / pH 1 or 6iii. SiO 2 / NaOH // H 3O +JACS, 1977, 99, 3861.iv. LDA / MoO 5-Py -v. NaOH // CH 3O OH 3O +vi. KMnO 4 / KOHChem. Rev. 1955, 55, 137.5-k IOOOH O(3 eq.)JACS, 2001, 123, 3183.CH 3CHO2. DDQ / TFA.Synthesis, 1979, 537.JCS, 1932, 1875.Ph-F / DMSO 3.1. SeO 2a select oxidantindrect: change to RC-OH followed by oxidation direct:1. DMAPO / DBU / CH 3CN i. DMSO / AgBF 4RBr DMSO / AgBF 4- Me 2SBull Soc. Jpn., 1981, 54, 2221.THL, 1974, 917.2. NaIO 4 / DMFO Br84 %oNaIO 4 / DMF a new method 3. DMSO reagents:ii. DMSO / ZnSRCHBrMeRC(O)MeDMSO BrOH OOH JACS, 2003, 68, 2480.ROAgBFTHL, 1975, 4467.C C R CHOHRR C C HC C R R'R C C HR C C ArR C C HC C R PhR C C Hsteric base, prevent Nu attack n -BuLi: not MeLi, or t -BuLi, fire easily RX: R-Br, R-TOS, RCHO, RC(O)Rn -BuLi / R'CHO // Ac 2O // KO t BuClOMeN Liiii.ii. (Ph 3P)2PdCl 2, CuI, Et 2NH / PhIi. n-BuLi / RX6-b6-a b c d e g 6-aC CC CC Csulfonic acid: PhSO 3H; sulfinic acid: PhSO 2H; sulfenic acid: PhSOHiv. CuI, NaI, Na 2CO 3, RC C CH 2ClR C C HCl CH 2CC R'RCCCH 2CCR'Synthesis, 2000, 691.RCH 2-SO 2Ph RC CHh f iRCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXin fact: convert to C=C firstlyii. protect - deprotecti. move to terminal 6-cNH 2NHKuse: KAPAuse: Co (CO)8 // Fe(NO 3)3, EtOHJACS, 1975, 97, 891.6-duse: i. Br 2 / CCl 4 // KO t Bu6-euse: Pb(OAc)4, LiCl // KO t Bu // Br 2/CCl 4 // KO t Fe(NO 3)3: weak oxidizing agentii. Br 2 // KOHJA CS, 1941, 63, 1180.PhPhPhPh6-fi. NaBH 4, H 3O +, Br 2, KOtBuii. NH 2OH, NaNO 2 / H 2SO 4 // Ac 2O / DMAPiii. LDA, ClPO(OEt)2ON NODMAP:4-N,N-D i m ethyl a minop y ridinemixture ofAc 2O / DMAP:N NC CH 3O6-guse: TsNHNH 2 / EtOH, heatTHL, 1967, 3943.OHO3(l)O(MVK)CH 3CH CH 2Robinson Annulation German invention, as acylating agentLDA: Li N(iPr)2, ignored a long time, re-introduced by Michigan State U. became famous, appeared every weekHORLiNH 2 / NH 3 (l)use: LiNH 2 / NH 3 (l) / R-XO Cl6-h6-i.JA CS, 1958, 80, 4599.JA CS, 1955, 77, 3293.Me PhHOSO 2CF 3Me C C Phvia:MeCPhJOC, 1978, 43, 364.ArAr'HBr Ar C C Ar'NaOEtvia:Ar Ar'Bri. NaOEt (when X = Br)ii. BuLi (when X = -OSO 2CF 3)?heatRCH=CH 2:PBu RCH 2CH 2-O-PBu 3RCH 2CH 2-OHPh-Se-PBu 3Ph-Se-CNmechanism:MCPBA OAc CO 2MeOAcMeO MeO 2CNO 2SeNOAcCO 2MeOAc MeOMeO 2Cminorapplied for reactions: without rearrangement;no regiosiomerCC (CO 2H)2 / benzeneOH PhPhOO Cl ClClClOCl Cl NC NCO iii. Pd-C; or Ni; Pt, Rhii. chloronaili. DDQ use base: DBNi. CH 3I / Ag 2ii. HCHO / HCO 222use: heatuse: heatb 7-i. p-TSOH.H 2O or CSA ii. weak acid: HOAc; HCO 2H; H 2C 2O 4use:C C HIC C H NH 2C C H OC(S)SMe C C H OAc C C H OMs C C H OH a7-i h gCCX C C C CC CHC O C Cf e dc b a 7--C(O)-CH 3CH-CH CH-CX C-OHjCX-CYNaI / Zn (Cu)i. Zn / acetonei. CSCl 2/C COMs OMs C C BrBrCCOH OHc7-CCOH Iii. CSCl 2 / P(OMe)3P NNPhPOCl 3 / py // Snvia:C C IIapplication: i. protect alkene: via Br 2 // ZnCCCCC 36 o C CCCC=C 31 o C CCCC C Cl Cl148 o CS OR ORC C BrOAcZn / HOAcOAcO AcOAcOBrOAcZn OOAc OAcOAcJOC, 1978, 43, 364.HOAc, 1998, 2113.ii. In / MeOH ii. purify compoundd7-e7-i. WCl 6 / RLi ii. LiPPh 2 / CH 3I product retention product inversionNa R C HC HCH 2CH 2CH 2OH OClRiii. Na(special structure):7-d.7-d.S R 1R 2R 1R 2(EtO)3Puse: (EtO)3PSynthesis , 1977, 1134.via : betaine, oxaphosphetane (NMR)Onot good for Ph 3P=CH 2function as base:expensivedifficult to prepareOEtCNPPh 3CNPPh 3H OPPh 3O CO 2Me+notPh 3P CH EtH C OCO 2Me notPh 3P CH CO 2MeEtH O++++stable ylid gives trans (E)unstable ylid gives cis (Z)water soluble, removed by extraction(comparison: O=PPh 3 highly soluble in organic solvent)use:LiPh SON MeCH 2// Al (Hg)Me 3SiCHR -Li +Ph 3SiCH 2-Li + === Ph 3SiCH 2Br + n-BuLi (exchange)Me 3SiC -H-MgBr === Me 3SiCH 2Cl + Mg (metal reduction)Ph 3SiC -HCH 2Ph === Ph 3SiCH=CH 2 + PhLi (addition to vinylsilane)Me 3SiC -HCO 2Et === Me 3SiCH 2CO 2Et + Li (metalation)Me 3SiCH=PPh 3 === Me 3SiCH 2PPh 3+ X - + KHRO = MeO-, EtO-use: (RO)2PO-CHR'use: Ph 3P-CHR'vi. Sulfoximide (Johnson C.)iii. Silyl Wittig Reaction (Peterson Reaction)ii. Phosphonate Wittig Reaction (Horner-Emmons Modification)i. Wittig Reaction 7-f7-f.Synthesis, 1984, 384.THL, 1981, 2751.JOC, 1968, 33, 780.iv. CH 2(ZnI)2Chem. Lett, 1995, 259.Synlett, 1988, 12, 1369.2CH 2(ZnI)2v. CH 2CHBr 2, Sm, SnI 2 / CrCl 3, THFRO Rvii. Grignard reagent:1. TMSCH MgCluse: TMSCH 2MgClTHL, 1973, 3497.THL, 1988, 4339. 2. NaOAc, AcOHmethylenationOC RR'3H advantages over the Wittig:1. by-products are more easily removed,2. reaction suffers less from steric effects.via:(olefination reaction)1953 discover7-f.2not for Wittig, ylid unstableJOC, 1978, 43, 3253.JACS, 1974, 96, 4706.Chem. Lett, 1973, 1041.TiCl 3-LiAlH 4 / THF TiCl 3 / Mg TiCl 4 / Zn TiCl 4 / K ii. McMurry Couplingi. use: N 2H 4 / H 2S / Pb(OAc)4BASF, 1973, 2147.via:Zn-CuP(OEt)1. H 2S2. Pb(OAc)431. H 2S2. Pb(OAc)4OON SN N N OSN NSON ON NNSN NON NO OSO ON NOO OO OTiCl 3N 2H 4g7-form trans alkene:form cis alkene:i. Li / NH 3; or other IA metals ii. Li / EtNH 2iii. LiAlH 4 / THFi. H 2 / Ni 2B (P-2 catalyst)ii. H 2 / Pd-CaCO 3 (Lindlar catalyst)iii. H 2 / Pd-BaSO 4iv. B 2H 6 / HOAc (Diborane)v. N 2H 2vi. HCHO / Pd-C / Et 3Nnot use H 2 / Pt: might convert to alkaneh7-all form trans alkene:i. R 2BH / Br-CN (hydroboration)C CHR HHii. DIBAL / n-BuLi / CH 3I (hydroalumination)iii. Cp 2ZrClH / RX (hydrozirconation)application: protecting groupvia dihalidevia halohydrinvia epoxidevia diene-olefin additionC=C C CX XC CH XC=CC COC=CC=CC=C C=CC=CC CC Cnot for double bond might moveMnO2 / Ph3P CH3 Br- / MTBDNNNCH3MTBD via diradicalJA CS, 1998, 100, 877.Ph Ph7-i7-j8-a 8-a.28-a.38-a.41. HI 3. TsCl / C 62. PI 3JCS, 1905, 87, 1592.CH OH CH I PI 38-a.12. F 3S-NEt 21.(DAST)SN SF O OOO Chem. Rev., 1996, 96, 1737.2FCH 3SO O OH ONCHCl 2CH 3 1. CF 3CHFCF 2NEt 22. HOAc / i PrOH$ 65 / 500 g $ 80 / 50 gPBr 3PI 3$ 35 / 1000 g PBr 3$ 500 / 125 gJOC, 1993, 58, 3800.8-C-XC-OH C(O)Z d c b a C-NH 2C=O 2. PPh 3 / I 2e C-H8-d8-d.RC O OH1. AgNO 3/KOH 2R Br Ber. 1942, 75, 296.8-d.2ClOClRhCl(PPh 3)38-b NaNO 2 / HCl / HBF 4 /Chem Rev., 1956, 56, 219.8-c CF 2Br 2 / ZnFF JCS.PT I, 1993, 335.8-e8-e.1I86 %I 2 / HNO 3JACS, 1917, 39, 437.8-e.3I / HNO PhCH 2C(O)CH 3PhCHC(O)CH 3FN SFO OF +Chem. Rev., 1996, 96, 1737.F-TEDA-BF 4, 1994, 149.F 2-N 2 / CFCl 3-CHCl 3JOC, 1988, 53, 2803.90 %adamantane1. regioselective fluorination at the more substituted positions2. electrophilic in natureF -N 33OO N XR 1R 3OOR 2H Mg(ClO 4)2R 1R 3O OR 2X NBX / Mg(ClO 4)2JOC, 2002, 67, 7429.8-e.2X = Cl, Br, IX = Cl, Br, INBXNBX:i.ii.iii.iv.RRFR = CH 3CO, COCF 3, CCl 3, NO 2 HF / electrolysis1.4-1.6 Valready industrilized NF 3O / TBAH / CH 3CNv.TBHA: TetrabutylammoniumhydroxideTHL, 2003, 44, 2799.9-a9-C-CH 3C-X a (CH 3)3AlMe 3Al98 %Organomet. Chem. Rev., 1996, 4, 47.CH 2Cl 2bridgehead methylation。
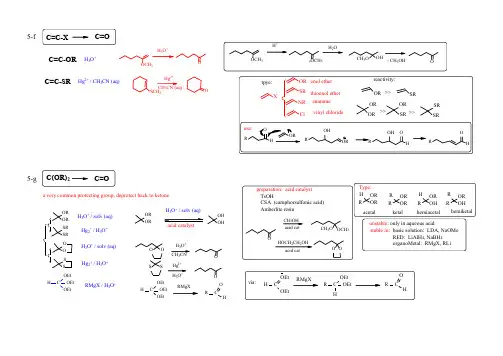
i 5-7-g f e d c b a e d c b a i h g f ed c ba h g f e d cb a h g f e dc b a 6-4-3-1-2-i h g f ed c b a C=C -C(O)-CH 3CH-CH CH-CX Functional Group InterconversionC=CC C C=CC C RCH 2-SO 2Ph RC CH CC C C C C CC C C=O C-C(O)Z C=C C=O C-OH C-X C-N C-H C-N C=O C---OH C-OC(O)R C-X C-OCH 2OR C-NH 2C-OR C-H C-OH C=C C-H C(O)OR C-(OR)2C-OH C-ORC-CHO C-CO 2H C-CN C=C C=O C-S C-X C-OH C-H C=C j C(O)XhC Nj kCC 8-C-Xi C-OHC-OH C(O)Z dc b a ed c b a f C-NH 2C-Hj CX-CYC CXC=O h g f iC CH RCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXjC O C-NH 2C-CN9-C-CH 3C-Xa e C=O1-atriflmesytosyS O O O RCH 2CF 3S OO O RCH 2CH 3CH 3CH 3CH 3OH (2). for 3' alcohol:LiAlH 4(1). for 1', 2' alcohol:1-i h g f e dc b a C-CHO C-CO 2HC-CN C=C C=O C-SC-NH 2C-X C-OH C-H CH 3CH3CH 3H n -Bu 3SnH C S O PhClRCH 2-HCH 3SOO O RCH 2CH 3S OOCl RCH 2OHjC(O)XPh 2SiHCl / InCl 3PhPhPhPhJOC, 2001, 66, 7741.ii. Ph 2SiHCl / InCl 3i. p -TsCl // LiAlH 4i. ClC(S)OPh // n -Bu 3SnH Cl 22via:a unique L accelerateInCl 3indium tri ii. Et 3SiH / Lewis acidJ. Org. Chem. 2000, 65, 6179JOC, 2000, 65, 6179.2rt, 3 hr1-bBu 3SnH: (l), easy to rem Ph 3SnH: (s), hard to rem Me 3SnH: too volatile, tounstable in acid, form H 2 gasNaBH 3CN: stable at pH 5-6hygroscopic, dried self, suggest: buy sma(Grignard reageH 2OMg / Et O JOC, 1969, 34, 3923.HBrNa / NH 3; Li / NH 3; Na / EtOH Zn; Fe; Sn; Mg(3). metal reduction(2). hydride reduction(1). free radical reductionJACS, 1972, 94, 8905.n -Bu 3SnH HBrNaBH 4 / InCl 3 / CH 3CNradical reagentn -Bu 3SnH / AlBN JA CS, 2002, 124, 906.i iii NaBH 3CNi LiAlH 4i ii ii NaBH 4ii THL, 1969, 3095.JOC, 1976, 41, 3064.iv LiBHEt 3 (super hydride)JCS Perkin Trans I, 1973,654.(3). L iAlH 4 / CuCl 2NaBH 4 / NiCl 2NaBHEt 3 / FeCl 2 (or CoCl 2, VCl 3)(2). Li / NH 3(1). Raney Ni BuLi1-d1-cRCH 2-HRCH 2NH 2radical mechanismChemistry:R-SH R-S-R R 2SO R 2SOR-SS-Rremove: Hg +; Ni(1).(2).Ar-H2H PO Ar-NH 2RCH 2NH 2RCH 2NMe 3R=CH 2R-CH 3(4).X-RCH 2NMe 3OH -p-TsClp-TsCl2(3).Ar-NH 2Ar-Hbasicneutral acidic1-e(2). thioketal:(3). Wolff-Kishner reduction:(5). Tosylhydrazone reduction (Shapiro reaction):(modified Wolff-Kishner reduction):)(6). enol derivatives: SHSH / BF 3, CH 2Cl 2 // RaNiN 2H 4, OH -, heatTsNHNH 2Tf 2O /N// H 2 / PtO 2preparation: HgCl 2 into Znsimilar: Sn / HCl(4). Pd-C / HCO 2NH 4: mild, efficient(7). Et 3SiH / CF 3COOHPhONO 21-fb.p. ~ 230 Chighly toxic, cancer suspected agent?= HMPT: h exa m ethyl p hosphoric t riamide (Me2N)3P=O(3). organic electrochemistryβ(1). particular structure:1-g(1). K / Al2O3K / HMPA(2). Na / NH31-h(2). normal structure: SOCl2JOC, 1980, 45, 3227HMPA: h exa m ethyl p hosphor a mide (Me2N)3P=Oyes for white mouse, uncertain for humanmodified to: N NO1-i(1). RhCl(PPh 3)3 (Wilkinson's cat)(2). Rh(DPPD)2+ Cl -DPPD = Ph 2P-CH 2CH 2-PPh 21-jHSiEt 3 / B(C 6F 5)3activator / hydride sourceRCH 2 OR OO RR OROR RCH 2 OCH 2CH2OH(3). AlCl 3 / LiAlH 4(2). HCl / NaBH 3(CN)(1). h / HSiCl 32-bN NH/ TBDMS-ClTBDPS-ClEt 3N / TMS-Clacid: H 2SO 4H 3PO 4BF 3-Et 2ORC-OCH 2CH=CH2RC-OCPh 3 = RC -OTr RC-O t BuRC-OCH 3RC-OSiR 3RC-OCH 2Ph = RC-OBZl = RC-OBni. Willianson s ii. stability of s iii. abbrev.: TBSilyl group:i. S N ii. abbreviation iii. advantage: Willianson st -Butyl group:i. abbreviati ii. deprotectiPhCH 2-ClPhCH 2-Br: reactivity goodPhCH 2-I: reactivity better than PhCH 2Br, generated in situ, PhCH 2Br + NaIPhCH 2-X: Benzyl- group:i. Williamson ii. not a goodMe group:CH 3-X: CH 3I; CH 3OSO 2R; (CH 3)3O + BF 4-, (CH 3)2SO 4base: NaH, n -BuLi, Ag 2O(4). t -Bu: acid cat /(3). allyl: base /Br (6). silyl: Et 3N / R 3SiCl(5). trityl: py // Ph 3C-Br(2). PhCH 2-: base / PhCH 2-X e d cb a 2-RC=C RC-H RC(O)ORRC-(OR)2RC-OH RC-OR (1). Me: base / CH 3-X2-a (7). acetal / ketal: (see 3e)fRC-CNgenerate H 2, or butane gasJOC, 1988, 53, 2985.trimethyloxonium tetrafluoroborateJCS, 1930, 2166.(8). ArF / CsFROHradical mechanism: SiCl 3t-BuORaNi with C=S2-c2-d (1). hv / HSiCl 3(2). HCl / tBu-OO-t Bu(4). BF 3 / NaBH 42-e2-e.vi. H 2O 2, t -BuOH, MnSO 4 // NaHCO 3, pH 8HO 2new, cheap,, simple, green chemistryOOHOOBr 2Br 2 / ROH2-f ROH / HClEtCNEt C OEt OEtOEtHClJA CS, 1942, 64, 1825.C-OH C-H C-OR C-NH 2C-X 3-a b c d3-a(1). [PhI(OAc)-O]2-Mn(TPP)(2). organic electrochemistry(3). X 2 / hv // OH -3-a.13-a.23-a.3(1) Me 3SiCl // MPCBA//H 3O +(2). O 2, LDA, (EtO)3PJA CS, 1975, 97, 6909.i h g f e C=O C---OH C-OC(O)RC-OCH 2OR C=Cj C O(1). Me: application: deprotecting (2). PhCH 2-(5). trityl:(6). silyl: (3). allyl: (4). t-Bu: RC-OCH 2Ph = RC-OBZl = RC-OBnRC-OSiR 3RC-OCH 3RC-OtBuRC-OCPh 3 = RC-OTr RC-OCH 2CH=CH2Ni. TMSIii. BF 3-Et 2O // R-SH (or HS-CH 2CH 2-SH)iii. BBr 3 / CH 2Cl 2, 0-10 Cvi.i. H 2 / Pd-C ii.CN CN Cl ClO, OH -O CH 2OCH 3RhCl(PPh 3)3, H 3O +Oi. TFA (CF 3CO 2H)ii. HBr / HOAc iii. TMS-Ii. HOAc: weak acid: good leaving groupii. H 2need stronger acidi. F - : HF, Py-H + F -; n +--SiMe 3-SiBuMe 2-SiBuPh 2if HOBr: OK for TMDMSJOC, 1987, 52, 4973.JOC, 1973, 38, 3224.iv. AlCl 3 / RSH THL, 2001, 42, 9207.v./ heatCl -N H3-b triphenylmethylorganic base: TMG3-c(1). OH -(2). KO 2 / DMSO 3-d not practically useful: R-OH cheaper than R-XJOC, 1975,40, 1678.(2). Na 2[Fe(CN)5(NO)] / K 2CO 3 / H 2O3-e(1). Symmetry:ketal: use H 3O +acetal: use H 3O +(2). unsymetry:RO-MOM RO-MEM RO-MTM RO-THPi. H 3O +p -TsOH / MeOHi. H 3O +; ii. ZnBr 2 / CH 2Cl 2HgCl 2 / CH 3CN (aq.)actually, acetal exchange (3). Ag 2O / H 2OTHL, 1975, 3183.JOC, 1986, 51, 3913RO 2C (CH 2)3CHRNH 2RO 2C (CH 2)3CHROHNa 2[Fe(CN)5(NO)]2323-f(1). base: KHCO 3 (or K 2CO 3, NH 3) / MeOH; NaOH (1 %, or 0.5 N)(3). RED: (2). acid: H 3O +PPh 3 / DEAD / RCO 2H // OH -3-gMitsunobu inversionSynthesis, 1981, 1.JOC, 1987, 52, 4235.common esters:formate = HCO 2R ------------------------ KHCO 3 (ortrifluoroacetate = CF 3CO 2R ------------ KHCO 3 (oracetate = CH 3CO 2R = ROAc --------- KHCO 3 (or Kbenzoate = PhCO 2R = ROBz -------- NaOH (1 %)pivalate = t Bu-CO 2R = ROPv ------ NaOH (0.5 N*HOi LiAlH 4ii. NaAlH 2(OCH 2CH 2OCH 3)CH 3O 2CCO 2CH 3HOOHNaAlH 2(OCH 2CH 2OCH 3)2C 6H 6, r.t.hydride:electron:Na / NH 3AGIEE, 2002, 41, 3028.JACS, 1972, 94, 7159.LAH ------------ almost all: ald, ketone, acie, ester, acyl X, anhydride NaBH 4 --------------- not for acid, ester (but LiBH 4 work for ester)B 2H 6 --------------- not for ester, acyl X, anhydride; from top:LiAlH 4; NaBH 4; Na / NH 3Al (O i Pr)3 / i PrOH ----------- Meerwein-Pondorf-Verley rxn IrCl 4 / i PrOH / P(OMe)3 ------ Henbest rxn LiBH(sec Bu)3 ------------------ H. C. Brownfrom bottom:(2). stereoselective:(1). regioselective:3-h (3). HCHO reagent:Me CHO MeOHHCHOKOHJACS, 1935, 511, 903.CH 3CHOC(CH 2OH)42Org.Syn, 1925, 4, 53.HCHO / KOHHCHO / Ca(OH)2Synthesis, 1994, 1007.PhNO 2OPhBH / SMe OBH 3 / THF solvent: THF, SMe 23-iR 3B, HOCH 2CH 2OH // H 2O 2 // NaOHJOC, 1986, 51, 4925.CORB RR 3BCRRCRR R 3CB OOH 2O 2R 3B O O OHOB R 3Cpractice3-k OOHOHOHOHOOHOH OHOHOHJOC, 1967, 32, 3452.H 2Hg ((3). B 2H 6, H 2O 2 / OH -, H 2O(2). Hg(OAc)2, H 2O // NaBH 4(1). H 3O +3-j3-j.13-j.2hydration:(1). KMnO 4 / NaOH (2). OsO 4(3). H 2O 2/HCO 2H (4). Na / EtOHcistran cis +trancis3Me 2NNN CH 3HClh νN CH 3HH +NCSN CH 3Cl NHCH21. LAH R 3C NH 2R C NR 2R C NHR R 3C OHR 2C OH RC OH R C NH 2tertiarysecondary primary Compare nomenclature class:not a very useful reactionC-N C-H C-N C-X C-OH C=OC=C 4-a b c d e f g 4-aSO 2NH 2Ph I OAcOAcS OON I Ph Fe (TPP)ClS OONH 2TPPN N2. NaN 3N C O1. SO 2Cl 2C O 2h i C N C (O)X C -C(O)XNH 22RC NO 2RC NH 2iii4-b CF 3CO 3H // Fe / HOAc1. many reducing agents4-b.14-b.21.2.3.4.Fe 3(CO)12 / CH 3OH JOC, 1972, 37, 930.NaBH 4 / Pd-C Na 2S Sn / HCl Vogel's 12.57Vogel's 12.58Vogel's 12.595.H 2 / Pt (S)-Csulfided platium not affect: aromatic rings, ketones, halides, nitrileJACS, 1933, 55, 4579.2HCHO NMe 2CO 2EtNH 2CO 2EtRC NCC NR C CRC NH 2iC N R NN+-C NRR'ii1. HCHO / HCO 2H 1. RBCl 2 / base1. HC(OEt)3 // NaBH 4;2. R 2CO // NaBH 3CN NH 2N CH 3CH 3HCHO N 3NHBCl 2NH 2COOHN COOHHCH 3NaBH 4b.3 2. HCHO // H 2 / Pd-CN 3NO 2MeO 2CNaBH 422rt NH 2NO 2MeO 2Cmild conditionhigh yieldnot affect:: NO2. NaBH 4 / CoCl 2-6H 2Onot good, usually2. Delepine3. NaN 3/ RED4-d4-c 5. Unpolung4. NaN 3 / RED3. Delepine2. Gabriel:1. NH 3N OO K N 2H 42Oi. LAH, NaBH 4ii. H 2 / catiii Zn / HCl; Al (Hg)i. Mg // NH 2Clii. Mg // PhSCH 2-N 3commercial available, tetramer of Me 3N24. CBr 4, PPh 3, NaN 3, DMF // PPh 3 / THFJOC, 2000, 65, 7110.urm heB 2H 6 / H 2NOSO 3HB 2H 6 / H 2NO CH 3CN / H 3O +B 2H 6 / NH 2Cl C-C-NHCOCH 3C=CC-C-NH 24-freductive amination!Leuckart reactionmost generalvia: hydrazone4. PhNHNH 2 // Al (Hg)2. Me 3SiN 3 // LiAlH 43. NH 3 (excess) // RaNi / H 21. RNH 2 // NaBH 3CN5. NH 4+HCO 2-4-e6. RNH 2 / n -Bu 2SnClH / HMPASynthesis, 2000, 789.5. P 4S 10// RaNi4. Et 3O + BF 4- // NaBH 43. B 2H 62. NaBH 3(OCOR)1. LiAlH 46. Lawesson's reagent // RaNi4-h4-g4-g.a 4-g.b R C NH 2R C NH 2R'formform AlH 3 / THF BrC NBr NH 2JOC, 2000AlH 3TH, 1989, 30, 5137.JOC, 1987, 52, 3901.R'Li // NaBH 4R'MgX // NaBH 4R'MgX // Li/NH 3(l)R'2CuLi // NaBH 4TH, 1989, 30, 5139.JOC, 1993, 58, 4313.R C N4-iNH 2ONHOCH 3O PhI(OAc)23JOC, 199RCO NH 2RCO NIPh OAcPhI, OARCPhI(OAc)4-i.2C NH 2RCH 2PhI(OAc)2 // KOH / CH 3OHC(OR)2C(SR)2hC-NH2C-NO2C NC C5-agfdcba5-C=C-ORC=C-SRC-OHC=N-OHC=N-HC=SC=OC=Ov. via: epoxysilaneR COCRR COCH2R42SOCl H3O+23OO2-HBr CrO4OOKOHNaBHCeCl3H3O+3ZnZnTsNHNH2MeLi TMSCl MCPBA LAH324CH2CORRCH2CORR3S SCH2CORRPhCHOi. via:α-CO2Hii. via: α-haloketoneiii. via: aldol processiv. via: thioenol etherR COCH2Rdrawback: require simple structure, use many powerful agents: MeLi, LAH, MCPBAeij C-Brk C-Hii. MCPBAi. hydrolysis5-b5-c C=N-OHC=N-Hi. RaNi ii. TiCl 3iii. KMnO 4 / Al 2O 3H 3O +5-dHg 2+ / H 2O JOC,JOC,HgSO 4 / H 2O / H 2O5-c.15-c.2THL, 2001, 42, 4775.1. DIBAL / H 3O +5-eStenphen reductionmostly for2. HCl./ SnCl 2 / Et 2O 5-e.1R -CH 2-C N5-e.25-e.3-CH 2-C OHR -CH -C OH R -CH -C O R"R'R'X / n -BuLiCH 3I R''MgBr H 3O +3.H 3O +5-fH 3O +Hg 2+ / CH3CN (aq)C=C-OR C=C-SROCH 3OH 3O+SCH 3OHg 2+3OH 3O Hg 2+3H 3O+O OO SSS SSR SR OO OR OR 5-gHg 2+ / H 3O +H 3O + / solv (aq)H 3O + / solv (aq)Hg 2+ / H 3O +OR OROH OHH 3O + / solv (aq)a very common protecting group, deprotect back to ketoneHC OEt OEt OEtRMgX / H 3O +HC OEt OEt OEtRMgXRCHON H+2Cr 2O 7-2N HCl.CrO 3Ag 2O:1. a mild oxidizing agent2. must be freshly prepared: NaOH into AgNO 3 (aq)3. may involve surface change, react with CO 2, lightSwern drawb Collins reagent: (CrO 3 - 2 Py)1. drawback: use 6 equivalent, a messy reaction 2. must be very dry, fire easily; purify by CaH 23. an old oxidizing material, isolated by Collin.i. PCCii. PDCix. K 2R C OHO aldehyde1st alcohol2nd alcohol1st alcoholR C OHOR C ROR C HO 5-h i. PCC ii. PDCN OCH 3OHPDC (pyridinium dichormate)(H 2Cr 2O 7 + 2 Py)PCC (pyridinium chlorochromate) (Py-HCl-CrO 3)most widely used use 1 - 1.2 eq.PfitzOO BrDMSOO OOH360 %Synth. Commun., 1986, 16, 1343.JOC, 1977, 42, 1991.O I OOAcAcOpH 6: weak acid buffer, aMcMurray reactioni. Corey approach: subtituted-quinone // H 3O +ii. Watt approacha. PhCHO // MCPBA // H 3O +b. ArPhO // MCPBA // H 3O +c. NBS // KOH // H 3O +5-iPhOPh PhOPhNH 2Ph PhNH 2NC O H // H 3O +OO5-i.15-i.2i. Et 3N // H 3O +Nef reactionii. TiCl 3 / pH 1 or 6iii. SiO 2 / NaOH // H 3O +JACS, 1977, 99, 3861.iv. LDA / MoO 5-Py -v. NaOH // CH 3O OH 3O +vi. KMnO 4 / KOHChem. Rev. 1955, 55, 137.5-j5-k IOOOH O(3 eq.)JACS, 2001, 123, 3183.CH 3CHO2. DDQ / TFA.Synthesis, 1979, 537.JCS, 1932, 1875.Ph-F / DMSO 3.1. SeO2a select oxidantindrect: change to RC-OH followed by oxidation direct:1. DMAPO / DBU / CH 3CN i. DMSO / AgBF 4RBrBull Soc. Jpn., 1981, 54, 2221.THL, 1974, 917.2. NaIO 4 / DMFO Br84 %oNaIO 4 / DMF a new method 3. DMSO reagents:ii. DMSO / ZnSRCHBrMeRC(O)MeDMSO BrOH OOH JACS, 2003, 68, 2480.AgBFTHL, 1975, 4467.C C R CHOHRR C C HC C R R'R C C HR C C ArR C C HC C RPhR C C Hsteric base, prevent Nu attackn -BuLi: not MeLi, or t -BuLi, fire easily RX: R-Br, R-TOS, RCHO, RC(O)Rn -BuLi / R'CHO // Ac 2O // KO t BuClOMeN Liiii.ii. (Ph 3P)2PdCl 2, CuI, Et 2NH / PhIi. n-BuLi / RX6-b6-a b c d e g 6-aC CC CC Csulfonic aciiv. CuI, NaI, Na 2CO 3, RC C CH 2ClR C C HCl CH 2CC R'RCCCH 2CRCH 2-SO 2Ph RC CHh f iRCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXin fact: convert to C=C firstlyii. protect - deprotecti. move to terminal 6-cNH 2NHKuse: KAPAuse: Co (CO)8 // Fe(NO 3)3, EtOHJACS, 1975, 97, 891.6-duse: i. Br 2 / CCl 4 // KO t Bu6-euse: Pb(OAc)4, LiCl // KO t Bu // Br 2/CCl 4 // KO t Fe(NO 3)3: weak oxidizing agentii. Br 2 // KOHJA CS, 1941, 63, 1180.PhPhPhPh6-fi. NaBH 4, H 3O +, Br 2, KOtBuii. NH 2OH, NaNO 2 / H 2SO 4 // Ac 2O / DMAPiii. LDA, ClPO(OEt)2OO6-guse: TsNHNH 2 / EtOH, heatTHL, 1967, 3943.OO(MVK)CH 3CH CH 2Robinson Annulation LDA: L bHORLiNH 2 / NH 3 (l)RXuse: LiNH 2 / NH 3 (l) / R-XO Cl6-h6-i.JA CS, 1958, 80, 4599.JA CS, 1955, 77, 3293.Me PhHOSO 2CF 3Me C C Phvia:Me CPhJOC, 1978, 43,ArAr'H Br Ar C C Ar'NaOEti. NaOEt (when X = Br)ii. BuLi (when X = -OSO 2CF 3)MCPBA OAc CO 2MeOAcMeO MeO 2CNO 2SeNOAcCO 2MeOAc MeOMeO 2C(CO 2H)2 / benzeneOH PhOO Cl ClClClOCl Cl NC NCO iii. Pd-C; or Ni; Pt, Rhii. chloronaili. DDQ use base: DBNi. CH 3I / Ag 2ii. HCHO / HCO 222use: heatuse: heatb 7-i. p-TSOH.H 2O or CSA ii. weak acid: HOAc; HCO 2H; H 2C 2O 4use:C C HIC C H NH 2C C H OC(S)SMe C C H OAc C C H OMs C C H OH a7-i h gCCX C C C CC CHC O C Cf e dc b a 7--C(O)-CH 3CH-CH CH-CX C-OHjCX-CYNaI / Zn (Cu)i. Zn / acetonei. CSCl 2/C COMs OMs C C BrBrCCOH OHc7-CCOH Iii. CSCl 2 / P(OMe)3P NNPhPOCl 3 / py // Snvia:C C IIapplication: i. protect alkene: via Br 2 // ZnCCCCC 36 o C CCCC=C 31 o C CCCC C Cl Cl148 o CC C BrOAcZn / HOAc, 1998, 2113.ii. In / MeOH ii. purify compoundd7-e7-i. WCl 6 / RLi ii. LiPPh 2 / CH 3I product retention product inversionNa R C HC HCH 2CH 2CH 2OH OClRiii. Na(special structure):7-d.7-d.S R 1R 2R 1R 2(EtO)3Puse: (EtO)3PSynthesis , 1977, 1134.via : betaine, oxaphosphetane (NMR)CNCO 2MeEtwater soluble, removed by extraction(comparison: O=PPh 3 highly soluble in organic solvent)use:LiPh SON MeCH 2// Al (Hg)Me 3SiCHR -Li +Ph 3SiCH 2-Li + === Ph 3SiCH 2Br + n-BuLi (exchange)Me 3SiC -H-MgBr === Me 3SiCH 2Ph 3SiC -HCH 2Ph === Ph 3SiCH=CH 2Me 3SiC -HCO 2Et === Me 3SiCH 2CO 2Et + Li (metalation)Me 3SiCH=PPh 3 === Me 3SiCH 2PPh 3+ X - + KHRO = MeO-, EtO-use: (RO)2PO-CHR'use: Ph 3P-CHR'vi. Sulfoximide (Johnson C.)iii. Silyl Wittig Reaction (Peterson Reaction)ii. Phosphonate Wittig Reaction (Horner-Emmons Modification)i. Wittig Reaction 7-f7-f.Synthesis, 1984, 384.THL, 1981, 2751.JOC, 1968, 33, 780.iv. CH 2(ZnI)2Chem. Lett, 1995, 259.Synlett, 1988, 12, 1369.2CH 2(ZnI)2v. CH 2CHBr 2, Sm, SnI 2 / CrCl 3, THFRO Rvii. Grignard reagent:1. TMSCH MgCluse: TMSCH 2MgClTHL, 1973, 3497.THL, 1988, 4339. 2. NaOAc, AcOHRR'H via:(olefination reaction)1953 discover7-f.2not for Wittig, ylid unstableJOC, 1978, 43, 3253.JACS, 1974, 96, 4706.Chem. Lett, 1973, 1041.TiCl 3-LiAlH 4 / THF TiCl 3 / Mg TiCl 4 / Zn TiCl 4 / K ii. McMurry Couplingi. use: N 2H 4 / H 2S / Pb(OAc)4BASF, 1973, 2147.31. H 2S2. Pb(OAc)4N NO OSO ON NOO OO ON 2H 4g7-form trans alkene:form cis alkene:i. Li / NH 3; or other IA metals ii. Li / EtNH 2iii. LiAlH 4 / THFi. H 2 / Ni 2B (P-2 catalyst)ii. H 2 / Pd-CaCO 3 (Lindlar catalyst)iii. H 2 / Pd-BaSO 4iv. B 2H 6 / HOAc (Diborane)v. N 2H 2vi. HCHO / Pd-C / Et 3Nnot use H 2 / Pt: might convert to alkaneh7-all form trans alkene:i. R 2BH / Br-CN (hydroboration)C CHR HHii. DIBAL / n-BuLi / CH 3I (hydroalumination)iii. Cp 2ZrClH / RX (hydrozirconation)application: protecting groupvia dihalidevia halohydrin via epoxidevia diene-olefin addition C=CC C X XC C H X C=C CC O C=C C=CC=CC=C C=C C CC C not fordouble bond might moveMnO 2 / Ph 3P CH 3 Br - / MTBDvia diradicalJA CS, 1998, 100, 877.PhPh7-i7-j8-a 8-a.28-a.38-a.41. HI 3. TsCl / C 62. PI 3JCS, 1905, 87, 1592.CH OH CH I PI 38-a.12. F 3S-NEt 21.(DAST)SN SF O OOO Chem. Rev., 1996, 96, 1737.CSO O OH ONCHCl 2CH 3 1. CF 3CHFCF 2NEt 2$ 500 / 125 gJOC, 1993, 58, 3800.8-C-XC-OH C(O)Z d c b a C-NH 2C=O 2. PPh 3 / I 2e C-H8-d8-d.RC O OH1. AgNO 3/KOH 2R Br Ber. 1942,8-d.2ClOClRhCl(PPh 3)38-b NaNO 2 / HCl / HBF 4 /Chem Rev., 1956, 56, 219.8-c CF 2Br 2 / ZnFF JCS.PT I, 1993, 335.8-e8-e.1I86 %I 2 / HNO 3JACS, 1917, 39, 437.8-e.3I / HNO PhCH 2C(O)CH 3PhCHC(O)CH 3FN SF OOF +Chem. Rev., 1996, 96, 1737.F-TEDA-BF 4, 1994, 149.F 2-N 2 / CFCl 3-CHCl 3JOC, 1988, 53, 2803.90 %adamantane1. regioselective2. electrophilic inF -N CFCl 3-CHCl 3OO N XR 1R 3OOR 2H Mg(ClO 4)2R 1R 3O OR 2X NBX / Mg(ClO 4)2JOC, 2002, 67, 7429.8-e.2X = Cl, Br, IX = Cl, Br, INBXNBX:i.ii.iii.iv.RRFR = CH 3CO, COCF 3, CCl 3, NO 2 HF / electrolysis1.4-1.6 V already industrilizedNF 3O / TBAH / CH 3CNv.TBHA: TetrabutylamTHL, 2003, 44, 279-a 9-C-CH 3C-X a (CH 3)3AlMe 3Al98 %Organomet. Chem.CH 2Cl 2bridgehead meth。
第2课时醛、酮的氧化还原反应案例探究Wollf-Kishner还原法是一种能把醛、酮还原成烃的方法,该法需要用成本很高的无水肼且需在高压封管内进行,反应时间长,产率不高。
1946年,我国有机化学家黄鸣龙在研究这个方法的过程中,对反应条件进行了改进,将反应的低沸点溶剂改为高沸点溶剂,提高了反应产率,缩短了反应时间,为世界各国广泛应用,并普遍称为黄鸣龙还原法。
CH3COCH2CH3 CH3CH2CH2CH3黄鸣龙对中国甾族激素的基础或应用研究作出过重大贡献,是中国甾族激素药物工业的奠基人。
思考: 1. 你了解醛、酮的结构吗?2. 醛、酮与H2加成属于还原反应吗?3. 你还知道醛、酮有哪些性质吗?自学导引1. 氧化反应醛具有 ________ 的还原性,一些弱氧化剂如 ________ 、 ________ 悬浊液能氧化醛生成相应的 ________ ,而酮比较稳定,只有很强的氧化剂才能将其氧化。
这是因为醛的氧化只是 ________ 的转变,而酮的氧化还包含了 ________ 的断裂。
含有醛基的物质,通常都能与 ________ 、________ 悬浊液反应,因此,这两种试剂常用于鉴别是否有醛基。
( 1 )银镜反应醛跟银氨溶液反应生成金属银的薄层,附着在洁净的试管内壁,形成光亮的银镜,所以称为 ________ 。
乙醛发生银镜反应的方程式为: CH3CHO + 2Ag ( NH3)2 OH −−→CH3COONH4+ 2Ag↓ + 3NH3 + H2O( 2 )与新制Cu ( OH )2悬浊液的反应CH3CHO + 2Cu ( OH )2 −−→CH3COOH + Cu2O + 2H2O(砖红色)( 3 )与氧气反应2CH3CHO + O2 _________2. 还原反应醛、酮的羰基都可以发生多种还原反应,产生为相应的 __________ 或 ________ 。
如:答案1. 较强 银氨溶液 Cu (OH )2 羧酸 官能团 碳碳键 银氨溶液 Cu (OH )2 ( 1 ) 银镜反应( 3 ) 2CH 3COOH2. 醇 烃 RCH 2OH疑难剖析一、氧化反应和还原反应1. 氧化反应乙醛不仅能被KMnO 4酸性溶液或溴水等强氧化剂氧化,也能被银氨溶液,新制Cu ( OH ) 2等弱氧化剂氧化。