化学第二章官能团与有机化学反应烃的衍生物..醛和酮课件鲁科版
- 格式:ppt
- 大小:3.21 MB
- 文档页数:48




醛酮的化学性质(2)
【设计思路】
本教学设计是依据鲁科版选修5 《有机化学基础》第二章第三节《醛和酮糖类》进行编排的,本节课为该节的第二课时,是一节新授理论课,本节内容是第1章有机化合物的结构与性质的延续,是前一课时醛、酮结构的运用,也是后续学习糖类和有机合成的基础;本节内容起着承前起后的作用,把醇和羧酸等烃的衍生物衔接起来;本节内容的主要特点是充分运用了“结构决定性质”的思想方法,用醛、酮的结构来预测它们的主要化学性质。
22CH
2CH 物是
2.人造象牙是一种高聚物分子,其结构可表示为2,它是由一种化合
A.能被KMnO4酸性溶液氧化
B.在一定条件下能与溴发生取代反应
C.被催化加氢的最后产物的分子式是
学生已有的基础知识:第1章第2节“有机化合物的结构与性质”、第2章第1节“有机化学反应类型”和前一课时醛、酮结构,学生在此基础上进行学习活动会比较顺利。
对利用结构推断性质来说,醛、酮是一个很好的实例。
具有培养学生由结构推断性质的重要功能,教学过程中应注意帮助学生有条理地分析结构,启发他们结合已有的性质和反应类型的知识打开思路,推测醛、酮可能发生的反应、所需的试剂、对应的产物。
对于有困难的学生,应结合使用表2-3-1。
教师要注意对学生写出的推测结果进行分析点评,及时给予鼓励,以培养学生学习兴趣。
羟醛缩合反应是学生学习的难点,可让学生将此反应与烯烃的自身加成反应做对比。
注意培养学生的学习方法是自主学习法和迁移学习法:在教师指导下,引导学生自由思考学习;用已学的知识和技能迁移新知识和技能的学习。

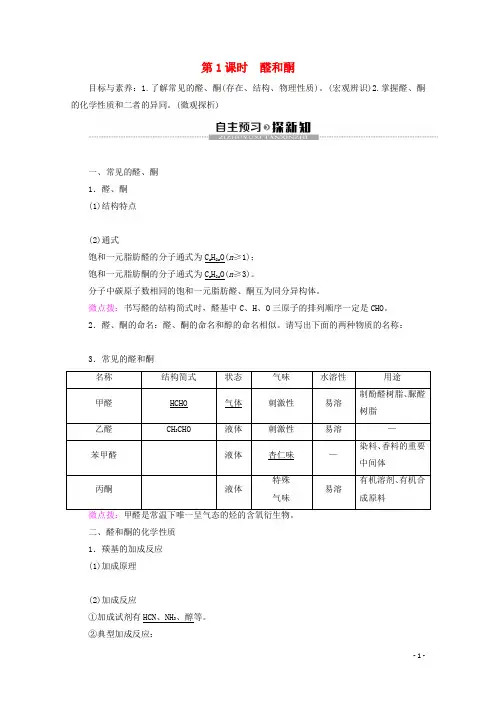
第1课时醛和酮目标与素养:1.了解常见的醛、酮(存在、结构、物理性质)。
(宏观辨识)2.掌握醛、酮的化学性质和二者的异同。
(微观探析)一、常见的醛、酮1.醛、酮(1)结构特点(2)通式饱和一元脂肪醛的分子通式为C n H2n O(n≥1);饱和一元脂肪酮的分子通式为C n H2n O(n≥3)。
分子中碳原子数相同的饱和一元脂肪醛、酮互为同分异构体。
微点拨:书写醛的结构简式时,醛基中C、H、O三原子的排列顺序一定是CHO。
2.醛、酮的命名:醛、酮的命名和醇的命名相似。
请写出下面的两种物质的名称:3.常见的醛和酮二、醛和酮的化学性质1.羰基的加成反应(1)加成原理(2)加成反应①加成试剂有HCN、NH3、醇等。
②典型加成反应:乙醛与HCN :2.氧化反应 (1)催化氧化乙醛催化氧化的方程式:2CH 3CHO +O 2――→催化剂2CH 3COOH 。
(2)被弱氧化剂氧化 ①银镜反应:CH 3CHO +2[Ag(NH 3)2]OH ――→△CH 3COONH 4+2Ag↓+3NH 3+H 2O 。
②与新制氢氧化铜悬浊液的反应:CH 3CHO +2Cu(OH)2――→△CH 3COOH +Cu 2O↓+2H 2O 。
微点拨:银镜反应口诀:银镜反应很简单,生成醋酸铵,还有一水二银三个氨。
3.还原反应(1)还原产物:加H 2之后得到,产物属于醇类。
(2)与氢气加成的通式1.判断正误(正确的打“√”,错误的打“×”) (1)含有羰基的化合物属于酮。
( )(2) 的名称为2甲基1丁醛。
( ) (3)醛、酮都可以发生还原反应。
( ) (4)醛和酮都可以发生银镜反应。
( ) (5)碳原子数相同的饱和一元醛和饱和一元酮完全燃烧,生成的二氧化碳和水的物质的量相等。
( )[提示] (1)× (2)× (3)√ (4)× (5)√ 2.下列说法正确的是( ) A .甲醛是甲基跟醛基相连而构成的醛 B .醛的官能团是—COH C .甲醛和丙酮互为同系物D .饱和一元脂肪醛的分子组成符合通式C n H 2n O(n ≥1)D [甲醛的结构式为,是氢原子与醛基相连而成的,醛的官能团为“—CHO”并非“—COH”,故A 、B 两项错误;甲醛和丙酮属于不同类别的物质,故甲醛与丙酮不是同系物,C 项错误;饱和一元脂肪醛的分子通式均为C n H 2n O(n ≥1),D 项正确。


第1节有机化学反应类型答案:不饱和键两端的原子烯烃炔烃苯及苯的同系物某些原子或原子团脱去小分子物质双键或叁键卤代醇氧原子氢原子氢原子氧原子烷烃烯烃NaOH水溶液NaOH的醇溶液1.加成反应(1)定义:有机化合物分子中的不饱和键两端的原子与其他原子或原子团结合,生成饱和的或比较饱和的有机化合物的反应。
例如:乙烯与溴的CCl4溶液反应:谈重点发生加成反应的结构特点加成反应要求有机物分子中必须含有不饱和键,如等。
(2)加成反应的规律双键或叁键两端带部分正电荷的原子与试剂中带部分负电荷的原子或原子团结合;双键或叁键两端带部分负电荷的原子与试剂中带部分正电荷的原子或原子团结合,生成反应产物。
①一般规律:②参与加成反应的某些试剂反应部位化学键的电荷分布:例如:乙醛分子中碳氧双键的碳原子上带有部分正电荷,氧原子上带有部分负电荷,因此与HCN的反应中,—CN加在带有部分正电荷的碳原子上,—H加在带有部分负电荷的氧原子上。
析规律化学键的电荷分布规律化学键的电荷分布与元素的电负性即元素原子吸引电子能力相关。
一般来说,在元素周期表右上方的元素电负性大。
常见的共价键的电荷分布:(3)加成反应的应用加成反应是有机化学中非常重要的一类反应,在有机合成中有着广泛应用。
如:工业上利用乙烯与水的加成反应制备乙醇:CH 2===CH 2+H 2O ――――――→催化剂加热、加压C 2H 5OH 【例1】 完成下列化学方程式:①②CH 3—CH===CH 2+H —OH ――→催化剂解析:根据加成反应的规律和加成试剂的电荷分布来书写化学方程式。
如:①中,带正电荷的H 原子应该加到丙烯中带负电荷的1号碳原子上,带负电荷的Cl 原子应该加到2号碳原子上。
答案:①②CH 3—CH===CH 2+H —OH ――→催化剂析规律 烯烃的加成规律(以丙烯为例)CH 33—CH 2===CH 21在上述丙烯与氯化氢、水的加成反应中,由于丙烯分子中甲基的推电子作用,使得2号碳上带部分正电荷,1号碳带部分负电荷。



鲁科版选修5:第二章官能团与有机化学反应烃的衍生物重难点知识小结本章复习学案编辑人:吕荣海2011.12一、学习目标:1、复习目标:(1)通过复习使烃的衍生物知识网络化、系统化;综合应用各类化合物的不同性质,进行区别、鉴定、分离或推导未知物的结构简式。
(2)通过归纳整理,进一步理解烃的衍生物重要化学性质和主要反应。
掌握有机反应的主要类型及衍生物之间的相互转化关系。
(3)提高学生解答有机物习题的能力,培养辨证、全面联系地认识事物的科学态度和科学方法。
2、复习重点、难点:重点:各类衍生物的主要化学性质及衍生物之间的相互转化关系。
难点:应用衍生物之间的相互转化关系解答综合性习题。
二、烃的衍生物的重要类别和主要化学性质(1)、[烃的衍生物的比较]类别官能团分子结构特点分类主要化学性质卤代烃卤原子(-X)碳-卤键(C-X)有极性,易断裂①氟烃、氯烃、溴烃;②一卤烃和多卤烃;③饱和卤烃、不炮和卤烃和芳香卤烃①取代反应(水解反应):R-X+H2O R-OH + HX②消去反应:R-CH2-CH2X + NaOHRCH=C H2 + NaX + H2O醇均为羟基(-OH) -OH在非苯环碳原子上①脂肪醇(包括饱和醇、不饱和醇);②脂环醇(如环己醇)③芳香醇(如苯甲醇),④一元醇与多元醇(如乙二醇、丙三醇)①取代反应:a.与Na等活泼金属反应;b.与HX反应,c.分子间脱水;d.酯化反应②氧化反应:2R-CH2OH + O22R-CHO+2H2O③消去反应,CH3CH2OHCH2=H2↑+ H2O酚-OH直接连在苯环碳原上.酚类中均含苯的结构一元酚、二元酚、三元酚等①易被空气氧化而变质;②具有弱酸性③取代反应④显色反应醛醛基(-CHO)分子中含有醛基的有机物①脂肪醛(饱和醛和不饱和醛);②芳香醛;③一元醛与多元醛①加成反应(与H2加成又叫做还原反应):R-CHO+H2R-CH2OH②氧化反应:a.银镜反应;b.红色沉淀反应:c.在一定条件下,被空气氧化羧酸羧基(-COOH) 分子中含有羧基的有机物①脂肪酸与芳香酸;②一元酸与多元酸;③饱和羧酸与不饱和羧酸;④低级脂肪酸与高级脂肪酸①具有酸的通性;②酯化反应羧酸酯酯基(R为烃基或H)原子,R′只能为烃基)①饱和一元酯:CnH2n+lCOOCmH2m+1②高级脂肪酸甘油酯③聚酯④环酯水解反应:RCOOR′+ H2ORCOOH + R'OHRCOOR′+ NaOHRCOONa + R'OH(2)、烃与烃的衍生物的主要反应简单机理和官能团性质转化关系:2、典型有机实验举例例1、①如何用化学方法区别乙醇、乙醛、乙酸?(Cu(OH)2溶液)②如何分离乙酸、乙醇、苯酚的混合物?(加入NaOH蒸馏,加入少量水并通入CO2后分液)解析:①、各取少量乙醇、乙醛、乙酸于试管中,分别滴入新制的Cu(OH)2溶液,沉淀溶解的是乙酸,将剩余的二只试管分别加热,有红色沉淀的是乙醛,无明显现象的是乙醇。
第二章《官能团与有机化学反应烃的衍生物》检测题一、单选题(共13题)1.丙烯酸(CH2 = CH-COOH)的性质可能有①加成反应②酯化反应③中和反应④氧化反应A.①③B.①③④C.①②③④D.①④2.甲醛不具有的用途是A.有机原料B.纺织产业C.催熟水果D.浸制标本3.下列实验现象与实验操作不匹配的是A.A B.B C.C D.D4.以下说法不正确的是A.甲烷的取代反应的条件是在光照条件下与卤素气态单质B.乙酸与乙醇在浓硫酸加热条件下发生的酯化反应,也属于取代反应C.乙烯与酸性高锰酸钾的反应是加成反应D.苯的取代反应条件是液溴加催化剂5.分子式为C10H20O2的酯在酸性条件下水解,所得酸A和醇B,且B经氧化可得A。
符合此条件的酯的同分异构体数目为A.4 B.8 C.16 D.326.下列有关物质的叙述正确的有:①蛋白质的二级结构与肽键的形成有关②核酸是由核苷酸单体形成的生物大分子,其单体水解可得到核苷和磷酸③的名称是1,3,4-三甲苯④中,所有碳原子不可能处于同一平面⑤根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 ⑥酸性:333CF COOH>CCl COOH>CH COOH⑦向硫酸铜溶液中加入氨水,先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色溶液,向该溶液中加入乙醇,析出深蓝色晶体()344Cu NH SO ⎡⎤⎣⎦⑧测定新制氯水的pH 时,先用玻璃棒蘸取液体滴在pH 试纸上,再与标准比色卡对照 ⑨同温同压下,等体积的CO 2与CO 的密度之比是11∶7 A .2个B .3个C .4个D .5个7.根据下列实验操作和现象所得到的结论正确..的是。
A .AB .BC .CD .D8.分子式为C 3H 8O 的醇与C 3H 6O 2的羧酸在浓H 2SO 4存在时共热生成的酯有 A .3种B .2种C .5种D .7种9.下列有关除杂质(括号中为杂质)的操作中,错误的是 A .乙烷(乙烯):通入足量溴水 B .乙烯(2SO ):通入足量NaOH 溶液 C .苯(苯酚):加溴水,振荡,过滤除去沉淀D .乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡;分液,弃水层 10.下列选项中所示物质间转化关系不能..实现的是 A .2H /Ni加热、加压−−−−→B .+4KMnO /H −−−−−−→C .−−−→2Cu/O 加热D .−−−−−−→一定条件11.下面四种变化中,有一种变化与其他三种变化反应类型不同的是( )A .CH 4+Cl 2−−−−−→光照CH 3Cl+HClB .CH 3CH 2OH 170→℃浓硫酸CH 2=CH 2↑+H 2OC .2CH 3CH 2OH 140→℃浓硫酸CH 3CH 2OCH 2CH 3+H 2OD .CH 3CH 2OH+HBr(浓) ∆−−→CH 3CH 2Br+H 2O12.柔红酮是一种医药中间体,其结构简式如图所示。
第2课时醛、酮的氧化还原反应案例探究Wollf-Kishner还原法是一种能把醛、酮还原成烃的方法,该法需要用成本很高的无水肼且需在高压封管内进行,反应时间长,产率不高。
1946年,我国有机化学家黄鸣龙在研究这个方法的过程中,对反应条件进行了改进,将反应的低沸点溶剂改为高沸点溶剂,提高了反应产率,缩短了反应时间,为世界各国广泛应用,并普遍称为黄鸣龙还原法。
CH3COCH2CH3 CH3CH2CH2CH3黄鸣龙对中国甾族激素的基础或应用研究作出过重大贡献,是中国甾族激素药物工业的奠基人。
思考: 1. 你了解醛、酮的结构吗?2. 醛、酮与H2加成属于还原反应吗?3. 你还知道醛、酮有哪些性质吗?自学导引1. 氧化反应醛具有 ________ 的还原性,一些弱氧化剂如 ________ 、 ________ 悬浊液能氧化醛生成相应的 ________ ,而酮比较稳定,只有很强的氧化剂才能将其氧化。
这是因为醛的氧化只是 ________ 的转变,而酮的氧化还包含了 ________ 的断裂。
含有醛基的物质,通常都能与 ________ 、________ 悬浊液反应,因此,这两种试剂常用于鉴别是否有醛基。
( 1 )银镜反应醛跟银氨溶液反应生成金属银的薄层,附着在洁净的试管内壁,形成光亮的银镜,所以称为 ________ 。
乙醛发生银镜反应的方程式为: CH3CHO + 2Ag ( NH3)2 OH −−→CH3COONH4+ 2Ag↓ + 3NH3 + H2O( 2 )与新制Cu ( OH )2悬浊液的反应CH3CHO + 2Cu ( OH )2 −−→CH3COOH + Cu2O + 2H2O(砖红色)( 3 )与氧气反应2CH3CHO + O2 _________2. 还原反应醛、酮的羰基都可以发生多种还原反应,产生为相应的 __________ 或 ________ 。
如:答案1. 较强 银氨溶液 Cu (OH )2 羧酸 官能团 碳碳键 银氨溶液 Cu (OH )2 ( 1 ) 银镜反应( 3 ) 2CH 3COOH2. 醇 烃 RCH 2OH疑难剖析一、氧化反应和还原反应1. 氧化反应乙醛不仅能被KMnO 4酸性溶液或溴水等强氧化剂氧化,也能被银氨溶液,新制Cu ( OH ) 2等弱氧化剂氧化。