理想气体基本热力过程要点
- 格式:doc
- 大小:296.50 KB
- 文档页数:12
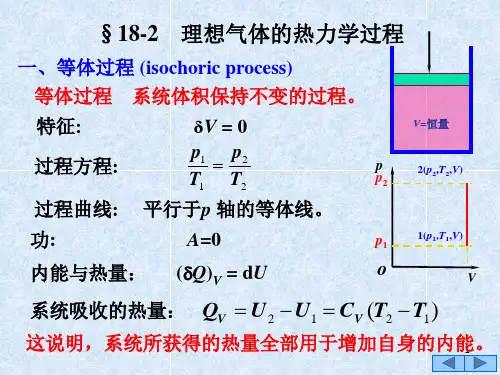



气体主要热力过程的基本公式1.等容过程(isochoric process)在等容过程中,气体体积保持不变。
根据理想气体状态方程PV=nRT,结合理想气体的内能U=C_vT(其中C_v表示摩尔定容热容量),可以得到气体的内能和温度的关系为U2-U1=C_v(T2-T1)2.等压过程(isobaric process)在等压过程中,气体的压强保持不变。
根据理想气体状态方程PV=nRT,结合理想气体的焓H=U+PV(其中H表示焓),可以得到气体的焓和温度的关系为H2-H1=C_p(T2-T1)其中C_p表示摩尔定压热容量。
3. 绝热过程(adiabatic process)在绝热过程中,气体在没有与外界交换热量的情况下发生压缩、膨胀等过程。
根据绝热条件PV^γ=常数,可以得到气体压强和体积的关系为P2V2^γ=P1V1^γ其中γ=C_p/C_v表示绝热指数。
4.等温过程(isothermal process)在等温过程中,气体的温度保持不变。
根据理想气体状态方程PV=nRT,可以得到气体的压强和体积的关系为P1V1=P2V2综合以上各种过程,可以得到气体的理想热力方程为C_p(T2 - T1) - R(ln(V2/V1)) = 0其中 R 表示气体常数,对于摩尔气体,R = 8.314 J/(mol·K)。
另外,对于理想气体的内能和焓,还可以利用摩尔定热容量和摩尔焓的定义进行计算:U=nC_vTH=nC_pT其中C_v和C_p分别为摩尔定容热容量和摩尔定压热容量,n表示气体的物质量。
需要注意的是,以上公式都是在理想气体的情况下推导得到的,在实际情况下可能需要考虑相对论效应、分子间相互作用等因素。
此外,还有其他一些非常特殊的热力过程,如绝热绝热过程、多孔气体的热力过程等,其公式推导及应用较为复杂,对于一般的热力学应用来说已经足够。




理想气体的典型热力过程
1. 等压过程:在恒定的压力下,气体的体积增加或减少,热量从气体传给环境或从环境传给气体。
这类过程也称作“伯努利过程”。
2. 等温过程:在恒定的温度下,气体随着压力的变化而膨胀或收缩,此时所吸收或释放的热量与温度成正比例。
这类过程也称作“卡诺过程”。
3. 等体过程:在恒定的体积下,气体的压强增加或减少,需要向气体注入或从气体中抽取热能。
这类过程也称作“热容过程”。
4. 绝热过程:在没有热量交换的情况下,气体的压强、温度和体积都同时变化。
这类过程也称作“奥托过程”。



理想气体的基本热力过程热力设备中,热能与机械能的相互转化,通常是通过气态工质的吸热、膨胀、放热、压缩等热力过程来实现的。
实际的热力过程都很复杂,而且几乎都是非平衡、非可逆的过程。
但若仔细观察会发现,某些常见过程非常近似一些简单的可逆过程。
常见的主要有四种简单可逆过程-基本热力过程,指系统某一状态参数保持不变的可逆过程。
包括定容过程、定压过程、定温过程和绝热过程。
我们以1kg理想气体的闭口系统为例来分析这几种基本热力过程,分析方法包括5点:(1)依据过程特点建立过程方程式;(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系,即P1、v1、T1和P2、v2、T2之间的关系;(3)绘制过程曲线;我们主要绘制两种坐标图P-v图和T-s图,因为P-v图上可以表示过程中做功量的多少,而T-s图上可以表示过程中吸收或放出热量的多少;(4)分析计算△u,△h,△s;(5)分析计算过程的热量q和功w。
一、定容过程定容过程即工质的容积在整个过程中维持不变,dv=0,通常是一定量的气体在刚性容器中进行定容加热或定容放热。
(1)依据过程特点建立过程方程式定容过程的特点是体积保持不变,所以建立过程方程式:v=常数;或dv=0或v1=v2(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系过程方程式:v1=v2理想气体状态方程:112212Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系:122211v v P T P T =⎧⎪⎨=⎪⎩ 即定容过程中工质的压力与温度成正比。
(3)绘制过程曲线;定容过程有两种情况:定容加热和定容放热。
(4)分析计算△u ,△h ,△s ;2211v v u u u c dT c T ∆=-==∆⎰ 2211p p h h h c dT c T ∆=-==∆⎰ 222111ln ln ln p v v v P P s c c c v P P ∆=+=或222111ln ln ln v v T v T s c R c T v T ∆=+= (5)分析计算过程的热量q 和功w 。
容积变化功:210w Pdv ==⎰ 根据q=△u+w 可得:v q u c T =∆=∆总结:定容过程中系统与外界无容积变化功,加给工质的热量全部用于增加工质的热力学能,而没有热能与机械能的转化。
二、定压过程定压过程即工质的压力在整个过程中维持不变,dP=0,工程上使用的加热器、冷却器、燃烧器、锅炉等设备都是在接近定压的情况下工作的。
(1)依据过程特点建立过程方程式定压过程的特点是压力保持不变,所以建立过程方程式:P=常数;或dP=0或P 1=P 2(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系过程方程式:P 1=P 2 理想气体状态方程:112212Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系:122211P P v T v T =⎧⎪⎨=⎪⎩ 即定压过程中工质的比容与温度成正比。
(3)绘制过程曲线;定压过程有两种情况:定压加热和定压放热。
T-s 图上曲线是对数曲线,从上图可知,定容过程与定压过程在T-s 图上都是对数曲线,但定压线的斜率小,更为平坦。
(4)分析计算△u ,△h ,△s ;2211v v u u u c dT c T ∆=-==∆⎰ 2211p p h h h c dT c T ∆=-==∆⎰ 222111ln ln ln p v p v P v s c c c v P v ∆=+=或222111ln ln ln p p T P T s c R c T P T ∆=-= (5)分析计算过程的热量q 和功w 。
容积变化功:22121211()w Pdv P v v Pv Pv RT RT R T ==-=-=-=∆⎰ 根据q=△u+w 可得:v p q u w c T R T c T =∆+=∆+∆=∆总结:工质在定压过程中吸入的热量等于焓的增加量,放出的热量等于焓的降低量。
三、定温过程定温过程即工质的温度在整个过程中维持不变,dT=0。
(1)依据过程特点建立过程方程式定温过程的特点是温度保持不变,所以建立过程方程式:T=常数;或dT=0或T 1=T 2(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系过程方程式:T 1=T 2 理想气体状态方程:112212Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系:122112T T P v P v =⎧⎪⎨=⎪⎩ 即定温过程中工质的压力与比容成反比。
(3)绘制过程曲线;定容过程有两种情况:定容加热和定容放热。
(4)分析计算△u ,△h ,△s ;22110v v u u u c dT c T ∆=-==∆=⎰ 22110p p h h h c dT c T ∆=-==∆=⎰ 222111ln ln ln p T P P s c R R T P P ∆=-=-或222111ln ln ln v T v v s c R R T v v ∆=+= (5)分析计算过程的热量q 和功w 。
容积变化功:22221111ln ln v RT w Pdv dv RT v RT v v ====⎰⎰ 根据q=△u+w 可得:21ln v q w RT v == 总结:定温过程中内能变化为零,吸热量全部用于对外做膨胀功。
四、绝热过程绝热过程是指与外界无热量交换的过程,即0q δ=或q=0;(1)依据过程特点建立过程方程式0q δ=或q=0 另外根据revq ds T δ=得到:ds=0即可逆的绝热过程是熵不变的过程,定熵过程。
现实中严格的绝热过程是不存在的,但当过程进行的无限快时,工质与外界来不及换热,这种过程可近似认为是绝热的。
绝热过程的过程方程式有另外一种表达方式:P k v =常数 其中k pv c c =,是比热容比,又叫绝热指数,当比热取定值比热时,k 是与状态无关的常数。
(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系过程方程式:1122k k Pv P v = 理想气体状态方程:112212Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系:22111211212211()()()kk k k P v P v T v T v T P T P --=== (3)绘制过程曲线;定容过程有两种情况:定容加热和定容放热。
(4)分析计算△u ,△h ,△s ;2211v v u u u c dT c T ∆=-==∆⎰ 2211p p h h h c dT c T ∆=-==∆⎰ 0s ∆=(5)分析计算过程的热量q 和功w 。
绝热过程q=0;根据q=△u+w 得:w=-△u=v c T -∆绝热(定熵)过程是内能与膨胀功之间的转换。
多变过程前面我们讨论的几种基本热力过程,定容、定压、定温和绝热,都会有一个参数保持不变,要么是体积,要么是压力、温度或熵。
但在实际热机中,有些过程,工质的状态参数都会有显著的变化,即PVT 没有一个是恒定不变的,而且工质与外界之间的换热量也不可以忽略不计,即s 也是变化的非绝热过程。
这时,我们就不能将实际过程简化为上述几种基本热力过程。
但通过实验发现,多数过程的P-v 关系曲线往往比较接近指数方程式,即 P n v =常数热力学中个,热力过程符合该式的变化过程称做多变过程。
其中,n 为多变指数,取值在(-∞,﹢∞)之间。
n 为定值。
实际的热力过程往往非常复杂,主要有两种情况:(1)整个过程并不完全符合P n v =常数,但整个过程中n 值变化不大,比如:前半段过程符合2P v =常数,中间段过程符合 2.1P v =常数,后半段过程符合2.2P v =常数,那么我们可以用一个不变的n 的平均值来代替实际中变化的n 。
(2)n 的变化较大时,则将热力过程分成几段,每一段作为一个n 不变的简单的多变过程。
我们对于多变过程的分析,同样有前面的5项内容。
(1)依据过程特点建立过程方程式多变过程的过程方程式为:P n v =常数这个方程式比较具有普遍性,将n 取不同的值,它可以代表前面我们讲的四种基本热力过程中的任意一种。
定压过程:n=0定容过程:n=±∞定温过程:n=1绝热过程:n=k(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系过程方程式:1122n n Pv P v =理想气体状态方程:112212Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系:22111211212211()()()nn n n P v P v T v T v T P T P --=== (3)绘制过程曲线;在P-v 图和T-s 图上,可逆的多变过程是一条任意的双曲线,过程线的相对位置取决于n 的值,我们先把前面讲的四种基本热力过程的过程曲线画在图上,然后再找n 值不同时的曲线。
P-v 图和T-s 图上都以定容线为分界线,多变指数n 按顺时针方向递增。
在热机和制冷、热泵循环中,最常遇到的过程是介于1<n<k 之间,即大多数的实际热力过程介于定温和绝热过程之间。
(4)分析计算△u ,△h ,△s ;2211v v u u u c dT c T ∆=-==∆⎰ 2211p p h h h c dT c T ∆=-==∆⎰ 222111ln ln ln p T P P s c R R T P P ∆=-=-或222111ln ln ln v T v v s c R R T v v ∆=+=或222111ln ln ln p v p v P v s c c c v P v ∆=+=(5)分析计算过程的热量q 和功w 。
n n q c T =∆其中n c 称为多变比热1n v n k c c n -=- 根据根据q=△u+w 得:w=q-△u= ()1v v n k c c T n --∆- 过程曲线比较重要的一个作用是判断过程中△u 、w 、q 的正负。
1、判断△u 的正负以定温线为界,在T-s 图上,任何同一起点的多变过程,若变化曲线位于定温线上方,则△u 为正,若变化过程曲线位于定温线下方,则△u 为负。
在P-v 图上,任何同一起点的多变过程,若变化曲线位于定温线右上方,则△u 为正,若变化曲线位于定温线左下方,则△u 为负。
2、判断w 的正负以定容线为界,在T-s 图上,任何同一起点的多变过程,若变化曲线位于定容线右下方,则w 为正,若变化过程曲线位于定容线左上方,则w 为负。
在P-v 图上,任何同一起点的多变过程,若变化曲线位于定容线右方,则w 为正,若变化曲线位于定温线左方,则w 为负。