年度内部质量审核计划表
- 格式:doc
- 大小:182.50 KB
- 文档页数:10
IATF16949质量监督体系内审计划表
目的
该内审计划表旨在规划和安排IATF质量监督体系的内部审计活动,以确保组织的质量管理体系符合IATF标准的要求。
内审计划表
内审计划流程
1. 确定内审计划的目标和范围;
2. 选择内审团队成员和负责人;
3. 根据内审计划表中的内容,制定详细的审核指导文件;
4. 安排内审的日期和时间,并通知相关部门和人员;
5. 进行内审活动,包括对文件的审查、现场观察和面谈;
6. 记录和整理内审的结果和发现;
7. 提出内审报告和改进建议;
8. 协助组织制定并执行改进措施;
9. 跟踪和验证改进措施的有效性。
注意事项
- 内审活动应该按照计划表的顺序进行,确保覆盖所有的章节
和要求;
- 内审团队成员应具备相应的知识和技能,并严格遵守内审程序;
- 内审报告应详细记录内审结果和改进建议,并及时提交给管
理层;
- 内审活动应保持客观、公正和独立,不受个人或部门的影响。
质量审核年度计划
编号:
一、审核的目的和范围
1、目的:
2、范围:
二、审核的依据和标准
编制人:审核人:批准人:(中心主任)日期:日期:日期:
内部质量审核实施计划共页第页编号:
编制:批准:
内部审核检查记录表
共页第页编号:
审核员:日期:年月日备注:此表仅适用于审核员自己记录使用
内部质量审核报告
共页第页编号:
不合格报告
共页第页编号:
不合格项目整改意见表
内部质量审核签到表年月日编号:
第页共页
内审员委派通知书
编号
__________________实验室/部门:
现委派____________________________________________________ ____________________________________等内审员到你室进行内部质量审核, 请协助。
内审组组长为______________。
审核时间为:_________________________
质量负责人(签字): 日期: 年月日
共页第页。

质量安全检查年度计划表1. 引言本文档旨在制定质量安全检查的年度计划表,以确保组织的质量和安全管理达到预期目标。
本计划表将包含计划的时间表、检查的范围、方法和责任人等关键信息,以提供一个全面的质量安全管理框架。
2. 计划时间表以下是质量安全检查的年度计划时间表:时间段检查内容责任人一月生产设备运行状况检查工程部经理二月原材料质量检查采购部经理三月产品生产过程检查质量控制经理四月产品包装质量检查仓储部经理五月客户服务满意度调查销售部经理六月生产安全检查安全主管七月设备维护保养检查工程部经理八月安全培训与教育人力资源部经理九月质量管理体系审核质量管理部经理十月产品标识与包装检查市场部经理十一月外部供应商评估采购部经理十二月年度质量安全总结与改进经营总监3. 检查范围和方法3.1 检查范围质量安全检查覆盖了公司内部各个部门和外部供应商,以确保整个供应链的质量和安全标准。
3.2 检查方法质量安全检查将采用以下方法进行:•文件审查:对相关质量和安全管理文件进行审核,以确保符合相关法规和标准要求。
•现场检查:对生产现场、仓储场所等进行实地检查,以发现潜在的质量和安全问题。
•数据分析:对质量和安全相关的数据进行分析,以评估和改进质量安全管理体系的有效性。
4. 责任与授权质量安全检查的责任和授权如下:•工程部经理负责生产设备运行状况检查和设备维护保养检查。
•采购部经理负责原材料质量检查和外部供应商评估。
•质量控制经理负责产品生产过程检查。
•仓储部经理负责产品包装质量检查。
•销售部经理负责客户服务满意度调查。
•安全主管负责生产安全检查。
•人力资源部经理负责安全培训与教育。
•质量管理部经理负责质量管理体系审核。
•市场部经理负责产品标识与包装检查。
•经营总监负责年度质量安全总结与改进。
5. 结论质量安全检查的年度计划表为组织提供了一个明确的时间表和责任分工,以确保质量和安全管理的有效运行。
通过定期的检查和评估,组织可以及时发现和纠正潜在的质量和安全问题,并持续改进质量安全管理体系,以提升组织的整体运营效率和客户满意度。

检验科2015年度内审工作计划表编制:质量主管:田光春2015-1-25检测中心2011年度第1次管理体系内审实施计划表编制/日期:岳XX/2010年1 2月22日批准/日期:王XX/2010.12.23内审不符合项记录表内审员签名日期:质量负责人日期纠正措施记录表使用说明:本通知单适用于监督、校核、验证、检查、审核和评审活动中对纠正和预防措施的要求,请在□中打。
管理体系内部检查表精选范本实验室内审检查表4管理要求c)与质量有关的管理体系的目的?d)实验室所有与检测和校准活动有关的人员熟悉与之相关的质量文件,并在工作中执行这些政策和程序?e)实验室管理层对遵守CNAL/AC01:2005 及持续改进管理体系注:参考ISO/IEC 17025:2005 标准4.2.2.注。
423最高管理者是否提供了建立和实施管理体系以及持续改进其有效性承诺的证据?最高管理者是否将满足客户要求和法定要求的重要性传达到组424织?4.2.5质量手册是否包括或注明了含技术程序在内的支持性程序,并概述质量体系中所用文件的架构?质量手册是否包括或注明含技术程序在内的支持性程序,并概述质量体4.2.6系中所用文件的架构?当策划和实施管理体系的变更时,最高管理者是否能确保维持管理体系4.2.7的完整性?4.3文件控制总则4.3.1实验室是否建立并维持有关程序,以控制构成其管理体系的所有(内部制订或来自外部的)文件?注:参考ISO/IEC 17025:2005 标准4.3.1.注1,注2。
5技术要求5.1总则5.1.1 决定实验室检测和/或校准的正确性和可靠性的因素有许多,这些因素包括人员( 5.2 )、设施和环境5.1.2上述因素对不同(类别)的检测和不同(类别)的校准之间的测量总不确定度的影响明显不同。
实验室在检测和校准方法和程序的制定、人员培训和考核、所用设备选择和校准时,应考虑到这些因素。
5.2人员评审结果评审说明5.2.1 实验室管理层是否确保操作专门设备、从事检测和/或校准、评价结果和签署检测报告和校准证书的人员能力?使用正在培训中的员工时,是否对其安排适当的监督?XXX实验室管理体系内审总结报告内审总结报告:1 •审核组成员的名单;2•审核日期;3 •审核区域;4.被检查的所有区域的详细情况;5 •机构运行中值得肯定的或好的方面;6. 确定的不符合项及其对应的相关文件条款;7. 改进建议;8. 商定的纠正措施及其完成时间,以及负责实施纠正措施的人员;9. 采取的纠正措施;10. 确定完成纠正措施的日期;11. 质量负责人确认完成纠正措施的签字。
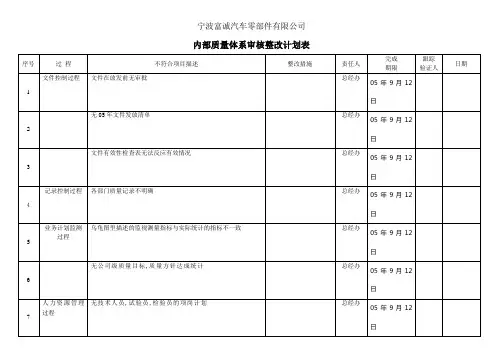


1、审核目的:
评价公司按照医疗器械生产质量管理规范标准建立的质量管理体系运行的符合性和有效性。
2、审核范围:
公司质量管理体系覆盖下的所有医用产品的生产、安装和服务的全部过程,以及相关职能部门。
3、审核准则:
1)《医疗器械生产质量管理规范》及其现场检查指导原则;
2)质量手册及程序文件;
3)适用的法律和法规;
4)产品的技术标准;
5)其他相关资料;
4、本次审核时间:年月日至年月日。
5、审核组成员:
1)组长:
2)组员:
3)审核分组:A组:
B组:
4)其他要求:
1)为AB两组各指派一名陪同人员,负责联络及审核见证;
2)按日程表各部门负责人及相关人员作好接受审核的准备;
3)各部门负责本部门不合格的纠正措施。
6、内审日程安排,见下表:
编制/日期: 审核/日期: 批准/日期:。

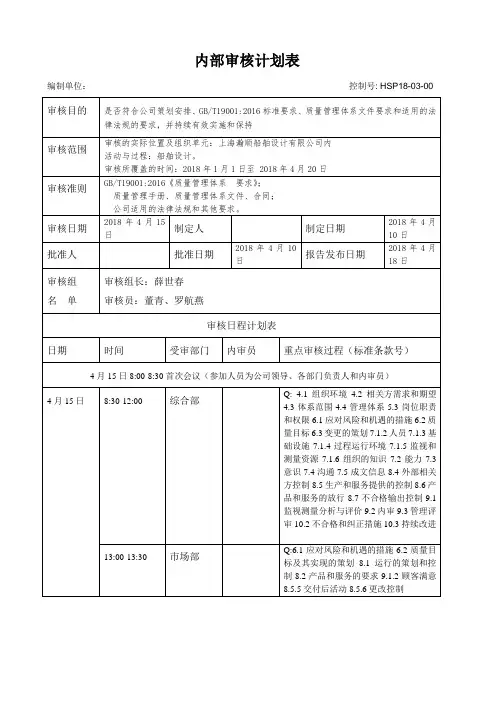
审核涉及质量管理体系标准要求主要审核内容8:30-9:00职能部门管理人员首次会议(内审员及各部门负责人参与)全体9:00-9:30总经理/管代 4.1、4.2、4.3、4.4、5.1、5.2、5.3、6.1、6.2、6.3、7.1.1、9.1、9.2、9.3、10.1、10.2、10.39:30-10:30行政部7.1.1、7.1.2、7.1.3、7.1.4、7.2、7.3、7.1.6、7.4、7.510:30-11:30物控部8.5.2、8.5.3、8.5.4、8.5.59:30-12:00技术部 6.1.2、8.1、8.39:30-10:30工艺部8.1、8.310:30-11:30生产部 6.1.2、7.1.3、7.1.4、8.1、8.5.1、8.5.2、8.5.6、8.713:30-14:30品质部 6.1.2、7.1.5、8.5.2、8.6、8.7、9.1.3、10.1、10.2、10.314:30-15:30外贸部、内贸部 6.1.2、8.2.1、8.2.2、8.2.3、8.2.4、9.1.213:30-14:30财务部 6.1、7.114:30-15:30采购部 6.1.2、8.415:30-16:00审核组内部沟通会议审核组成员16:30-17:00职能部门管理人员末次会议全体编制: 2019-12-12批准:受审部门内部审核实施计划表审核目的:按照ISO9001:2015质量体系要求建立现有的质量管理体系,经过贯彻实施标准,现对公司的质量管理体系做全面审核,通过审核了解和评价本公司的质量管理体系的有效性和符合性,以及是否具备申请第三方转版认证条件。
审核范围:■体系覆盖的产品范围适用于本公司生产各类产品;■体系覆盖的组织、职能范围:公司与质量有关的所有职能部门。
审核依据:GB/T 19001-2015 IDT ISO19001-2015版质量管理体系文件以及国家和地方有关的法律、法规和标准、公司管理制度、顾客与合同要求。
控制编号:GGGG-GG-GG质量体系内部审核报告编制:日期:20GG年GG月GG日批准:日期:20GG年GG月GG日GGGGGGGGGGG有限公司GGGG年度质量体系内部审核计划表编号:GGGG-GG第1页,共1页20GG年度内部审核工作计划编号:200G-G 第1页共2页一、审核目的为验证实验室管理体系的适应性和有效性,保证实验室的管理体系运行符合《实验室资质认定评审准则》的要求,进行本次内部审核工作。
二、受审核部门GG试验室、GG试验室、GG业务办公室三、审核范围涉及实验室资质认定评审准则的全部要素。
四、审核依据(一)实验室资质认定评审准则。
(二)实验室《质量手册》、《程序文件》。
五、审核组成员组长:GGG组员:GGGGGG六、工作时间安排(一)20GG 年GG 月GG 日8:30----9:00 首次会议(GGG室主任及相关人员)9:00----11:00GG 试验室(GGG、GGG)11:30---13:00 午休13:00---15:30GG 试验室(GGG、GGG)15:30---16:00 审核组内部会议20GG年度内部审核工作计划编号:200G-G 第2页共2页(二)20GG 年10 月19 日8:30----10:00GGG 办公室(GGG、GGG)10:00---10:30 审核组内部会议10:30---11:00 末次会议编制:批准:内部审核组二0GG年GG月GG日关于进行20GG年度内部审核的通知编号:200G-G 第1页共1页公司各部门:经公司质量负责人与各科室沟通后,决定于20GG年GG月GG日、GG月GG日依据实验室资质认定评审准则和公司《质量手册》、《程序文件》等要求进行20GG年度公司管理体系内部审核工作。
希望各部门接到通知后,认真做好迎接内部审核的准备工作,配合内部审核组进行审核工作。
具体工作安排见20GG年度内部审核工作计划。
内部审核组成员:组长:GGG组员:GGGGGGGGG办公室二0GG年GG月GG日质量体系内部审核签到表编号:第G页,共G页内审首末次会议签到表编号:20GG-G质量体系内部检查表审核组长GGG GGGG 年G月G日标记:P为合格,N为不合格,0为待验证.。