(优质医学)胸部放疗危及器官图谱
- 格式:ppt
- 大小:20.38 MB
- 文档页数:121



引言随着放疗技术的快速发展,调强放疗(Intensity Modulated Radiation Therapy,IMRT)在肿瘤治疗中的应用日益广泛。
IMRT不仅可以提高靶区剂量与均匀性,还可以降低周围正常组织受照剂量[1],减轻放疗不良反应,提高患者生存质量[2-3]。
有研究显示,食管癌在放疗过程中,靶区存在不同程度的缩小和移位[4]。
因此,为了避免靶区漏照,保护危及器官(Organs at Risk,OARs),通常需在食管癌患者放疗的中后期再次进行CT模拟定位并制定自适应放食管癌自适应放疗不同累加方法对危及器官受照剂量的差异比较许晓燕1,王沛沛1,李金凯1,昌志刚1,顾宵寰1,鞠孟阳2,葛小林1,孙新臣11. 江苏省人民医院(南京医科大学第一附属医院)放射治疗科,江苏南京 210000;2. 南京医科大学特种医学系,江苏南京 211100[摘 要] 目的 比较食管癌自适应放疗时,三种累加方法所得危及器官(Organs at Risk,OARs)受照剂量的差异。
方法 回顾性分析50例根治性食管癌自适应放疗计划,PTV:50 Gy/25 f,PGTV:60 Gy/30 f。
在治疗20~25 f期间重新CT模拟定位,根据肿瘤靶区退缩情况制定自适应放疗计划。
通过人工计算(A组)、治疗计划系统(B组)和MIM多模态形变配准系统(C组)三种方法分别计算双肺、心脏及脊髓的累加受照剂量。
结果 方差分析显示双肺V5差异有统计学意义(F=8.933,P<0.001),A组最小为(51.95±12.67)%;V20差异无统计学意义(P>0.05)。
心脏V40差异有统计学意义(F=3.590,P<0.05),A组最大为(17.69±12.48)%。
脊髓D max差异有统计学意义(F=5.587,P<0.001),A组最大为(43.98±2.23 )Gy。
结论 食管癌自适应放疗时,人工计算方法会低估双肺的低剂量受照体积,并会高估脊髓的最大受照剂量。





IJROBP在放射肿瘤学领域称为“红皮杂志”,是美国放射治疗及肿瘤学会(ASTRO)官方杂志,为国际肿瘤放疗领域权威的、影响力最大的杂志。
红皮杂志列出2011年下载次数排名前10位文章,来自哈佛医学院肿瘤放疗中心的Zietman教授,现任ASTRO主席和红皮杂志主编,对这些文章撰写了评论。
强烈推荐大家阅读这些文章,这些文章对中国从事肿瘤放疗的医生必将有所启迪和帮助。
文章列表:1、骨转移的姑息放疗:ASTRO循证指南(Lutz等,2011)Palliative radiotherapy for bone metastases: an ASTRO evidence-based guideline.2、共识指南:宫颈癌调强盆腔放疗的临床靶区描绘(Lim等,2011)Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy for the definitive treatment of cervix cancer.3、临床上使用的正常组织并发症概率模型(Marks等,2010)Use of normal tissue complication probability models in the clinic.4、胸部放疗脏器风险的剂量限值考虑:肺、近端支气管树、食管、脊髓、肋骨和臂丛神经的图谱(Kong等,2011)Consideration of dose limits for organs at risk of thoracic radiotherapy: atlas for lung, proximal bronchial tree, esophagus, spinal cord, ribs, and brachial plexus.5、临床正常组织效应量化分析(QUANTEC):对一些科学命题的简介(Bentzen等,2010)Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC): an introduction to the scientific issues.6、开发并验证一项描绘臂神经丛轮廓的标准方法:在接受调强放疗的头颈部肿瘤患者中进行辐射剂量的初步分析(Hall 等,2008)Development and validation of a standardized method for contouring the brachial plexus: preliminary dosimetric analysis among patients treated with IMRT for head-and-neck cancer.7、综述表皮生长因子受体生物学(Herbst等,2004)Review of epidermal growth factor receptor biology.8、预后不良的中高危前列腺癌患者的盆腔淋巴结放射治疗:证据、推理以及未来方向(Morikawa等,2011)Pelvic nodal radiotherapy in patients with unfavorable intermediate and high-risk prostate cancer: evidence, rationale, and future directions.9、子宫内膜癌和宫颈癌术后盆腔调强放疗临床靶区划定的共识指南(Small等,2008)Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy in postoperative treatment of endometrial and cervical cancer.10、放疗在恶性黑色素瘤治疗中的应用进展(Khan等,2011)The evolving role of radiation therapy in the management of malignant melanoma.文献解读:Top 1为ASTRO以循证为依据制定的关于骨转移姑息放疗临床推荐指南,另一姊妹篇脑转移的姑息放疗指南也已发表,可于ASTRO网站下载(https:///Clinical-Practice/Guidelines/Brain-meta stases.aspx)。


非小细胞肺癌立体定向放疗的两种体位固定方式比较目的探讨真空垫和热塑膜在肺癌立体定向放疗(SBRT)固定时的适用性。
方法随机收集浙江省肿瘤医院胸部放疗科22例接受SBRT的周围型非小细胞肺癌患者,其中12例采用真空垫体位固定技术,余10例采用热塑膜体位固定技术,每次治疗前拍摄CBCT(cone-beam CT,锥形束CT)影像与治疗计划进行配准,配准前人工校对得出患者左右、上下、前后方向摆位误差,比较两组误差的大小。
结果真空垫组三个方向上的摆位误差分别为(2.51±0.75)mm、(2.62±0.81)mm、(2.21±0.69)mm,热塑膜组三个方向上的摆位误差分别为(2.43±0.82)mm、(2.58±0.77)mm 、(2.35±0.86)mm,两组摆位误差值均相近(P>0.05)。
在前后(Z轴)方向上热塑膜组线性误差>3.5 mm的更多,差异有统计学意义(P<0.05)。
结论两种体位固定技术在肺癌SBRT中各有优劣,但均在可控范围内。
相对来说真空垫提高了患者舒适性,更加适合年纪大、身体情况差、强迫体位的患者。
标签:非小细胞肺癌;立体定向放疗;体位固定;锥形束CT随着科学技术的发展,体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)广泛应用于因为生理状况或医源性疾病而不能或者不愿意手术的非小细胞肺癌患者的治疗,并取得了良好的效果[1]。
SBRT提高了靶区剂量分布的适形性,而周围重要正常组织得到很好保护,意味着肿瘤与正常组织之间的剂量梯度增加[2]。
但是如果体位的重复性差而引起实际治疗的等中心点相对于计划的等中心偏移使得实际剂量分布和治疗计划不一致,从而导致肿瘤剂量不足而危及器官剂量过高[3],和常规放疗相比误差带来的危害更大。
因此保证每次SBRT时体位的一致性显得尤为重要。
Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC)
临床正常组织效应的定量分析
三维适形放疗常规分割
注:“心包体积”是指在心脏轮廓的“外皮”,人工绘制的心脏体积用作外边界,内边界使用自动勾画将外边界内缩1 cm,将连续轴位CT片上的心包轮廓线网格化为三维结构。
Conventional fractionated 3D-CRT
Note: The “pericardium volume” was defined as a “rind” within the previously contoured heart volumes. The manually contoured heart volumes served as the outer border, and the inner border was automatically contoured 1 cm within these same contours using the planning. The heart pericardium contours on successive axial CT slices were meshed into a 3D structure.
参考文献
Quantitative Analyses of Normal Tissue Effects in the Clinic): IJROBP, 76 (2), Suppl, Mar 1, 2010.
长按二维码关注公众号,免费使用【NCCN助手】查询特定病人的最新美国NCCN治疗方案,免费进入肿瘤功能社区使用临床常用工具及下载专业课件。
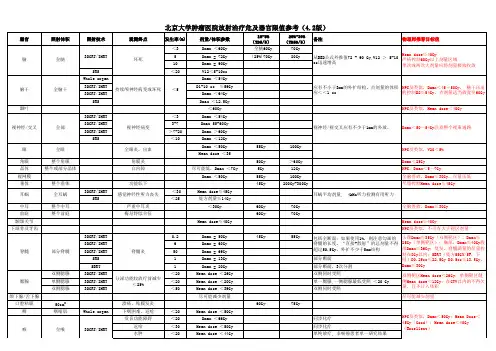
15种常见放疗危及器官限量参考标准随着影像技术的发展、精确放疗技术的开展,对于大多数的肿瘤,其局部、区域控率和总生存率都有了不同程度的提高,但需提醒,在目前的工作中,与肿瘤放疗相关的研究相比,正常组织保护方面的研究相对较少。
究其原因,一方面是因为对正常组织放射损伤进行评价需要更长时间的观察;另一方面是因为不同组织有着不同的放射生物学数据。
尽管在放射线效应的生物学基础研究领域,以及精确放射治疗技术方面已取得了令人瞩目的进展,然而在长期生存的患者中正常组织的放射损伤是我们不得不面对的现状。
本文通过整理《肿瘤放射治疗危及器官勾画》及《肿瘤放射治疗学》第四版相关放疗危及器官限量内容,编辑成文,方便大家查阅。
注重正常组织和重要器官的保护,也是注重患者治疗后的生活质量!1呼吸器官剂量限制肺肺癌单纯放疗:双肺V20≤30%,V5≤60%,MLD≤20~23Gy.肺癌同步放化疗:双肺V20≤28%,V5≤60%肺癌术后放疗:肺叶切除V20<20%,全肺切除V20<10%肺癌同步放化疗手术:双肺V20<20%,V10<40%,V15<30%食管癌单纯放疗双肺V20≤30%,V30≤20%,V,5≤60%食管癌同步化疗:V20≤28%间皮瘤V5<60%,V 20<4~10%,MLD<8GyQUANTEC汇总资料:全肺3DCRT照射时,V20≤30%时,肺炎发生率<20%,平均剂量7Gy时,肺炎发生率5%,13Gy时10%,20Gy时20%,24Gy时30%,27Gy时40%。
支气管树(主要是SBRT时)根据分割次数不同,最大限制剂量:1次:20.2Gy3次:30Gy(10Gy/f)4次:34.8Gy(8.7Gy/f)5次:32.5Gy(6.5Gy/f)2心包、心脏及大血管剂量限定全乳放疗(RTOG1005):左侧乳腺癌心脏受量≥20Gy的心脏体积≤全心体积的5%,心脏受量≥8Gy的心脏体积≤全心体积的35%,右侧乳腺癌心脏受量≥20Gy的心脏体积为0,心脏受量≥8Gy的心脏体积≤全心体积的15%,心脏平均剂量≤4Gy。
正常组织的放疗耐受剂量(一)常规标准治疗条件下人体正常组织耐受剂量常规放射治疗中正常组织的耐受量一般可参考表1。
表中TD5/5为最小耐受剂量,指在标准治疗条件下,治疗后5年内小于或等于5%的病例发生严重并发症的剂量。
TD50/5为最大耐受剂量,指在标准治疗条件下,治疗后5年,50%的病例发生严重并发症的剂量。
此处标准治疗条件是指从超高压治疗(1~6MeV),1000cGy/周,每天1次,治疗5次,休息2天。
整个治疗根据总剂量在2~8周内完成(表1)。
表1 放射耐受量(cGy)续表(二)局部照射的正常组织耐受量(供常规分次治疗参考)1. 照射1 000~2 000cGy 剂量范围:一些对放射线最敏感的组织受到影响。
生殖腺-卵巢、睾丸的生殖功能丧失。
发育中的乳腺、生长中的骨和软骨有严重的损伤,骨髓功能明显抑制。
大于2 000cGy生长中的骨与软骨完全停止生长,局部骨髓照射后不能再生,晶体浑浊并发生进行性白内障。
胎儿受1 000cGy照射将死亡。
2. 照射2 000~4 500cGy水平的中等剂量范围:整个消化系统、大部分或全部胃、小肠、结肠受此剂量范围的照射后基本不发生严重的并发症。
双侧肾、全肺照射2 500cGy以上即有一定比例发生放射性肾炎及放射性肺炎。
全肝照射4 000cGy以上,发生一定比例的放射性肝炎。
全心照射4 000cGy以上会有心肌受损的可能。
甲状腺、垂体在一定情况下也受到影响,产生功能低下。
生长中的肌肉可以萎缩。
淋巴结受此剂量水平的照射后可萎缩。
3. 照射5 000~7 000cGy剂量范围:皮肤、口腔粘膜、食管、直肠、唾液腺、胰腺、膀胱有1%~5%发生严重并发症。
成熟的骨和软骨、中枢神经系统、脊髓、眼、耳、和肾上腺等器官,如照射较高剂量(7 500cGy)将有20%~50%发生严重损伤。
4. 一般性临床高剂量照射:照射7 500cGy以上不发生严重并发症的有输卵管、子宫、成人乳腺、成人肌肉、血液、胆道、关节软骨及周围神经。
关于放疗副作⽤的真相,被蒙蔽了太久春节前在门诊,和⼀个患者讲了讲下⼀步要开始放疗,过程中可能出现副作⽤,谁知道,还没说⼏句话,该患者就沮丧的跟我讲:陈教授,⽹上写的放疗副作⽤太⼤,有的治完连命都没了,我看我还是不要做了吧。
有这样的恐惧⼼理的患者估计不占少数,今天我们就聊聊放疗的副作⽤。
⼀、放疗副作⽤太⼤,⾮死即伤?⾸先,我们必须指出,所有的关于对放疗副作⽤的夸⼤和不实描述,全部来⾃于⼀些⼼存误解、过于焦虑的患者和家属,甚⾄还有⼀些⾮本专业的同⾏,他们⼀叶障⽬,管中窥豹,⽚⾯的将道听途说、街边听闻甚⾄误听猜想,⼝⼝相传,导致了很多不明真相的患者朋友产⽣不必要的恐慌和误解。
肿瘤专家指出:现代,所有癌症的治疗都会有副作⽤,这些副作⽤都各有特点,也正是因为治疗本⾝性质的不同,⽽决定了副作⽤的各有千秋,甚⾄不具有可⽐性。
应⽤到具有差异性的不同个体上,就更加难说哪种治疗的副作⽤⼩,哪种副作⽤⼤。
放疗,其毒副作⽤主要来⾃局部的电离辐射引起,⼈们传统观念中的副反应⼤的放疗指的是精度不⾼的常规放疗。
常规放疗由于影像诊断和定位系统都只停留在⼆维平⾯上,医⽣看不到肿瘤后⾯的情况,就只能靠感觉和经验去掌握,如同盲⼈摸象,在这种⼤⾯积的照射下,肿瘤周围的正常细胞就像被挟持的⼈质⼀样被射线消灭,导致“杀敌⼀千,⾃损⼋百”,即副作⽤⾮常明显,对患者造成很⼤伤害。
常规放疗历经⼏⼗年,造成⼈们对常规放疗⼼有余悸,对并发症的恐惧远多于对治疗效果的认可。
但是,放疗技术历经100多年的发展。
如今,已经从不分敌我的常规放疗“⽕炮时代”发展成为今⾮昔⽐,不再“滥杀⽆辜”的精、准、狠的现代放疗“导弹时代”。
放疗技术从上世纪初的深部X线到50年代的⼆维传统照射技术、90年代的三维适型照射技术,发展到⽬前的调强放射治疗技术、图像引导放射治疗技术以及最新的螺旋断层放射治疗技术,发⽣了翻天覆地的变化。
现代放疗在CT、核磁、PET/CT的模拟定位下,在4D和分⼦层⾯上深⼊分析肿瘤,有的放⽮地⽤IMRT、TOMO⼑、伽马⼑等放疗设备,按肿块的⽴体形态直接射杀,不再累及正常组织。
胸部肿瘤放疗患者发生2级以上放射性肺炎的影响因素摘要:目的:探讨不同因素对胸部肿瘤放射性肺炎严重程度的影响。
方法回顾性研究数据来自于2021年1月-2022年1月因胸部肿瘤放疗,发生放射性肺炎入住我院的116例胸部肿瘤患者,收集患者的临床资料。
使用SPSS24.0软件进行数据处理和统计分析,多因素Logistic回归分析用于评估相关因素对放射性肺炎严重程度的影响。
结果入组的116例患者中,男性89(76.7%)人,女性27(23.3%)人;平均年龄62.73±9.99岁(范围:39~83)。
单因素分析结果显示:性别(P=0.009)、吸烟指数(P<0.001)和有无饮酒史(P=0.003)与放射性肺炎严重程度显著相关。
多因素分析后,显示仅有吸烟指数与放射性肺炎严重程度相关。
结论在胸部肿瘤放射治疗中肺病史、双肺V20是2级以上RP发生的独立危险因素。
关键词:胸部肿瘤;放疗;放射性肺炎引言放射治疗在胸部肿瘤如食管癌、胸部肿瘤等治疗中占重要地位。
肺是胸部肿瘤治疗的重要限制器官。
放射性肺炎(RP)的发生降低了患者生活质量,甚至危及患者生命。
近几十年放疗技术虽然取得进步,肺可以在胸部肿瘤放疗中得到更好的保护,如何降低RP是胸部肿瘤放射治疗中的困难。
RP发生后,只能对症处理,缺乏有效治疗措施,因此应在放疗前掌握RP发生的相关因素,尽量避免RP的发生。
本研究通过分析胸部放射治疗患者的资料、放射治疗计划系统导出的计划参数和回访结果,分析2级以上RP发生的相关影响因素。
1资料与方法1.1一般资料回顾分析2021年1月-2022年1月我院收治的发生放射性肺炎的胸部肿瘤患者的临床资料。
入组标准:1)年龄18岁以上;2)病理证实为胸部肿瘤;3)既往接受过胸部放疗;4)根据RTOG标准,临床诊断为2级及以上的放射性肺炎。
排除标准:1)存在不能与放射性肺炎相鉴别的其他肺部病变的患者;2)合并其他脏器严重器官功能不全者。