【高中化学】价键理论分子轨道理论的区别
- 格式:docx
- 大小:38.45 KB
- 文档页数:3

价键理论自1916年路易斯提出经典的共价键理论以来,共价键理论有了很大的发展。
现代共价键理论有两种,一是价键理论,二是分子轨道理论。
(一)价键理论的基本要点价键理论,又称电子配对法,其基本要点如下:1.具有自旋相反的未成对电子的两个原子相互接近,可以形成稳定的共价键。
如果A、B两个原子各有一个自旋相反的未成对的电子,那么这两个未成对电子可以相互配对形成稳定的共价键,这对电子为A、B两原子所共有(共用)。
如果A、B各有两个或三个未成对的电子,则自旋相反的单电子可两两配对形成双键或叁键。
如果A原子有两个未成对电子,B原子有一个未成对电子,那么一个A原子能与两个B原子结合形成AB2型分子,…。
2.原子中未成对的电子数等于原子所能形成的共价键数目(共价键的饱和性)。
共价键是由成键原子中自旋相反的未成对电子配对形成的。
一个原子的一个电子和另一个原子的一个电子配对以后,不能再和第二个电子配对。
因为这时其中必有两个电子的自旋方向相同而相斥。
也就是说一个原子所能形成共价键的数目是一定的。
原子中未成对的电子数等于原子所能形成的共价键数目,这就是共键价的饱和性。
例如,H原子只有一个未成对电子,它和另一个H原子的未成对电子配对后,就不能再与第二个H原子的电子配对了,……。
3.成键电子的电子云重叠越多,核间电子子云密度就越大,形成的共价键就越牢固(共价健的方向性)。
共价键的生成是由于自旋相反的单电子相互配对,电子云重叠的结果。
因此,当两个原子形成分子时,电子云重叠的程度越大,则两原子间的电子云密度越大,生成的共价键就越牢固,所以,在形成共价键时,电子云总是尽可能达到最大程度的重叠。
因此,在形成共价键时,原子间总是尽可能沿着电子云最大重叠方向成键。
s电子云呈球形对称分布,p、d、f电子云在空间都有一定的伸展方向。
在形成共价键时,除了s 电子云和s电子云可以在任何方向上都能达到最大程度的重叠外,p、d电子云的重叠,只有在一定方向上才能使电子云有最大程度的重叠。


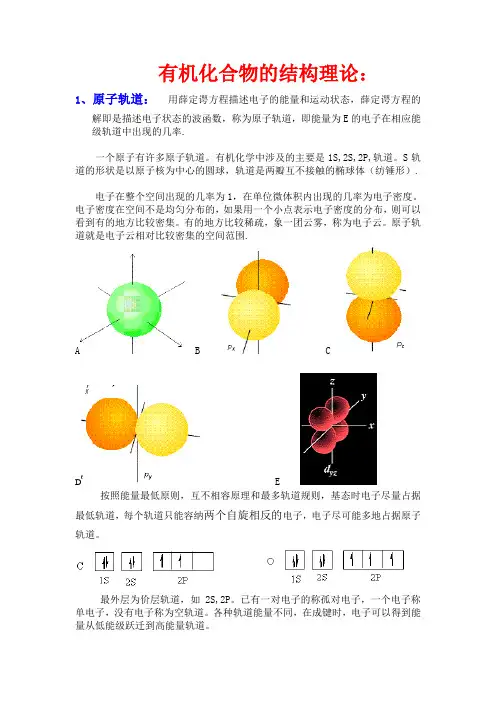
有机化合物的结构理论:1、原子轨道:用薛定谔方程描述电子的能量和运动状态,薛定谔方程的解即是描述电子状态的波函数,称为原子轨道,即能量为E的电子在相应能级轨道中出现的几率.一个原子有许多原子轨道。
有机化学中涉及的主要是1S,2S,2P,轨道。
S轨道的形状是以原子核为中心的圆球,轨道是两瓣互不接触的椭球体(纺锤形).电子在整个空间出现的几率为1,在单位微体积内出现的几率为电子密度。
电子密度在空间不是均匀分布的,如果用一个小点表示电子密度的分布,则可以看到有的地方比较密集。
有的地方比较稀疏,象一团云雾,称为电子云。
原子轨道就是电子云相对比较密集的空间范围.A B CD E按照能量最低原则,互不相容原理和最多轨道规则,基态时电子尽量占据最低轨道,每个轨道只能容纳两个自旋相反的电子,电子尽可能多地占据原子轨道。
最外层为价层轨道,如2S,2P。
已有一对电子的称孤对电子,一个电子称单电子,没有电子称为空轨道。
各种轨道能量不同,在成键时,电子可以得到能量从低能级跃迁到高能量轨道。
1S22S22P2 ——→1S22S12P32、价键理论:价键理论认为,两个原子各有成单电子且自旋方向相反,则这两个单电子可以通过原子轨道重叠而配成一对形成共价键。
轨道重叠后,电子密度更多地集中在量重叠范围内,即两个原子核间,同时吸引着两个原子核,并且屏蔽两原子核间的斥力,于是两个原子结合在一起形成共价键。
轨道重叠或电子配对后,体系能量降低,所以是一种稳定的结合。
一个原子的单电子与另一个原子的单电子配对后,就不能与第三个电子配对,所以原子的成单电子个数就等于它所能形成的共价键数,即共价键的饱和性.形成共价键时轨道要实现最大重叠,原子轨道在看空间伸展的方向不同,电子云密度不同,要实现最大重叠,只有在原子轨道的一定方向上即电子云密度最大的地方重叠,所以共价键具有方向性.若一个原子的价层轨道有孤对电子,而另一个原子或离子有空的轨道,两个原子也可以成键而共用电子对,称为配位键。




高二化学选修3知识点总结一、化学键1. 价键理论价键理论是我国著名化学家郭沫若和沈鄂生在20世纪30年代提出的,它是用电子互相共用、以提高稳定和降低能量的思想来解释化学键的形成。
根据价键理论,原子围绕原子核分布的电子称为价电子,原子核外的电子称为价电子,价电子可以用来组成化学键。
2. 共价键当两个原子通过共用价电子形成化学键时,这种化学键就是共价键。
共价键的形成依赖原子价电子的相互作用,一般来说,当原子的电负性相近时,它们能形成共价键。
3. 极性共价键当两个原子之间形成共价键时,如果两个原子的电负性不同,就会产生极性共价键。
这种化学键的产生源于电子云的不均匀分布,也会导致分子的极性。
4. 共价键的性质共价键有很强的方向性,特别是σ键。
共价键的长短和键能与原子间相互作用力有关。
5. 异性共价键异性共价键是指两个原子之间形成的共价键中,原子的电负性差异较大,导致共价键中有一个原子带正电荷,另一个带负电荷。
此时,共价键中两原子之间的极性是不均匀的。
6. 金属键金属键是金属之间的键。
在金属晶格中,正电荷离子和自由电子共同构成了金属键。
7. 离子键当电负性差异很大的两个原子之间形成的化学键,称为离子键。
在离子结晶中,正负离子按一定规则紧密排列而形成固体。
二、分子形状1. 分子的构象分子的构象是指分子的空间排布。
分子可以具有不同的构象,这些构象可能对于分子的性质和反应具有重要的影响。
2. 分子的对称性分子的对称性包括轴对称和平面对称。
分子的对称性与其构象有关。
3. 分子的形状决定因素分子的形状受到影响的因素包括:原子的排布、化学键角、共价键的性质等。
4. 分子的立体分子模型通过立体分子模型可以更直观地了解分子的形状。
例如,水分子的立体结构是呈V形。
5. 分子形状对化学性质的影响分子的形状对其化学性质和反应有着重要的影响。
比如,形状特定的分子可能对于特定的化学反应更有利。
三、化学键的性质1. 化学键的强度化学键的强度是指在两个原子之间形成的化学键的稳定性。

【高中化学】价键理论、分子轨道理论的区别分子轨道理论认为原子在相互结合形成共价键时,由原子轨道组成分子轨道,分子轨道属于整个分子。
而价键理论比较简单和粗糙。
分子轨道理论是现代共价键理论的一个分支。
其与现代共价键理论的重要区别在于,分子轨道理论认为原子轨道组合成分子轨道,电子在分子轨道中填充、运动。
而现代共价键理论则讨论原子轨道,认为电子在原子轨道中运动。
高中化学分子轨道理论分子轨道理论偏难,建议高中学生仅作了解。
我们把原子通过共用电子对结合的化学键成为共价键(covalent bond)。
路易斯(G.N.Lewis)曾经提出原子共用电子对成键的概念,也就是俗称的“八隅律”(高中阶段也只是停留于此)然而,我们知道很多现实情况都无法用八隅率解释,包括:PCl5,SCl6分子。
更重要的是,八隅率从来没有本质上说明共价键的成因:为什么带负电荷的两个分子不会排斥反而是互相配对?随着近代的量子力学(quantum mechanics)的建立,近代形成了两种现代共价键理论,即是:现代价键理(valence bond theory)简称VB(又叫作电子配对法)以及分子轨道理论(molecular orbital theory)简称MO。
价键理论强调了电子对键和成键电子的离域,有了明确的键的概念。
也成功的给出了一些键的性质以及分子结构的直观图像。
但是在解释 H2+氢分子离子的单电子键的存在以及养分子等有顺磁性或者大∏键的某些分子结构时感到困难。
而分子轨道理论可以完美的进行解释,这里我就主要阐述MO法的相关理论。
洪特(Hund)和密里肯(R.S Mulliken)等人提出了新的化学键理论,即是分子轨道理论。
这是人们利用量子力学处理氢分子离子而发展起来的。
(一)氢分子离子的成键理论氢分子离子(H2+)是由两个核以及一个电子组成的最简单分子,虽然不稳定,但是确实存在。
如何从理论上说明氢分子离子的形成呢?分子轨道理论把氢分子离子作为一个整体处理,认为电子是在两个氢核a和b组成的势场当中运动。

第2章质对市爱慕阳光实验学校分子结构[教学要求]1.掌握离子键和共价键的根本特征和它们的区别。
2.掌握价键理论,杂化轨道理论。
3.掌握分子轨道理论的根本内容。
4.了解分子间作用力及氢键的性质和特点。
[教学] 1.VSEPR 2.VB法 3.MO法[教学难点] MO法[教学时数] 6学时[主要内容]1.共价键:价键理论-电子配对法〔本质,要点,饱和性,方向性,类型σ键、π键〕。
2.VSEPR:价电子互斥理论的提出,价电子互斥理论的根本要点以及用价电子互斥理论分析各类分子和原子团的空间构型。
3.杂化轨道理论:杂化轨道理论的提出,杂化轨道理论的根本要点,杂化轨道的类型-sp、spd各种类型及举例。
4.分子轨道理论:分子轨道理论的根本要点,分子轨道的能级图,实例-同核:H2、He、O2、F2、N2;异核:NO、HF。
5.共价键的属性:键长,键角,键能,键级。
6.分子间的作用力和氢键。
[教学内容]上一章主要研究的是原子的结构与性质,本章进一步讨论原子同原子之间和分子之间靠什么力结合在一起?分子有什么性质?具体的讲2-1 路易斯结构式一、弗兰克兰结构式到19时,化学家们已经知道了许多分子的成分,如氯化氢HCl、水H2O、二氧化碳CO2、氨NH3,并用短棍线“—〞的形式来描述分子子之间的相互结合“1价〞,还总结出一些规律。
其中英国化学家弗兰克兰和瑞典化学家贝采尼乌斯奉献较大。
这些表达方式,在我们化学课本中还在沿用。
二、路易斯结构式19的著名化学家〔加里福尼亚教授〕路易斯利用原子结构知识对弗兰克兰结构式的短棍线“—〞进行了解释,即“—〞代表一对共用电子对,= 代表两对共用电子对,≡代表三对共用电子对,并进一步提出了键合电子和孤对电子的概念以及分子结构稳性的“八隅律〞—原子倾向于通过共用电子对使它们的最外层到达稀有气体的8电子稳构型。
1923年路易斯进一步将化合物分子中两个原子在一起的共享电子对称为共价键,从而建立了路易斯共价键理论。
分子轨道、原子轨道、价键理论、杂化轨道、VSEPR模型、波函数有什么联系与区别,哪种理论更好?这几个概念不在一个层次上。
波函数是最基本的量子力学概念,原子轨道是直接用量子力学计算原子中电子分布的结果。
分子轨道、价键理论、杂化轨道、VSEPR模型这四个是量子力学应用在计算分子结构上建立的理论模型。
如果拿来比较,只能比较这后四种,因为它们都属于量子化学的理论。
但波函数和原子轨道是物理学概念,是另外四个概念的基础,而且波函数更是基础中的基础,不能拿来和它们比较。
下面由浅入深比较一下VSEPR模型、价键理论、杂化轨道、分子轨道这四种理论模型。
VSEPR模型全称是价层电子对互斥模型,是一种利用量子力学的结论定性分析的方法。
首先以原子轨道为基础,再求出价电子之间的排斥力取最小值的分布,推导出分子结构。
该方法以定性为主,计算量比较小,精确性最低。
价键理论是进一步用到量子力学做精确计算分子结构,也是以原子轨道为基础,只把价电子当成两个原子共有的电子,直接解它们的定态薛定谔方程。
这是量子化学的第一代计算方法。
杂化轨道理论是价键理论的升级和补充,即当价电子比较多的情况时,并且能量比较接近时,价键理论的精确性就不够了,需要把形成分子时原来的原子轨道之间的交叉融合考虑进去。
这是量子化学的第1.5代计算方法。
分子轨道理论是最精确的用量子力学求解分子结构的方法。
它不再以原子轨道为基础,而是深入到和原子轨道一样的“从头计算”,即把所有电子,不管是价电子还是内层电子,都当成是分子里面所有原子核共有的,而不再局限于某个原子。
尽管它的产生历史不比价键理论晚,但是因为模型过于复杂,只能做较大的近似,所以一度和价键理论及杂化轨道理论相竞争。
直到出现了计算机,分子轨道理论胜出,成为量子化学的第二代计算方法。
简单来说就是精确性:分子轨道>杂化轨道>价键理论> VSEPR模型。
简洁易用性: VSEPR模型>价键理论>杂化轨道>分子轨道。
有机化学常见问题解答1. 价键理论、分子轨道理论有什么区别?[解答] 价键理论、分子轨道理论是目前关于共价键形成、本质的两个主要理论。
它们的不同之处在于价键理论是定域的,主要讨论两个原子之间的电子配对成键情况。
而分子轨道是以电子离域的观点为基础的。
在电子离域的共轭体系中,用分子分子轨道理论讨论问题可以避免价键理论定域的缺陷。
2. 异丁烷一元氯代时,产生如下两种可能异构体:3. 其异构体的相对含量是否与自由基稳定性相矛盾?[解答]:不矛盾。
反应活性是相对的。
叔丁烷中,叔氢有9个而甲基氢只有1个,甲基氢和叔氢的相对反应活性:25/9∶75/1≈1∶27。
说明叔氢的反应活性更大。
与自由基稳定性一致。
另外,氯原子比较活泼,氯代的选择性比较差,几率因素起作用较大。
如溴代时,溴原子的活性较低,反应的第一步是吸热的,所以选择性更好,主要是活性大的叔氢被取代。
4. 烯烃加溴是反式加成,其他加成也是反式吗?[解答]:不一定。
亲电加成反应是分步进行的,首先与亲电试剂反应,生成正离子活性中间体。
烯烃加溴,通常认为是经过环状溴翁离子中间体进行的,所以得到反式加成的结果:其他的加成反应并不一定经过环状中间体的过程,比如加 HBr ,首先得到碳正离子活性中间体:Cl2 可以形成翁离子,也可以形成碳正离子活性中间体,所以产物为顺式和反式两种产物。
5. 丙烯与氯气高温下反应,主要产物为α -H的氯代产物(A),为什么不产生亲电加成产物(B)?[解答]:烯烃与卤素在低温或无光照条件下,在液相中主要发生亲电加成反应。
在高温或光照条件下,主要发生自由基取代反应,一般取代在双键的α-H上。
这主要由于C—Cl键键能较小,高温下容易断裂而使反应可逆。
同时,取代反应的活性中间体更稳定。
6. 乙烯、丙烯、异丁烯在酸催化下与水加成,其反应速度哪个最快?为什么?[解答]:乙烯 < 丙烯 < 异丁烯。
决定于活性中间体碳正离子的稳定性次序。
【高中化学】价键理论、分子轨道理论的区别
分子轨道理论认为原子在相互结合形成共价键时,由原子轨道组成分子轨道,分子轨道属于整个分子。
而价键理论比较简单和粗糙。
分子轨道理论是现代共价键理论的一个分支。
其与现代共价键理论的重要区别在于,分子轨道理论认为原子轨道组合成分子轨道,电子在分子轨道中填充、运动。
而现代共价键理论则讨论原子轨道,认为电子在原子轨道中运动。
高中化学
分子轨道理论
分子轨道理论偏难,建议高中学生仅作了解。
我们把原子通过共用电子对结合的化学键成为共价键(covalent bond)。
路易斯(G.N.Lewis)曾经提出原子共用电子对成键的概念,也就是俗称的“八隅律”(高中阶段也只是停留于此)
然而,我们知道很多现实情况都无法用八隅率解释,包括:PCl5,SCl6分子。
更重要的是,八隅率从来没有本质上说明共价键的成因:为什么带负电荷的两个分子不会排斥反而是互相配对?
随着近代的量子力学(quantum mechanics)的建立,近代形成了两种现代共价键理论,即是:现代价键理(valence bond theory)简称VB(又叫作电子配对法)以及分子轨道理论(molecular orbital theory)简称MO。
价键理论强调了电子对键和成键电子的离域,有了明确的键的概念。
也成功的给出了一些键的性质以及分子结构的直观图像。
但是在解释 H2+氢分子离子的单电子键的存在以及养分子等有顺磁性或者大∏键的某些分
子结构时感到困难。
而分子轨道理论可以完美的进行解释,这里我就主要阐述MO法的相
关理论。
洪特(Hund)和密里肯(R.S Mulliken)等人提出了新的化学键理论,即是分子轨道
理论。
这是人们利用量子力学处理氢分子离子而发展起来的。
(一)氢分子离子的成键理论
氢分子离子(H2+)是由两个核以及一个电子组成的最简单分子,虽然不稳定,但是
确实存在。
如何从理论上说明氢分子离子的形成呢?分子轨道理论把氢分子离子作为一个整体
处理,认为电子是在两个氢核a和b组成的势场当中运动。
电子运动的轨道既不局限在
氢核a的周围,也不会局限于氢核b的周围,而是遍及氢核a和b。
这种遍及分子所有核
的周围的电子轨道,成为“分子轨道”。
如何形成这样的分子轨道呢?我们必须通过波函数来描述原子当中的运动状态,而
波函数势薛定谔方程的解。
因为得到精确的薛定谔方程的解势很困难的因此我们才去了近
似方法,假设分子轨道是各个原子轨道的组成。
仍然以氢分子离子为例:当这个单电子
出现了一个氢原子核a附近时候,分子轨道Ψ很近似于一个院子轨道Ψa。
同样,这个
电子出现在另外一个氢原子b附近时候,分子轨道Ψ也很像原子轨道Ψb。
不过这个只是两种极端情况,合理的应该是两种极端情况的组合即是Ψa与Ψb的组合。
分子轨道理
论假定了分子轨道是所属原子轨道的线性组合(linear combination of atomic orbital,简称LCAO),即是相加相减而得得。
例如氢分子离子当中就有:
ΨI=Ψa+Ψb
ΨII=Ψa-Ψb
其中Ψa和Ψb分别是氢原子a以及氢原子b得1s原子轨道。
它们的相加相减分别可以得到ΨI以及ΨII。
相加可以看出处在相同相位的两个电子波组合时候波峰叠加,这样可以使得波增强。
如果两个波函数相减,等于加上一个负的波函数,因此相减可以看成是有相反相位的两个电子波组合时的波峰叠加,这样似的波消弱或者抵消。
故在ΨI 当中,波函数数值和电子出现的几率密度在两个核当中明显增大,相应的能量比氢原子1s 轨道能量低,进入这个轨道的电子将促进这个两个原子的结合因此成为“成键轨道”(bonding orbital),用δ1s表示。
ΨII当中的波函数值在两核中间为零,电子在两核出现的几率很小,甚至为0,其电子能量高于氢原子的1s轨道,进入这个轨道的电子将促使这个两个原子分离,所以称为反键轨道(antibonding orbital)用δ1s*表示。
(图1)ΨI以及ΨII原子轨道能量之差基本相同,符号相反。
用轨道能级图表示(图2)如果两个原子轨道的能量不一样高,则它们所组成的分子轨道中,能量低的成键轨道比原来能量低的原子轨道的能量还低;能量高的反键轨道比原来能量高的原子轨道能量还高。
从氢分子离子的形成可以得出分子轨道理论是着眼于整个分子,把分子作为一个
整体来考虑。
分子当中的电子是在多个原子核以及电子的综合势场中运动。
因此没有明确的“键”的概念。
现在将分子轨道理论扼要的介绍如下:
1。
分子当中的电子在遍及整个分子范围内运动,每一个电子的运动状态都可以用一个分子波函数(或者称为分子轨道)Ψ来描述。
|Ψ|^2表示了电子在空间各处出现的几率密度。
感谢您的阅读,祝您生活愉快。