几种常见的盐
- 格式:ppt
- 大小:14.80 MB
- 文档页数:35


盐的复习一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明: 盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离: 以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐: 只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32- 电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。

常见的盐一、几种常见的盐1、氯化钠—NaCl—食言(1)物理性质:白色固体,易溶于水,pH=7;区别:工业盐≠食言NaNO2,有毒性,显碱性;(2)用途:调味品,生理盐水0.9%,重要的工业原料(可制备NaOH、Cl2、HCl、Na2CO3等)2、碳酸钠—Na2CO3—苏打、纯碱(1)物理性质:白色粉末,易溶于水,水溶液呈碱性,pH>7;区别:Na2CO3≠Na2CO3·10H2O(室温下干燥失去结晶水)碳酸钠晶体、十水碳酸钠Na2CO3·10H2O=Na2CO3+10H2O(化学反应)(2)用途:重要的工业原料,洗涤、纺织,制玻璃,食品工业。
3、碳酸钙—CaCO3—大理石、石灰石(1)物理性质:白色固体、难溶于水;(2)用途:重要的建筑材料,制备CO2,补钙剂;4、碳酸氢钠—NaHCO3—小苏打(1)物理性质:白色粉末,易溶于水,pH>7;(2)用途:发酵粉,用于中和胃酸。
5、硫酸铜—CuSO4(无水硫酸铜,白色粉末)硫酸铜晶体—CuSO4·5H2O—蓝矾、胆矾,蓝色晶体。
(蓝色晶体,五水硫酸铜)鉴别物质中是否含有水。
用途:炼铜、镀铜,配制波尔多液。
二、盐的通性1、盐和金属的反应盐+金属=新盐+新金属(溶液)(溶液)CuSO4+Fe=Cu+FeSO43CuSO4+2Al=3Cu+Al2(SO4)32、盐+酸=新盐+新酸(CO32-和可溶性盐)(生成沉淀、气体、水)CaCO3+2HCl=CaCl2+H2O+CO2HCl+AgNO3=AgCl+HNO33、盐+碱=新盐+新碱(可溶性盐和碱)(生成沉淀、气体、水)Ca(OH)2+Na2CO3=CaCO3+2NaOHNH4Cl+NaOH=NaCl+NH3+H2O(铵盐不能和碱共存)4、盐1+盐2=盐3+盐4(溶液)(其中一个必须是难溶性的)AgNO3+NaCl=AgCl+NaNO3BaCl2+Na2SO4=BaSO4+2NaClBa(NO3)2+CaCO3=??KNO3+NaCl=??。



几种常见的盐(一)1.氯化钠(NaCl)粗盐因含有MgCl2、CaCl2等杂质,会吸收空气里的水分而潮解。
熔点801℃,沸点1413℃。
用途:重要的化工原料,可用于制取钠、氢气、氢氧化钠、盐酸、纯碱等化工产品。
2.碳酸钠(Na2CO3)在工业中称为纯碱,因为和水反应,呈碱性。
白色粉末状物质,以溶于水。
当它从溶液里结晶析出时,晶体里结合着一定数目的水分子,这样的水分子叫结晶水,含有结晶水的物质叫结晶水合物。
碳酸钠晶体化学式Na2CO3·10H2O※常温是在干燥的空气里,碳酸钠晶体能逐渐失去结晶水而成为粉末,这种现象叫做风化。
(化学变化) Na2CO3·10H2O==Na2CO3+10H2O盐湖——天然碱(口碱)用途:化学工业重要产品之一,广泛应用于玻璃、造纸、纺织、洗涤剂工业上。
3.硫酸铜(CuSO4)无水硫酸铜是一种白色固体,能溶于水,水溶液呈蓝色,俗称胆矾或蓝矾,含有结晶水(CuSO4·5H2O)受热又能失去结晶水成为白色的CuSO4。
CuSO4·5H2O==CuSO4+5H2O(分解反应)条件加热CuSO4+5H2O==CuSO4·5H2O用途:农业上作杀虫剂(波尔多液:CaO、CuSO4),工业上炼铜。
(二)盐的分类和命名1.正盐酸和碱完全中和的产物。
(NaCl、Na2CO3、CuSO4)命名:非金属元素和金属元素名称中间加一“化”字,叫“某化某”。
(无氧酸盐NaCl)酸名称后加金属的名称,叫“某酸某”。
(含氧酸盐Na2SO4)※如果一种金属元素具有多种化合价,对于含低价的金属元素命名,可在前面加个“亚”字。
(硫酸钾K2SO4 硫酸亚钾K2SO3)2.酸式盐酸中的氢部分被中和的产物。
(NaHCO3、KHSO4)命名:在酸的名称后加“氢”(某酸氢某)Eg. NaHCO3碳酸氢钠(酸式碳酸钠) HCO3碳酸氢根离子如果酸式盐中含有2个可以电离的氢原子,命名时,可标明数字。




几种常见的盐
常见的盐种类有:
1. 食用盐:也称为食盐,一般指炼制后的精盐,主要成分为氯化钠。
食用盐可以分为普通食盐和岩石食盐等。
2. 海盐:是从海水中提取的盐,含有丰富的矿物质,比普通食用盐含有更多的微量元素。
3. 粗盐:是颗粒较大、未经加工的盐,一般用于烹饪和腌制。
4. 粉盐:是将普通食盐经过粉碎而成的细粉末盐,常用于制作调味品和调味酱。
5. 工业盐:用于工业生产或特殊行业,如化学、冶金等领域的盐。
6. 粒状盐:常见的有岩盐、湖盐、井盐等,形状不规则。
生活中常见的盐【主要内容】生活中常见的盐及其化学性质一、盐的分类根据盐的组成不同,如按盐组成中的阳离子或阴离子的名称,一般有如下的分类:钠盐:NaCl、Na2CO3、Na2SO4、Na2S等。
钾盐:K2CO3、KNO3、KCl等。
硫酸盐:CuSO4、K2SO4、(NH4)2SO4等。
碳酸盐:Na2CO3、K2CO3、(NH4)2CO3等。
盐的分类方法还有很多种,例如:酸式盐、碱式盐和正盐;含氧酸盐和无氧酸盐;强酸弱碱盐、强碱弱酸盐、强酸强碱盐和弱酸弱碱盐等。
二、生活中常见的盐1.氯化钠(重要的调味品,食盐的主要成分是NaCl)(1)物理性质:白色晶体,易溶于水,有咸味。
(2)在人的正常生理过程中的作用:人体中的氯化钠都是以离子的形式存在于体液中,钠离子对于维持细胞内外正常水分分布和促进细胞内外物质的交换起主要作用;氯离子是胃液的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
人体正常每人每天约需 3 g~5 g食盐。
但长期食用过多食盐不利于人体健康。
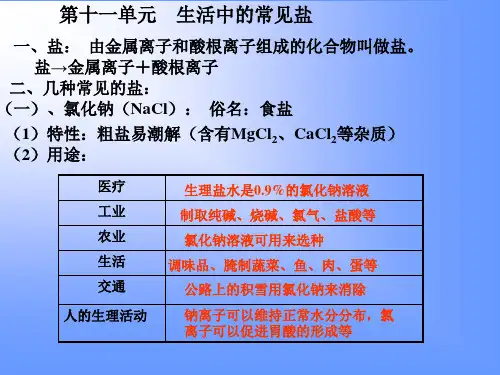
(3)存在:海水、盐湖、盐井、盐矿(4)用途:①医疗上的生理盐水(质量分数为0.9%)②用来制备Na2CO3、NaOH、Cl2、HCl等物质;③食品的调味剂,腌渍蔬菜等;④公路积雪可以用氯化钠消除;⑤农业上利用氯化钠溶液来选种。
粗盐的提纯:(1)溶解-------使用的仪器:烧杯、玻璃棒、药匙玻璃棒的作用:加快溶解速率,不能提高物质的溶解度操作要点:搅拌时玻璃棒不能接触烧杯壁(2)过滤------使用的仪器:漏斗、铁架台(带铁圈)、玻璃棒、烧杯玻璃棒的作用:引流操作要点:一贴、二低、三靠(3)蒸发-------使用的仪器:蒸发皿、铁架台(带铁圈)、玻璃棒、酒精灯、坩埚钳玻璃棒的作用:防止液体局部过热而引起液滴飞溅操作要点:当蒸发皿中出现较多固体时,即停止加热,利用余热使液体全部挥发。
*如果有转移操作:最后在转移固体时,玻璃棒起到转移的作用。
2.碳酸钙(化学式为CaCO3)(1)物理性质:碳酸钙是一种白色晶体或粉末状固体,难溶于水(25℃在水中的溶解度为6.9×10-4g)(2)存在:自然界广泛存在的石灰石、大理石、方解石、白垩以及珍珠、珊瑚等主要成分都是碳酸钙。