结构化学第5章--晶体结构-5-01
- 格式:ppt
- 大小:6.64 MB
- 文档页数:25


目录第一章答案----------------------------------------------------------------------------1 第二章答案---------------------------------------------------------------------------26 第三章答案---------------------------------------------------------------------------47 第四章答案---------------------------------------------------------------------------63 第五章答案---------------------------------------------------------------------------711《结构化学》第一章习题答案1001 (D) 1002 E =h ν p =h /λ 1003,mvh p h ==λ 小 1004 电子概率密度 1005 1-241-9--34s kg m 10626.6s kg m 100.1106.626⋅⋅⨯=⋅⋅⨯⨯==-λhp T = m p 22 = 3123410109.92)10626.6(--⨯⨯⨯ J = 2.410×10-17J 1006 T = h ν- h ν0=λhc -0λhcT = (1/2) mv 2 v =)11(20λλ-m hc = 6.03×105 m ·s -11007 (1/2)mv 2= h ν - W 0 = hc /λ - W 0 = 2.06×10-19 J v = 6.73×105 m/s 1008 λ = 1.226×10-9m/10000= 1.226×10-11 m 1009 (B) 1010 A,B 两步都是对的, A 中v 是自由粒子的运动速率, 它不等于实物波的传播速率u , C 中用了λ= v /ν,这就错了。






结构化学基础第5章第5章:原子中的电子结构导言:原子是化学物质的最小单位,其中电子的位置和运动对于化学行为和反应至关重要。
本章将介绍原子中电子的定量描述和排布方式,包括原子光谱和波粒二象性。
了解原子中电子结构的基本原理对于理解化学反应和物质性质具有重要意义。
一、原子光谱原子光谱是指原子从高能态跃迁到低能态时所放出的电磁辐射。
通过分析光谱,可以获取原子的能级结构以及电子在这些能级上的分布情况。
1.有线光谱:原子在外部加电场的作用下,电子会从低能态跃迁到高能态,形成有线光谱。
2.发射光谱:原子从高能态跃迁到低能态放出的电磁辐射,形成发射光谱,常见的有氢原子发射光谱。
3.吸收光谱:原子吸收外部归来的电磁波而产生的吸收光谱。
二、电子的波粒二象性1.普朗克常数:普朗克提出了能量量子化的概念,即能量是离散的,其中普朗克常数h约为6.63×10-34J·s。
2.德布罗意假说:德布罗意将量子理论应用于电子,提出了电子也具有波粒二象性。
3.不确定性原理:由海森堡提出的不确定性原理,意味着无法同时确切知道粒子的位置和速度。
4.薛定谔方程:由薛定谔提出的薛定谔方程描述了电子波函数的演化和电子在原子中的概率分布。
三、原子中的电子排布1.玻尔理论:玻尔提出了玻尔理论,认为原子中的电子按照一定能级排布,电子围绕着原子核旋转并且只能在特定轨道上运动。
2.能级和轨道:原子中的能级对应着电子的不同能量状态,而轨道是描述电子位置和运动方式的函数。
3.电子构型:电子构型是指描述原子中所有电子排布情况的表示方式。
使用核外电子层和轨道的符号来表示电子构型,例如氢原子的构型为1s14.周期表和电子排布规则:理解电子排布规则对于理解元素周期表上的周期性趋势和元素性质至关重要。
结论:原子中电子结构的研究是化学的基础,通过光谱和波粒二象性的研究,我们可以了解到原子中电子的能级结构和分布情况。
电子的波粒二象性使得我们无法准确确定其位置和速度,而原子中的电子排布则决定了元素的周期性行为和性质。


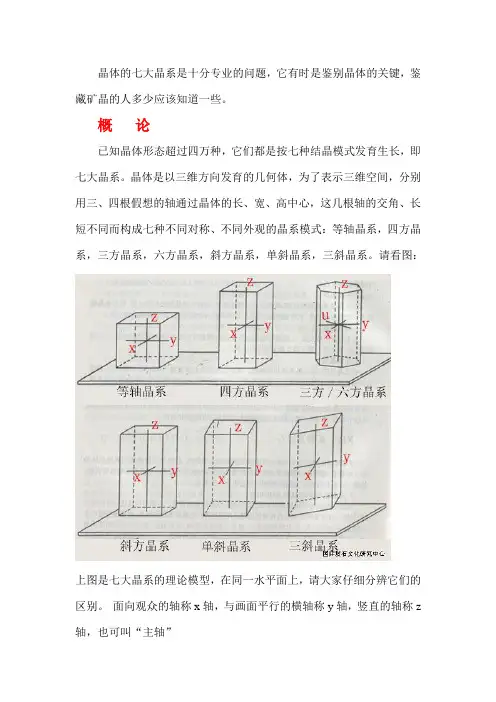
晶体的七大晶系是十分专业的问题,它有时是鉴别晶体的关键,鉴藏矿晶的人多少应该知道一些。
概论已知晶体形态超过四万种,它们都是按七种结晶模式发育生长,即七大晶系。
晶体是以三维方向发育的几何体,为了表示三维空间,分别用三、四根假想的轴通过晶体的长、宽、高中心,这几根轴的交角、长短不同而构成七种不同对称、不同外观的晶系模式:等轴晶系,四方晶系,三方晶系,六方晶系,斜方晶系,单斜晶系,三斜晶系。
请看图:上图是七大晶系的理论模型,在同一水平面上,请大家仔细分辨它们的区别。
面向观众的轴称x轴,与画面平行的横轴称y轴,竖直的轴称z 轴,也可叫“主轴”一,等轴晶系简介等轴晶系的三个轴长度一样,且相互垂直,对称性最强。
这个晶系的晶体通俗地说就是方块状、几何球状,从不同的角度看高低宽窄差不多。
如正方体、八面体、四面体、菱形十二面体等,它们的相对晶面和相邻晶面都相似,这种晶体的横截面和竖截面一样。
此晶系的矿物有黄铁矿、萤石、闪锌矿、石榴石,方铅矿等。
请看这种晶系的几种常见晶体的理论形态:等轴晶系的三个晶轴(x轴y轴z轴)一样长,互相垂直。
常见的等轴晶系的晶体模型图金刚石晶体八面体和立方体的聚形的方铅矿黄铁矿二,四方晶系简介四方晶系的三个晶轴相互垂直,其中两个水平轴(x轴、y轴)长度一样,但z轴的长度可长可短。
通俗地说,四方晶系的晶体大都是四棱的柱状体,(晶体横截面为正方形,但有时四个角会发育成小柱面,称“复四方”),有的是长柱体,有的是短柱体。
再,四方晶系四个柱面是对称的,即相邻和相对的柱面都一样,但和顶端不对称(不同形);所有主晶面交角都是九十度交角。
请看模型图:四方晶系的晶体如果z轴发育,它就是长柱状甚至针状;如果两个横轴(x 、y)发育大于竖轴z轴,那么该晶体就是四方板状,最有代表性的就是钼铅矿。
请看常见的一些四方晶系的晶体模型:这个晶系常见的矿物有锡石、鱼眼石、白钨矿、符山石、钼铅矿等。
请看实物图片:符山石的晶体锡石的长柱状晶体(顶端另有斜生的小晶体)。