第五章 晶体结构1
- 格式:ppt
- 大小:3.76 MB
- 文档页数:52
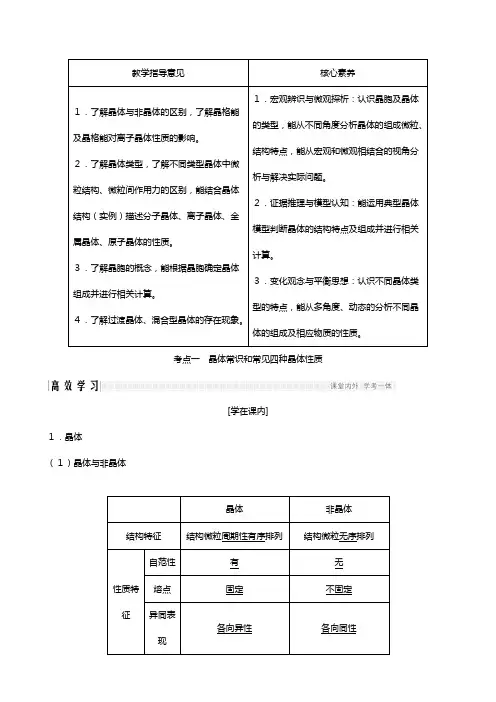
教学指导意见核心素养1.了解晶体与非晶体的区别,了解晶格能及晶格能对离子晶体性质的影响。
2.了解晶体类型,了解不同类型晶体中微粒结构、微粒间作用力的区别,能结合晶体结构(实例)描述分子晶体、离子晶体、金属晶体、原子晶体的性质。
3.了解晶胞的概念,能根据晶胞确定晶体组成并进行相关计算。
4.了解过渡晶体、混合型晶体的存在现象。
1.宏观辨识与微观探析:认识晶胞及晶体的类型,能从不同角度分析晶体的组成微粒、结构特点,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:能运用典型晶体模型判断晶体的结构特点及组成并进行相关计算。
3.变化观念与平衡思想:认识不同晶体类型的特点,能从多角度、动态的分析不同晶体的组成及相应物质的性质。
考点一晶体常识和常见四种晶体性质[学在课内]1.晶体(1)晶体与非晶体晶体非晶体结构特征结构微粒周期性有序排列结构微粒无序排列性质特征自范性有无熔点固定不固定异同表现各向异性各向同性对固体进行X射线衍射实验(2)得到晶体的途径1熔融态物质凝固。
2气态物质冷却不经液态直接凝固(凝华)。
3溶质从溶液中析出。
(3)晶胞1概念:描述晶体结构的基本单元。
2晶体中晶胞的排列——无隙并置A.无隙:相邻晶胞之间没有任何间隙。
B.并置:所有晶胞平行排列、取向相同。
(4)晶格能1定义:气态离子形成1摩尔离子晶体释放的能量,通常取正值,单位:kJ·mol—1。
2影响因素A.离子所带电荷数:离子所带电荷数越多,晶格能越大。
B.离子的半径:离子的半径越小,晶格能越大。
3与离子晶体性质的关系晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
[名师点拨](1)具有规则几何外形的固体不一定是晶体,如玻璃。
(2)晶胞是从晶体中“截取”出来具有代表性的“平行六面体”,但不一定是最小的“平行六面体”。
2.四种晶体类型的比较[考在课外]教材延伸判断正误(1)晶体和非晶体的本质区别是晶体中粒子在微观空间里呈周期性的有序排列。

第五章晶体结构第五章晶体结构⼀、单项选择题(每⼩题1分)1、NaCl 晶体的结构基元是()A 、⼀个N a +B 、⼀个正当晶胞C 、⼀个Na +和⼀个Cl -D 、4个N a +和⼀个Cl -2、有⼀AB 型离⼦晶体,若γ+/γ-=0.57,则正离⼦的配位数为()A 、4B 、6C 、8D 、123、某正交晶系的晶胞参数为a=500pm 、b=1000pm 、c=1500pm ,有⼀晶⾯在三个晶轴上的截长都是3000pm ,则该晶⾯的晶⾯指标为()A 、(321)B 、(632)C 、(236)D 、(123)4、AgF 属于NaCl 型晶体,⼀个晶胞中含有多少个Ag +?()A 、6B 、4C 、2D 、15、晶体的宏观对称操作的集合可以划分为多少个点群?()A 、8B 、32C 、14D 、76、已知⾦属Cs 为具有⽴⽅体⼼的晶胞,则其配位数为()A 、12B 、8C 、6D 、47、⽴⽅晶系中,下列哪种点阵型式不存在?()A 、⽴⽅P B 、体⼼I C 、底⼼C D 、⾯⼼F 8、根据正当单位选取原则,下列各组平⾯格⼦属于正当格⼦的组是()(1)正⽅的带⼼格⼦(2)六⽅带⼼格⼦(3)平⾏四边形的带⼼格⼦(4)矩形带⼼格⼦A 、(1)(3)(4)B 、(1)(2)(4)C 、(4)D 、(1)(3)9、空间点阵中下列形状不存在的是()A 、⽴⽅I B 、四⽅C C 、四⽅I D 、正交C 10、已知某⾦属的晶体结构属A 3型堆积,其原⼦半径为r ,则其晶胞的边长b 、c 等于()A 、b=2r ,c=42r/3B 、b=c=4r/3C 、b=4r/3,c=4r/2D 、b=c=4r/211、由实验确定Cu 属于⽴⽅⾯⼼结构,晶胞参数为a ,则Cu-Cu 键长等于()A 、2a/4B 、2a/2C 、3a/4D 、3a/212、已知钨属⽴⽅晶系,晶胞参数a=315.7pm ,密度ρ=1.9×104kg/m 3,分⼦量m=183.92,由此可推测该晶体是()A 、⽴⽅PB 、⽴⽅IC 、⽴⽅FD 、⽴⽅C 13、等经圆球作A 2型堆积,其密置列⽅向在()A 、a B 、b C 、c D 、a+b+c 14、KBr 晶体中K +的半径135pm ,KBr 的键长为328pm ,其负离⼦配位多⾯体的形状为()A 、直线型B 、正⽅形C 、四⾯体D 、⼋⾯体15、有⼀AB 晶胞、其中A 和B 原⼦的分数坐标为A (0,0,0),B (21,21,21),属于什么点阵?()A 、⽴⽅体⼼B 、⽴⽅⾯⼼C 、⽴⽅底⼼D 、简单⽴⽅16、(211)晶⾯表⽰了晶⾯在晶轴上的截距为()A 、2a 、b 、cB 、a 、2b 、2cC 、a 、b 、cD 、2a 、b 、2cE 、2a 、2b 、c 17、理想晶体不可能属于下列哪些点群?()A 、D 3h B 、D 5h C 、D 4h D 、D 6h18、在A 1型等经圆球密堆积中,密置层为()A 、(100)⾯B 、(110)⾯C 、(111)⾯D 、(210)⾯19、链型聚⼄烯的结构基元包括()A 、1C ,2H B 、2C ,4H C 、3C ,6H D 、2C ,3H 20、下列空间点阵的性质的论述哪条不对?()A 、空间点阵不论如何取法,素单位体积不变。


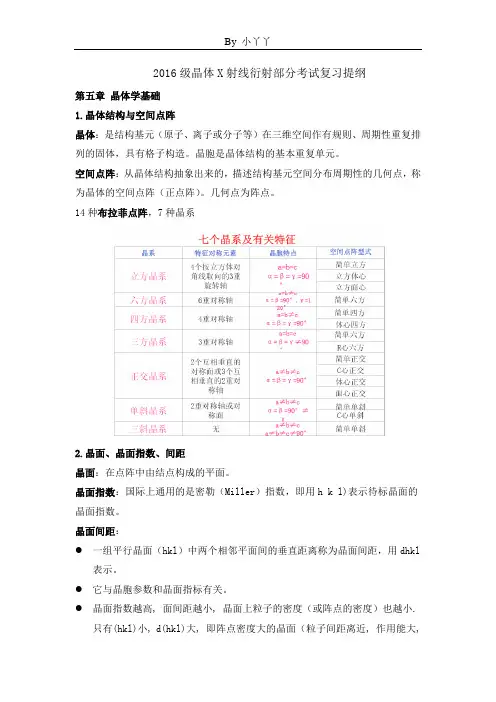
2016级晶体X射线衍射部分考试复习提纲第五章晶体学基础1.晶体结构与空间点阵晶体:是结构基元(原子、离子或分子等)在三维空间作有规则、周期性重复排列的固体,具有格子构造。
晶胞是晶体结构的基本重复单元。
空间点阵:从晶体结构抽象出来的,描述结构基元空间分布周期性的几何点,称为晶体的空间点阵(正点阵)。
几何点为阵点。
14种布拉菲点阵,7种晶系2.晶面、晶面指数、间距晶面:在点阵中由结点构成的平面。
晶面指数:国际上通用的是密勒(Miller)指数,即用h k l)表示待标晶面的晶面指数。
晶面间距:●一组平行晶面(hkl)中两个相邻平面间的垂直距离称为晶面间距,用dhkl表示。
●它与晶胞参数和晶面指标有关。
●晶面指数越高, 面间距越小, 晶面上粒子的密度(或阵点的密度)也越小.只有(hkl)小, d(hkl)大, 即阵点密度大的晶面(粒子间距离近, 作用能大,稳定)才能被保留下来。
3.晶面族:在同一晶体点阵中,有若干组晶面是可以通过一定的对称变化重复出现的等同晶面,它们的面间距与晶面上结点分布完全相同。
这些空间位向性质完全相同的晶面的集合,称为晶面族。
用{hkl}表示。
4.倒易点阵倒易点阵:是在晶体点阵的基础上按一定对应关系建立起来的空间几何图形,是晶体点阵的另一种表达形式。
为了区别有时把晶体点阵空间称为正空间。
倒易空间中的结点称为倒易点。
倒易矢量:从倒易点阵原点向任一倒易阵点所连接的矢量叫倒易矢量,表示为: r* = ha* + kb* + lc*倒易阵点用它所代表的晶面指数标定。
倒易矢量的基本性质:如果正点阵与倒易点阵具有同一坐标原点,则正点阵中的一个晶面在倒易点阵中就变成了一个阵点(倒易点)。
正点阵中晶面取向和面间距只须倒易矢量一个参量就能表示。
练习题:作业题:•在一正交晶系坐标中,画出(110)、(ī 05)、(ī ī 1)晶面。
•推算出立方晶系晶面(hkl)的面间距公式。
•画出七大晶系十四种布拉菲晶胞空间点阵形式。


2016级晶体X射线衍射部分考试复习提纲2016级晶体X射线衍射部分考试复习提纲第五章晶体学基础1.晶体结构与空间点阵晶体:是结构基元(原⼦、离⼦或分⼦等)在三维空间作有规则、周期性重复排列的固体,具有格⼦构造。
晶胞是晶体结构的基本重复单元。
空间点阵:从晶体结构抽象出来的,描述结构基元空间分布周期性的⼏何点,称为晶体的空间点阵(正点阵)。
⼏何点为阵点。
14种布拉菲点阵,7种晶系2.晶⾯、晶⾯指数、间距晶⾯:在点阵中由结点构成的平⾯。
晶⾯指数:国际上通⽤的是密勒(Miller)指数,即⽤h k l)表⽰待标晶⾯的晶⾯指数。
晶⾯间距:●⼀组平⾏晶⾯(hkl)中两个相邻平⾯间的垂直距离称为晶⾯间距,⽤dhkl表⽰。
●它与晶胞参数和晶⾯指标有关。
●晶⾯指数越⾼, ⾯间距越⼩, 晶⾯上粒⼦的密度(或阵点的密度)也越⼩.只有(hkl)⼩, d(hkl)⼤, 即阵点密度⼤的晶⾯(粒⼦间距离近, 作⽤能⼤,稳定)才能被保留下来。
3.晶⾯族:在同⼀晶体点阵中,有若⼲组晶⾯是可以通过⼀定的对称变化重复出现的等同晶⾯,它们的⾯间距与晶⾯上结点分布完全相同。
这些空间位向性质完全相同的晶⾯的集合,称为晶⾯族。
⽤{hkl}表⽰。
4.倒易点阵倒易点阵:是在晶体点阵的基础上按⼀定对应关系建⽴起来的空间⼏何图形,是晶体点阵的另⼀种表达形式。
为了区别有时把晶体点阵空间称为正空间。
倒易空间中的结点称为倒易点。
倒易⽮量:从倒易点阵原点向任⼀倒易阵点所连接的⽮量叫倒易⽮量,表⽰为: r* = ha* + kb* + lc*倒易阵点⽤它所代表的晶⾯指数标定。
倒易⽮量的基本性质:如果正点阵与倒易点阵具有同⼀坐标原点,则正点阵中的⼀个晶⾯在倒易点阵中就变成了⼀个阵点(倒易点)。
正点阵中晶⾯取向和⾯间距只须倒易⽮量⼀个参量就能表⽰。
练习题:作业题:在⼀正交晶系坐标中,画出(110)、(ī 05)、(ī ī 1)晶⾯。
推算出⽴⽅晶系晶⾯(hkl)的⾯间距公式。

第五章马氏体转变马氏体转变——当采用很快的冷却速度时(如水冷),奥氏体迅速过冷至不能进行扩散分解的低温M S点以下,此时得到的组织称为马氏体。
在转变过程中,铁原子和碳原子均不能扩散,因此其是一种非扩散型相变。
§5.1 马氏体转变的主要特征§5.2 钢中马氏体转变的晶体学§5.3 马氏体的组织形态及影响因素 §5.4 马氏体转变的热力学§5.5 马氏体转变动力学§5.6 马氏体的力学性能§5.1 马氏体转变的主要特征一、马氏体转变的非恒温性二、马氏体转变的共格性和表面浮凸现象三、马氏体转变的无扩散性四、具有特定的位向关系和惯习面五、马氏体转变的可逆性六、马氏体的亚结构一、马氏体转变的非恒温性马氏体转变开始点(M s)——必须将母相奥氏体以大于临界冷却速度的冷速过冷至某一温度以下才能发生马氏体转变,该转变温度即为M s。
马氏体转变终了点(M f)——当冷却至M s以下某一温度时,马氏体转变便不再继续进行,这个温度即为M f。
奥氏体被过冷至Ms点以下任一温度时,不需经过孕育,转变立即开始,且以极大速度进行,但转变很快停住,不能进行到终了。
为使转变能继续进行,必须降低温度,即马氏体转变是在不断降温的马氏体转变量是温度的函数,而与等温时间无关。
图5-2 马氏体转变量与温度的关系马氏体转变的非恒氏体二、马氏体转变的共格性和表面浮凸现象图5-3 钢因马氏体转变而产生的表面浮凸。
图5-4 马氏体浮凸示意图图5-5 马氏体和奥氏体切变共格交界面示意图马氏体与奥氏体之间界面上的原子既属于马氏体,又属于奥氏体,是共有的;并且整个相界面是互相牵制的,这种界面称之为“切变共格”界面。
三、马氏体转变的无扩散性马氏体转变的无扩散性:马氏体转变时只有点阵的改组而无成分的改变。
马氏体的成分与原奥氏体的成分完全一致,且碳原子在马氏体与奥氏体中相对于铁原子保持不变的间隙位置。

第五章 晶体结构安徽师范大学化学与材料科学学院§51晶体的点阵理论晶体具有按一定几何规律排列的内部结构,即晶 体由原子(离子、原子团或离子团)近似无限地、在三 维空间周期性地呈重复排列而成。
这种结构上的长 程有序,是晶体与气体、液体以及非晶态固体的本 质区别。
晶体的内部结构称为晶体结构。
1. 晶体的结构特征(1)均匀性(2) 各向异性(3) 自发形成多面体外形(4) 具有确定的熔点(5) 对称性(6) X射线衍射2.周期性下面两个图形均表现出周期性:沿直线方向,每 隔相同的距离,就会出现相同的图案。
如果在图形 中划出一个最小的重复单位(阴影部分所示),通 过平移,将该单位沿直线向两端周期性重复排列, 就构成了上面的图形。
最小重复单位的选择不是唯一的,例如,在图(a) 中,下面任何一个图案都可以作为最小的重复单位。
点的位置可以任意指定,可以在单位中或边缘的任 何位置,但一旦指定后,每个单位中的点的位置必须 相同。
如,不论点的位置如何选取,最后得到的一组点在空间 的取向以及相邻点的间距不会发生变化。
3.结构基元在晶体中,原子(离子、原子团或离子团)周期性地重 复排列。
上面我们在图形找出了最小的重复单位,类似 的,可以在晶体中划出结构基元。
结构基元是指晶体中 能够通过平移在空间重复排列的基本结构单位。
【例1】一维实例:在直线上等间距排列的原子。
一个原子组成一个结构基元,它同时也是基本的化学组成单位。
结构基元必须满足如下四个条件:化学组成相同;空间结构相 同;排列取向相同;周围环境相同。
【例2】一维实例:在伸展的聚乙烯链中,CH2CH2组成一个 结构基元,而不是CH2。
【例3】二维实例:层状石墨分子,其结构基元由两个C原子组 成(相邻的2个C原子的周围环境不同)。
结构基元可以有不同的选法,但其中的原子种类和数目应保 持不变。

一、填空题1、晶体按宏观对称操作构成32 个点群。
晶体按按微观对称操作构成230个空间群。
2、晶体按对称性共分为7 晶系。
14种空间点群。
晶体的空间点阵型式有230种。
晶体的宏观独立对称元素有8 种。
3、十四种空间点阵型式中,属于立方晶系的晶体可以抽象出的点阵型式有:简单、体心、面心,正交具有P、C、I、F型式,四方P、I型式,六方P型式,三方P、R型式,单斜P、C型式;三斜P型式。
4、A1(立方面心)A2(立方体心)A3(六方晶胞)A4(立方面心)型密堆积的空间占有率分别为74.05% 68.02% 74.05% 34.01%。
5、NaCl晶体的空间点阵型式为立方面心,结构基元为NaCl。
6、常用晶格能来表示离子键的强弱,用偶极矩来度量分子极性大小。
7、NaCl晶体中负离子的堆积型式为立方面心,正离子填入正八面体空隙中。
8、晶胞的二个要素:一是晶胞大小和型式,二是晶胞中原子位置。
衍射的二要素是:衍射方向和衍射强度。
9、在层状石墨分子形成的二维晶体中,其结构基元应包括2个C,3个C-C。
10、晶体化学定律晶体的结构型式,取决于其结构基元的数量关系,离子大小关系,极化作用。
11、晶体对称性定律:晶体中对称轴的轴次n,并不是任意的,而仅限于n=1,2,3,4,612、CsCl晶体中,两离子的分数坐标为111(0,0,0)(,,)22213、某AB型离子晶体的/0.53+-=,则晶体r r应属于结构。
14、晶面指标是指晶面在三晶轴上的倒易截数的互质整数比。
二、选择题1、估算下列化合物的熔点和硬度的变化次序正确的为(A )(A)KCl<NaCl<MgS<MgO<SiC (B)SiC<KCl<NaCl<MgO<MgS (C)KCl<NaCl<SiC<MgO<MgS (D)NaCl<KCl<MgO<MgS<SiC2、有一AB4型晶体,属立方晶系,每个晶胞中有1个A和4个B,1个A的坐标是(111,,222),4个B的坐标分别是(0,0,0);(11,,022);(11,0,22);(110,,22)。
晶面间距与晶格常数第五章 晶体的质点堆积与缺陷¾ 密堆积原理 ¾ 配位数和配位多面体 ¾ 化学键和晶格类型¾ 晶体的缺陷晶体化学晶体化学:研究晶体结构和晶体化学组成与其性质之间的关系和规律性的分支学科。
材料科学:晶体结构=空间点阵+基元Na+Cl-•晶体结构中的质点(阵点或基元)可以是原子、离子 或分子。
•晶体化学主要阐述这些质点的特性:离子类型、离子 和原子半径等; •讨论质点在组成晶体结构时的相互作用和规律:离子 或原子相互结合时的堆积方式和配位形式、键和晶格 类型。
z 理论半径:将原子或离子的电子云分布视为球形,其半 径为原子或离子的理论半径。
• 原子在形成化学键时,总要有一定程度的轨道重叠,而且 与不同的原子分别成化学键时,原子轨道重叠的程度又各 有不同,因此单纯地把原子半径理解成原子最外层电子到 原子核的距离是不严格的。
z 有效半径:以键长数据为基础,由实验方法得到的原子或 离子的半径,称为原子或离子的有效半径。
共价半径、金 属半径、范德华半径。
• 原子或离子半径的影响因素:价态、配位数、电子自旋态• 原子和离子半径的大小,特别是相对大小对晶体结构中的质 点的排列方式影响很大。
其对理解和阐明晶体结构类型的变化、 晶体化学组成的变异以及有关物理性质的变化都是非常重要的。
元素的原子半径和共价半径原子或离子半径的基本规律原子或离子半径的影响因素:价态、配位数、电子自旋态z 同种元素原子半径: 共价半径 < 金属原子半径 z 同种元素离子半径:阳离子半径小于原子半径,价态高半径小; 阴离子半径大于原子半径,负价高半径大; 氧化态相同,配位数高半径大; z 同族元素: 原子和离子半径随周期数增加而增大 z 同周期元素: 原子和离子半径随Z的增加而减小 z 从周期表左上到右下对角线上,阳离子半径近于相等 z 镧系和锕系:阳离子半径随Z增加而略有减小 z 通常, 阳离子半径都小于阴离子半径。